血管内皮细胞功能紊乱与动脉粥样硬化研究进展
2022-01-07张稣亚刘红霞何朝勇
张稣亚,刘红霞,何朝勇
(中国药科大学药学院,江苏 南京 210009)
血管内皮细胞是一种动态调节的细胞,在各种病理和生理过程中发挥着重要作用[1-2]。内皮细胞不仅是隔离血液和血管壁的屏障,而且通过释放一氧化氮(NO)和前列环素等生化因子,调节血管的结构与功能[3]。内皮细胞功能紊乱常发生在血流方向不一致的动脉分支或弯曲处,激活的内皮细胞能分泌大量黏附分子,如血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)、P-选择素和E-选择素等,招募血液中的白细胞和单核细胞浸润至内皮下层。单核细胞在内皮细胞或其他细胞分泌的巨噬细胞集落刺激因子(M-CSF)的作用下分化成巨噬细胞,通过吞噬氧化脂蛋白形成泡沫细胞(动脉粥样硬化脂纹期标志)[4],泡沫细胞最终死亡,并在斑块中形成由凋亡和坏死的细胞、胆固醇晶体和其他细胞外基质组成的坏死核心。随着平滑肌细胞增殖和迁移,纤维帽在斑块顶部形成,纤维帽变薄或破裂后,会发生血栓[5]。因此,内皮细胞功能紊乱会促进动脉粥样硬化的发生,同时内皮细胞功能障碍也被认为是动脉粥样硬化早期的重要病理学特征,保护血管内皮的正常功能有望成为心血管疾病治疗新策略。本文阐述导致内皮功能紊乱的因素及其机制,以及改善内皮功能的临床治疗策略,旨在为动脉粥样硬化的预防和治疗提供新思路。
1 血管内皮主要特征及微环境
血管内皮细胞位于血管的最内层,相邻内皮细胞间连接紧密,形成屏障,从而阻止血液中大分子物质的渗漏。内皮细胞下层为基膜,由层黏连蛋白和胶原等细胞外基质构成。在正常血管中,基膜蛋白可有效抑制内皮细胞中低血流剪切力诱导的核因子 κB(nuclear factor-κB,NF-κB)信号通路的激活,从而对内皮细胞发挥保护作用[6]。同时,基膜中的层黏连蛋白511(lamina 511)可促进内皮细胞紧密连接,抑制白细胞浸润[7]。此外,内皮细胞表面形成由糖胺聚糖、糖脂和糖蛋白等组成的凝胶网络,称为糖萼[8]。糖萼有利于调节血管渗透性,并且糖萼的厚度高于内皮细胞表达的黏附分子,可阻止炎性细胞黏附至内皮。在动脉粥样硬化斑块区域,糖萼厚度减少,导致内皮细胞表达的血管黏附分子暴露,增加炎症细胞浸润,加剧斑块形成[9]。抑制糖萼的主要成分透明质酸的合成,会增加白细胞浸润和局部炎症反应,促进动脉粥样硬化进程。由此可见,内皮细胞所处的血管微环境对内皮功能的维持有重要意义(见图1)。
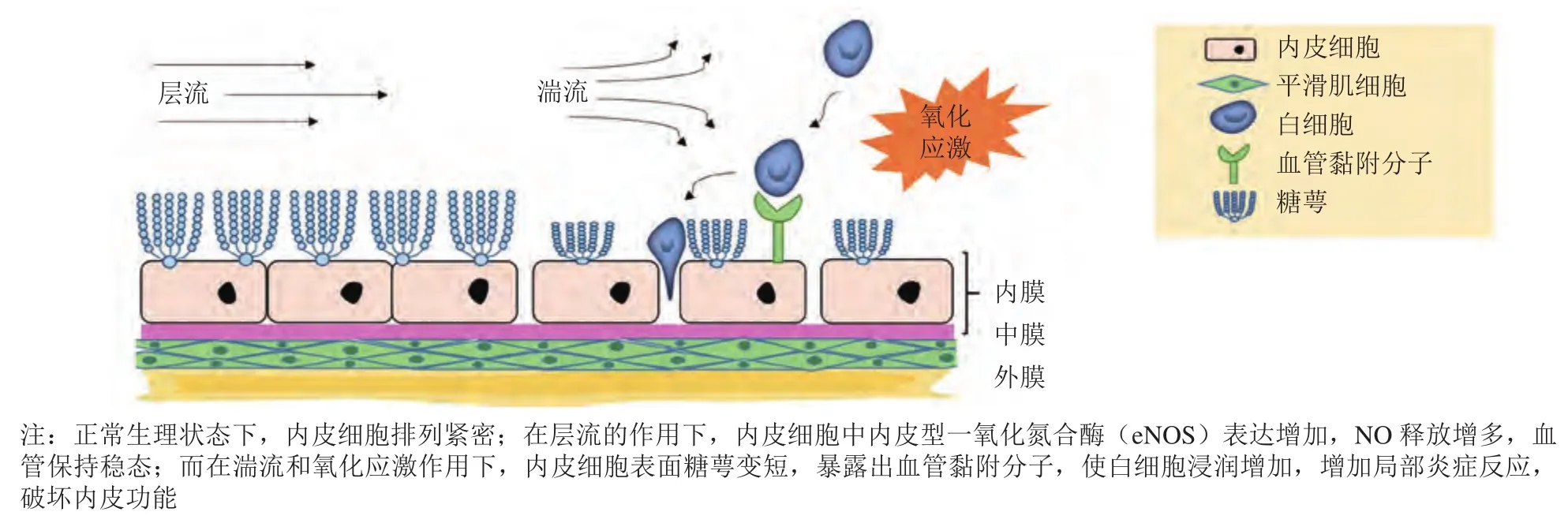
图1 血管结构及内皮功能紊乱Figure 1 Vascular structure and endothelial dysfunction
2 内皮细胞功能紊乱和动脉粥样硬化
Ludmer等[10]研究发现,在轻度冠状动脉疾病(coronary artery disease,CAD)和晚期CAD患者中均观察到内皮依赖性血管舒张障碍,说明内皮功能紊乱参与到动脉粥样硬化的整个发展过程。内皮功能紊乱有利于氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL)浸润至内皮下层,且分泌大量黏附因子招募白细胞和单核细胞至血管壁,引发局部炎症反应,进一步引起局部动脉粥样硬化斑块形成,因此,内皮细胞功能紊乱被认为是动脉粥样硬化早期病变的典型特征。此外,NO生物利用度下降、血管氧化应激、炎症反应、血管老化及血流动力学等因素均可诱导内皮细胞功能紊乱,下文将重点介绍这几个主要因素影响内皮细胞功能的具体机制。
2.1 NO与内皮细胞功能紊乱
血管内皮细胞主要通过合成和释放NO来调节血管结构与功能[3]。NO作为一种关键性的内皮源舒张因子(endothelium derived relaxing factor,EDRF),能够维持血管舒张和收缩平衡,调节血管张力。除此之外,NO在抗血小板聚集,炎症反应,血管平滑肌细胞增殖迁移,白细胞黏附和抗氧化等方面也发挥重要作用[11]。因此,许多病理刺激因素主要通过减少NO释放,降低内皮依赖性血管舒张功能来诱导内皮细胞功能紊乱。在血管内皮细胞,NO的合成主要受eNOS调节,eNOS通过催化L-精氨酸生成L-瓜氨酸的同时,释放NO。在此过程中,eNOS必须偶联辅助因子四氢生物喋呤(BH4)或Ca2+才能发挥其生物活性。在动脉粥样硬化疾病发生过程中,多因素刺激条件下,体内BH4水平因过氧亚硝酸盐或超氧化物的氧化降解而降低,进而导致eNOS解偶联,致使eNOS合成超氧化物而非NO,从而增加氧化应激,降低NO水平,降低血管内皮细胞的NO生物利用度,最终引起内皮细胞功能紊乱[12]。NO降低的另一个机制是受不对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)水平影响。有研究表明,在体外培养的人内皮细胞中,低浓度的ADMA便能抑制激动剂诱导的eNOS活性,导致eNOS解偶联,降低NO水平[13],因此,ADMA水平增加与体内NO水平降低密切相关。外源NO供体可以抑制由内皮细胞功能紊乱引起的动脉粥样硬化斑块发展,在预防和治疗动脉粥样硬化疾病方面具有很大潜力[14]。然而,内皮功能紊乱不仅限于NO依赖的功能受损,还涉及到其他大量血管活性介质的紊乱,包括糖萼破坏、内皮(血管)硬化、内皮通透性增加、内皮炎症及血栓和纤溶机制的改变等[15]。
2.2 氧化应激与内皮细胞功能紊乱
2.3 炎症与内皮细胞功能紊乱
由组胺和其他炎症因子引起的炎症急性反应被称为“内皮刺激”或“内皮细胞Ⅰ型激活”,这些反应较为迅速,限制性强,不会引起持续的形态学和功能学的改变[23]。内皮细胞对一些细菌产物,如革兰阴性内毒素(Gram-negative endotoxins)、病原相关的分子伴侣(pathogen associated molecular chaperones,PAMPs)、oxLDL、损坏相关分子伴侣(damage associated molecular chaperones,DAMPs)和细胞因子[如肿瘤坏死因子-ɑ(tumor necrosis factor-ɑ,TNF-ɑ)和干扰素-γ(interferon-γ,IFN-γ)]等引起不可逆的功能性改变,称为“内皮细胞Ⅱ型激活”[24]。内皮细胞Ⅱ型激活可促使经典的NF-κB信号通路的激活,而NF-κB能够调控大量参与动脉粥样硬化斑块起始和发展的基因表达,包括细胞因子(TNF-ɑ、IL-1、IL-6),黏附分子(VCAM-1、ICAM-1、E-选择素)和趋化因子(MCP-1)等,增加内皮细胞和白细胞等炎症细胞相互作用,促进动脉粥样硬化斑块内炎症反应[25-26]。相反,在动脉粥样硬化小鼠模型中内皮细胞特异性抑制NF-κB信号可抑制动脉粥样硬化斑块的发展[27]。
VCAM-1的发现是将内皮细胞促炎激活和动脉粥样硬化疾病联系起来的关键。一些动脉粥样硬化脂蛋白的主要成分,如溶血磷脂酰胆碱,可促进人和兔动脉内皮细胞VCMA-1的表达[28]。此外,在不同的动脉粥样硬化动物模型中,VCAM-1大多表达在有斑块形成的动脉血管区域[29]。在动脉粥样硬化小鼠模型中,敲除VCAM-1可有效降低小鼠动脉粥样硬化斑块面积,而敲除ICAM-1并没有明显改变斑块面积,说明VCAM-1在动脉粥样硬化中起主导作用[30]。在临床上,血清中可溶性VCAM-1亚型的水平与动脉粥样硬化患者的严重程度呈正相关[31]。这些发现强调了VCAM-1在动脉粥样硬化发展中的重要作用,同时也提示内皮细胞VCAM-1表达增加是内皮功能紊乱的一个分子标志。
动脉粥样硬化作为一种慢性炎症疾病,通过抑制炎性基因表达和减少血管壁炎性细胞募集,可有效保护内皮细胞功能,减缓动脉粥样硬化斑块发展,是临床治疗动脉粥样硬化的候选策略。
2.4 血流动力学异常与内皮细胞功能紊乱
在人和各种实验动物模型中可以观察到,动脉粥样硬化早期病变主要发生在动脉分支和其他受血流动力学影响的区域。内皮细胞具有机械传感能力,能响应局部血流剪切力的改变,介导细胞内的信号传导,从而改变细胞基因表达、细胞形态以及结构重塑[32]。在体内研究中,内皮细胞暴露于速度较快且方向单一的血流模式(又称层流,产生高血流剪切力)时,细胞形态表现为纺锤型,且长轴与血流方向平行;相反,速度较慢且方向紊乱的血流模式(又称湍流,产生低血流剪切力)下的内皮细胞更圆,且排布方向不统一[33]。
不同血流状态可以调节内皮细胞中不同机械敏感转录因子(mechanosensitive transcription factor,MSTF)表达,进而调节内皮细胞中的基因表达,使内皮细胞展现出不同的表型。如在湍流状态下,一些内皮保护性转录因子,如锌指样转录因子2(Kruppel-like factor,KLF2)、KLF4、核因子E2相关因子2(nuclear factor erythroid-derived factor2-related factor2,Nrf2)表达下调,而炎症相关转录因子NF-κB、核转录因子激活蛋白-1(activator protein-1,AP-1)、缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)等表达上调,最终使内皮细胞向促炎表型激活,致使内皮细胞功能紊乱[34]。相反,层流则对内皮细胞功能具有保护作用,在层流状态下,KLF2表达升高,通过腺苷酸活化蛋白激酶(AMP-activated kinase,AMPK)和microRNA(miR)-92a等信号级联反应,促进eNOS表达[35]。层流也可通过增加eNOS的辅助因子BH4和Ca2+的浓度,促进eNOS偶联,增加NO释放和NO生物利用度,起到内皮保护作用[36]。此外,血流剪切力可以通过调节VCAM-1的表达,调节内皮细胞与白细胞的黏附作用。低血流剪切力促进VCAM-1的表达,促进内皮细胞与白细胞的黏附,导致内皮细胞功能紊乱[37]。CCN1(又称CYR61)是一种基质细胞蛋白,已被报道在动脉粥样硬化斑块区域表达升高[38]。低血流剪切力可诱导CCN1表达增加,CCN1与其受体α6β1结合后促进内皮细胞NF-κB转录因子激活,从而促进动脉粥样硬化发生[39]。更有意思的是,低血流剪切力可通过促进内皮细胞表型转化(EndMT)诱导新内膜增生和内皮细胞功能紊乱,从而促进动脉粥样硬化发生[40]。血流剪切力还可通过调节其他因子,如miR-10a、碱性螺旋-环-螺旋转录因子1(TWIST1)和VE-钙黏蛋白等调节血管内皮细胞结构与功能。
2.5 血管老化与内皮细胞功能紊乱
血管老化是心血管疾病独立的危险因素,与动脉硬化和内皮细胞功能紊乱密切相关。血管老化表现在线粒体氧化应激反应增加,炎症因子水平增加,血管渗透性增大,NO生物利用度下降,一些血管保护性细胞因子或蛋白,如Nrf2、eNOS、BH4、胰岛素样生长因子(IGF-1)等水平下调。老年人的血管更易发生动脉粥样硬化病变、血管损伤、新生血管畸形及钙化等[41]。因此,一些心血管疾病并发症,如冠状动脉疾病和卒中等更容易发生在老年人群。
越来越多的研究表明,血管老化伴随着ROS的产生和抗氧化酶作用之间的不平衡,这种不平衡可能通过增加血小板凝血活性,诱导内皮细胞功能紊乱[42]。血管老化还可诱导血管中致癌胚胎抗原相关细胞黏附分子1(CEACAM1)表达,增加血管氧化应激和血管纤维化,从而诱导内皮细胞功能紊乱,促进动脉粥样硬化发生[43]。老年患者的动脉粥样硬化斑块往往更大,血管狭窄增加,在这些斑块中,脂质和胶原不断积累,炎症增加[44]。除了氧化应激和炎症反应,其他在血管老化过程中导致内皮细胞功能紊乱的因素还包括不同类型细胞的凋亡和坏死。
大量研究表明,内源性的硫化氢(H2S)具有血管保护作用,它能通过促进血管舒张、调节血管通透性、上调抗氧化蛋白Nrf2表达等作用抗血管老化[45]。Sirtuin1(SIRT1)是Sirtuin蛋白家族的一员,是一种烟酰胺腺嘌呤二核苷酸(NAD)依赖的组蛋白去乙酰化酶,具有强大的抗血管老化的作用[46]。SIRT1被认为是最有前景的药物靶点,未来研究可评估Sirtuin蛋白激活的化合物对老年人心血管疾病的保护作用[46]。此外,血管老化相关的内皮细胞功能紊乱可通过运动来改善,运动给予内皮保护功能的分子机制较为复杂,可能是通过改善血管内氧化应激及炎症反应,保护线粒体功能等。
3 血管内皮细胞功能的循环标志物
通过研究循环血液中内皮细胞来源分子的水平,可以更广泛地了解内皮细胞的功能,包括内皮细胞被激活时的直接产物,如炎症细胞因子、黏附分子、血栓调节蛋白(thrombomodulin,TM)以及内皮损伤和修复的标志物。这些循环标志物(见表1)中有许多难以测量且成本高昂,目前仅用于临床研究。
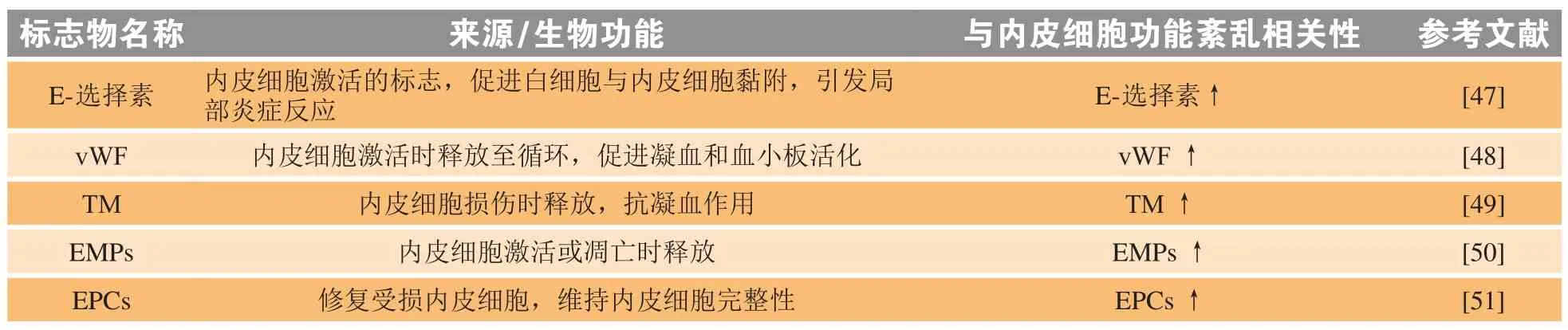
表1 血管内皮细胞功能的循环标志物Table 1 Circulating markers of vascular endothelial function
E-选择素在调节血管壁炎症和免疫方面具有重要作用,其在血清中的水平与内皮细胞激活和损坏程度相关[47]。血管性血友病因子(vWF)促进血小板与内皮细胞黏附,由损坏的内皮细胞释放,其在心血管疾病患者血清中的水平比正常人血清中的水平高,对于预测心血管疾病具有重要价值[48]。TM是一种由损伤的内皮细胞释放的抗凝血分子,其在外周循环中的水平可能是内皮损伤的标志[49]。内皮源微粒/微囊(EMPs)由激活或凋亡的内皮细胞释放,且在急性冠状动脉综合征的患者中,外周循环中EMPs水平增加与内皮功能紊乱相关,因此外周循环中EMPs水平的变化可用于预测内皮功能紊乱[50]。内皮细胞功能正常反映的是内皮损伤和修复之间的平衡,外周循环中内皮祖细胞(EPCs)可修复受损的内皮细胞,预防内皮功能紊乱。因此,血清中EPCs的增加被认为是预测内皮细胞损伤和修复的标志[51]。外周循环中成熟的内皮细胞在内皮细胞激活和完整性丧失的情况下脱落,可通过细胞大小和细胞表面标志物与EPCs进行区分。动脉粥样硬化和血管炎症患者外周循环中的成熟内皮细胞水平的增加,表明外周循环中这些细胞的数量与内皮损伤的程度有直接关系。
4 动脉粥样硬化临床治疗策略
内皮功能紊乱是动脉粥样硬化发生发展过程中的关键事件,临床可通过评估内皮功能,如内皮依赖性血管舒张反应是否正常,来预测动脉粥样硬化的发生。临床上常见的评估内皮功能的方法有:血流介导扩张技术(flow-mediated dilation,FMD)、脉搏波分析技术(pulse wave analysis,PWA)、激光多普勒血流仪(laser Doppler flowmetry,LDF)、磁共振成像技术(magnetic resonance imaging,MRI)等无创方法和冠状动脉定量造影等有创方法。
一些临床治疗方法通过改善内皮功能来预防和治疗动脉粥样硬化。临床常见的改善内皮功能的药物有他汀类药物、肾素/血管紧张素受体抑制剂(ACEIs/ARBs)、抗氧化剂、β受体阻滞剂、胰岛素增敏剂和NO供体等。他汀类药物现被认为是治疗动脉粥样硬化心血管患者的主要策略,可降低患者体内的低密度脂蛋白胆固醇,减少脂质沉积。也有临床实验表明,阿托伐他汀可以直接作用于血管壁,通过增加BH4和eNOS偶联,减少产生,增加NO生物利用度,从而改善内皮功能[52]。血管紧张素受体抑制剂和血管紧张素转化酶抑制剂可减少缓激肽代谢,导致内皮依赖性血管舒张,还可通过减少NADPH氧化酶激活,减少内皮细胞ROS生成,改善高胆固醇血症和冠状动脉疾病患者的内皮功能[53]。
此外,持续摄入膳食中的硝酸盐(如甜菜根汁富含硝酸盐)可改善高胆固醇血症患者的血管功能,从而预防动脉粥样硬化发生[54],但Gilchrist等[55]研究发现,服用甜菜根汁并未降低2型糖尿病患者的血压和改善内皮功能,因此,饮食摄入硝酸盐对不同疾病的患者内皮功能的改善作用还有待进一步研究。综上,上述临床应用药物对内皮功能均有改善作用,主要通过以下几个方面:1)直接或间接上调eNOS的表达,增加NO的生物利用度;2)减少内皮细胞内氧化应激;3)减少内皮细胞VCAM-1表达,减少炎症反应。
5 结语
血管内皮细胞形成血管的内壁,它能直接感受血流剪切力和炎症因子的刺激,在动脉粥样硬化的起始和发展过程中扮演重要角色。了解导致内皮功能紊乱的危险因素(见图2),寻找改善内皮功能的治疗策略,对预防和治疗动脉粥样硬化具有重要意义。目前,尽管在开发改善内皮功能的治疗策略方面做出了努力,但只有极少数方法显示出长期的治疗效益。他汀类药物、ACEIs/ARBs和噻唑烷二酮类药物治疗效果最符合期望,除了能够发挥正常降血脂、降血压和改善胰岛素抵抗的治疗作用外,它们还可以直接影响内皮并改善内皮功能。除了常规抗炎、抗氧化、增加NO生物利用度外,基因治疗也在研究探讨中。目前靶向内皮生长因子(VEGF)、eNOS、细胞外超氧化物歧化酶(SOD)等基因的治疗手段在动物模型中均取得较好的效果,但是还处在基础研究阶段。未来,还需要更深入地研究,以期寻找出更有效的监测和靶向内皮细胞功能的手段和治疗策略。
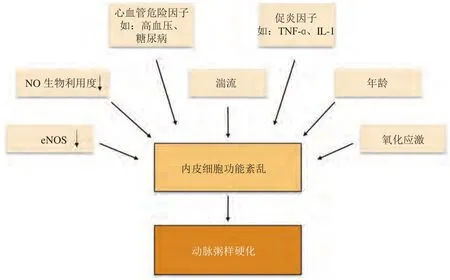
图2 内皮功能紊乱的病理生理刺激因素Figure 2 Pathophysiological stimulating factors of endothelial dysfunction
