肿瘤新生抗原疫苗研究新进展
2022-01-07苏比努尔阿不拉克张莉
苏比努尔·阿不拉克,张莉
(新疆医科大学第一附属医院综合内四科,新疆 乌鲁木齐 830054)
免疫治疗已成为多种恶性肿瘤的有效抗肿瘤治疗手段,包括免疫检查点阻断(immune checkpoint blockade,ICB)疗法和嵌合抗原受体T细胞(chimeric antigen receptors-modified T cells,CAR-T)疗法等,但其存在应答率低、靶点单一、副作用大、易复发等不足。随着抗肿瘤免疫机制研究的深入,肿瘤新生抗原成为免疫治疗研究的热点。肿瘤新生抗原由肿瘤体细胞突变产生,在正常细胞中不表达,可激活免疫细胞产生免疫应答;其免疫原性高、抗肿瘤免疫持续时间长、不易耐受;其靶点是肿瘤特异性抗原(tumor specific antigen,TSA),只杀伤肿瘤细胞,是一种个体化精准细胞免疫治疗。新生抗原疫苗相关研究显示,基于RNA、树突状细胞(dendritic cell,DC)、合成长肽的新生抗原疫苗能诱导新抗原特异性T细胞反应[1]。肿瘤新生抗原疫苗存在设计制备过程耗时长、成本高等缺点。目前,有关肿瘤新生抗原疫苗的研究,主要集中于候选分子的筛选及鉴定、可引起更强免疫应答的疫苗设计方案及制备方式、与其他传统治疗方式联用等。
1 肿瘤新生抗原的概念及免疫机制
1.1 肿瘤新生抗原的概念
基因突变会引起氨基酸序列的改变,氨基酸序列突变后的蛋白可能会在突变位置产生一个新的抗原表位,新生表位的抗原称为新生抗原[2]。肿瘤抗原主要有肿瘤相关抗原(tumor associated antigen,TAA)和TSA 2种[3]。其中,TSA包括肿瘤新生抗原,中枢对肿瘤新生抗原没有产生免疫耐受,故肿瘤新生抗原易于被免疫系统识别,产生T细胞免疫应答反应。新生抗原在正常组织内不表达,导致发生自身免疫疾病的概率低[4]。细胞周期依赖性激酶4(cyclin dependent kinase 4,CDK4)基因突变的产物是首个被发现的人类肿瘤新生抗原[5]。
1.2 肿瘤新生抗原免疫机制
人体免疫系统有监测能力,能激活机体对肿瘤的特异性免疫应答,发现并清除体内的肿瘤细胞,从而抑制肿瘤的生长及转移。国内研究团队证实,硝基化T细胞表位(NitraTh)可提高人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)疫苗在C57BL/6小鼠和人源化NCG小鼠中的免疫原性,该团队将NitraTh与HER2的细胞外结构域23 ~ 83融合产生的疫苗命名为HER2-NitraTh[6]。将该疫苗接种于异种移植模型小鼠上后可显著抑制C57BL/6小鼠HER2阳性肿瘤细胞的生长,可见NitraTh增强体液免疫和细胞免疫,并能抑制肿瘤生长,控制病情复发进展。肿瘤新生抗原引起肿瘤免疫反应的过程(见图1)包括:组织相容性复合体(major histocompatibility complex,MHC)分子表达新生抗原;抗原提呈细胞(antigen presenting cells,APC)识别新生抗原,并进行加工和呈递;T细胞受体(T cell receptor,TCR)特异性识别新生抗原,并与其结合;T细胞活化并增殖分化为效应T细胞,效应T细胞进一步抑制肿瘤生长[5]。
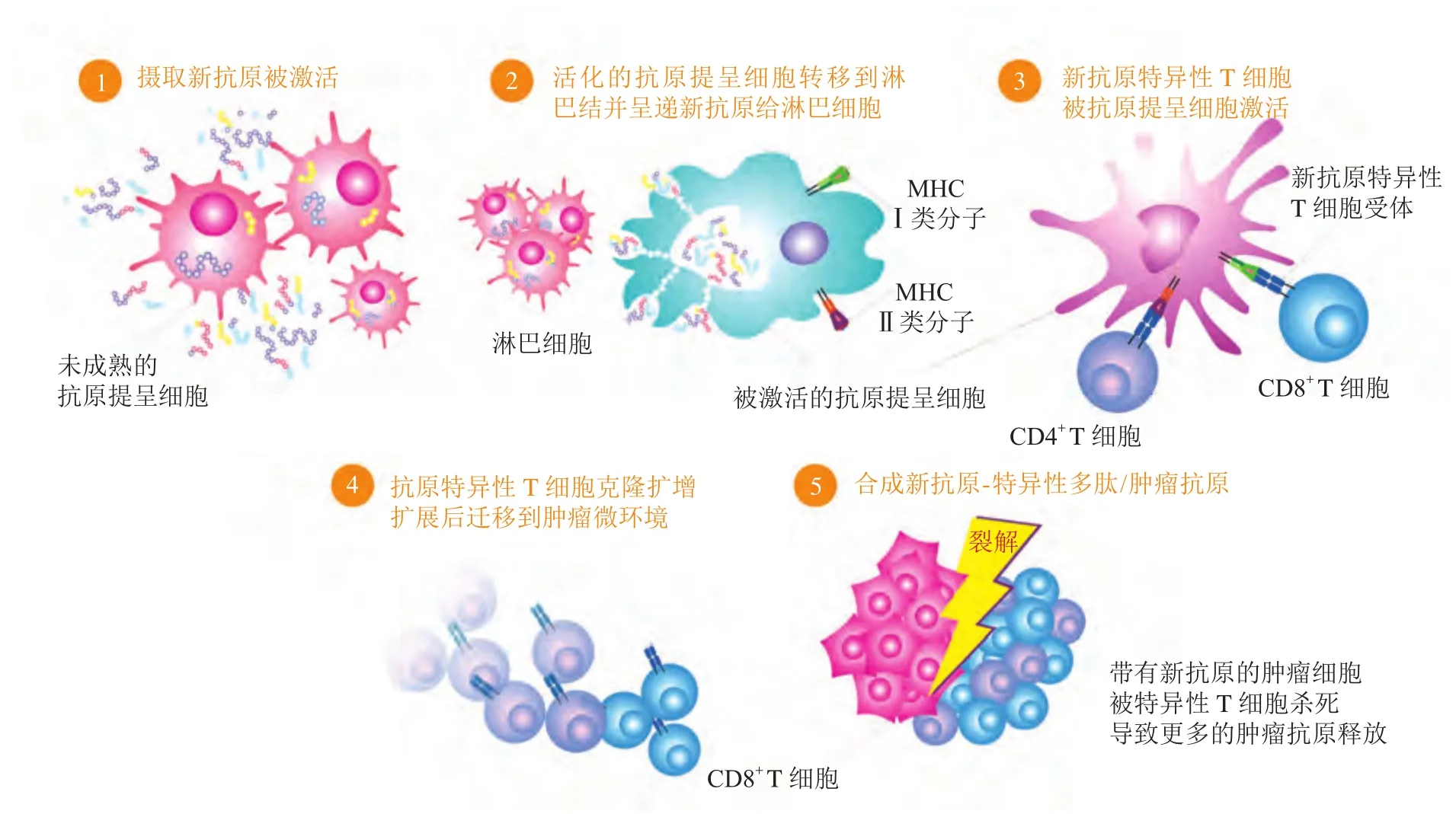
图1 肿瘤新生抗原的作用机制[7]Figure 1 Mechanism of action of tumor neoantigen
2 靶向新生抗原疫苗的种类及特点
2.1 DNA疫苗
DNA疫苗是一种基因疫苗(genetic vaccine),是将编码TSA的DNA片段与质粒DNA等载体通过基因工程技术结合后接种于个体,使个体表达特定抗原,诱导免疫应答[8]。与其他疫苗相比,DNA疫苗的设计成本低,易于高纯度规模化生产,其稳定性高、副作用较小,是较安全的可用疫苗[9]。
目前,针对恶性黑色素瘤的DNA疫苗研究较多。研究显示,DC靶向趋化因子(MIP3α)与黑色素瘤抗原Gp100的融合可显著增强小鼠黑色素瘤模型的免疫原性和存活率[10]。使用B16F10黑色素瘤同基因小鼠模型系统,并采用标准治疗方案,通过酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)和流式细胞术(flow cytometry,FCM)评估疫苗特异性T细胞反应,证实Gp100中加入MIP3α可以显著提高小鼠模型免疫原性[11]。与单纯抗原疫苗、非相关抗原疫苗和模拟疫苗相比,趋化因子融合疫苗可显著减轻肿瘤负荷(tumor load),减缓肿瘤生长,并提高小鼠总生存率;与模拟疫苗相比,单纯抗原和趋化因子融合疫苗诱导的CD4+T和CD8+T肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)水平显著升高[12]。研究认为,表达天然Endophilin-B2(EndoB2)的突变型Db/Sp244-252/R251H新表位的DNA疫苗能有效诱导接种小鼠的Db/Sp244-252/R251H特异性效应子CD8+T细胞[13]。编码肿瘤相关自我抗原的DNA疫苗已成功应用于诱导肿瘤特异性免疫应答反应[14]。
2.2 RNA疫苗
RNA疫苗也属于基因疫苗,是将编码TSA的外源基因导入个体内,通过免疫系统合成TSA蛋白,诱导机体产生免疫应答。RNA疫苗的制备原理与DNA疫苗相似。近几年,信使RNA(messenger RNA,mRNA)疫苗递送材料以及快速、规模化生产mRNA疫苗是该领域主要研究重点。
Sahin等[15]在小鼠黑色素瘤组织中筛选出新生抗原,设计制备的RNA疫苗均具有抗肿瘤治疗效果;该研究显示,体外转录(in vitrotranscription,IVT)mRNA疫苗具有佐剂活性,不需要依赖其他佐剂可直接转化进入细胞质,该插入诱变的风险低、制备流程简单。Sahin团队通过超声引导的经皮注射对晚期黑素瘤患者进行mRNA疫苗注射免疫治疗,该给药途径可增强mRNA的稳定性、翻译效率和新生抗原在DC上的呈递,促进DC的成熟,免疫后所有患者均能成功诱导出针对多种新抗原的强烈T细胞反应[16]。
2.3 基于树突状细胞的疫苗
DC是抗原呈递细胞之一,能激活CD4+T和CD8+T细胞[17]。目前,将DC增强宿主效应和记忆CD8+T细胞反应的能力应用于DC疫苗已成为肿瘤免疫治疗的主要策略之一[18]。DC疫苗的毒性低,是一种相对安全的治疗方法[19]。
Sipuleucel-T是美国食品和药品管理局(Food and Drug Administration,FDA)批准用于治疗转移性前列腺癌的全球首个全细胞DC疫苗[20],其是由粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)及前列腺酸性磷酸酶融合蛋白(prostatic acid phosphatase,PAP)培养后分离获得,是一种自体活细胞免疫疗法;使用该疫苗患者总生存期可延长4.1个月。尽管DC疫苗具有增强效应性和记忆性CD8+T细胞反应的能力,但也面临肿瘤微环境导致的免疫抑制以及单核细胞来源的树突状细胞(MoDC)的功能限制等诸多挑战。
2.4 纳米疫苗
生物材料递送系统可用于提高新生抗原肽疫苗或mRNA疫苗的疗效[21]。把新生抗原肽与超pH敏感的聚合物组装,可开发一种高响应性纳米疫苗,此类纳米疫苗可响应体内酸碱环境变化,实现有效的胞质递送抗原增强交叉呈递[22]。这种纳米疫苗不含佐剂,载体聚合物本身可通过刺激cGAS-STING通路作为佐剂;通过调整聚合物侧链的化学结构,以获得最佳的pH,在该pH条件下纳米疫苗可以诱导抗原特异性细胞毒性T淋巴细胞反应,其功效与含弗氏佐剂、Toll样受体(Toll-like receptor,TLR)激动剂等佐剂的疫苗相当或更好。
有研究利用纳米粒诱导较强免疫反应,以及与CD40靶向配体相连等特性,制备纳米疫苗,针对黑色素瘤、非小细胞肺癌等进行相关的临床试验,结果显示该纳米疫苗能引起机体抗肿瘤免疫反应[23-24]。Xu等[25]基于阳离子含氟聚合物制备的个性化纳米疫苗,将含氟聚合物与模型抗原卵清蛋白混合形成的纳米粒通过TLR4介导的信号通路诱导DC成熟,促进抗原转运至DC的细胞质中,引起系列免疫反应。纳米疫苗可抑制已建立的表达卵清蛋白的黑色素瘤,同时产生针对黑色素瘤的强大免疫记忆,为制备个性化癌症疫苗以预防肿瘤术后复发和转移提供了一种简单而通用的策略。Koh等[26]开发了以载有TLR激动剂的纳米乳剂为佐剂的肿瘤疫苗,该疫苗在皮下和原位小鼠肺癌模型中表现出强烈的局部和全身抗肿瘤免疫反应,诱导肿瘤特异性T细胞活化并减轻T细胞耗竭,与抗程序性死亡受体1(programmed cell death protein 1,PD-1)抗体联合使用在消除肿瘤和延长存活时间方面显示出协同作用。
3 靶向新生抗原疫苗的筛选
肿瘤新生抗原突变来自肿瘤基因组,基因组测序技术等方法可以协助识别与筛选肿瘤新生抗原。对肿瘤组织进行完整的外显子组或转录组测序后,与健康对照组的基因组序列对比,可以筛选出肿瘤基因组中的非同义体细胞突变。使用针对MHC-抗原肽亲和力的预测算法对突变进行筛选与鉴定,进而将免疫原性较高的候选新生抗原用于生产个体化新生抗原疫苗[27]。有部分预测算法可识别MHC I类分子的潜在高亲和力结合剂,但是现有的预测方法并不能把MHC的稳定性、遗传因素、DNA的改变等全部影响因素包含在内,技术仍需改进[28]。
目前,研究已开发了包括pVACseq、TIminer、MuPeXI、Neopepsee等在内的多个工具用于鉴定筛选候选新抗原,但鉴定结果假阳性率仍较高[29]。Yadav等[30]通过转录组、外显子测序及质谱分析等发现,小鼠肠癌细胞突变后的肽链可与MHCⅠ类分子结合,且该肽链上存在有免疫原性的突变新生表位,可作为新生肽疫苗的候选分子。因此,新一代测序技术与免疫及生物信息学技术可以提供鉴定肿瘤新生抗原的方法及思路。
4 靶向新生抗原疫苗的设计制备
在新生抗原疫苗诱导的免疫应答中,新生抗原主要通过交叉呈递来识别[31]。APC被富集到接种位点后,活化的APC刺激外周免疫器官,诱导T细胞的激活[32]。在新生抗原疫苗的设计中,选择能够被有效提呈和识别的新生抗原是一项技术挑战。除了免疫刺激成分外,不同佐剂和疫苗平台也会影响疫苗的疗效。
Ni等[33]开发的双佐剂新生抗原纳米疫苗(banNV),通过合成纳米模板与阳离子多肽纳米缩合,利用疏水性TLR激动剂和ADP依赖葡糖激酶的物理负载制备。双重协同佐剂能增强新生抗原的免疫原性,降低急性全身毒性。banNV与抗程序性死亡细胞蛋白(anti-programmed cell death protein 1,aPD-1)的组合能诱导特异性免疫应答,使70%的新生抗原特异性肿瘤完全消退而无复发[34]。banNV有望成为癌症免疫治疗高度个体化的新生抗原疫苗。高向东研究团队报道了一种靶向程序性死亡配体1(programmed cell death 1 ligand 1,PDL1)的二合一肿瘤疫苗,该疫苗能有效打破PDL1的免疫耐受,引发PDL1特异性体液免疫和细胞免疫,重塑肿瘤微环境,该疫苗可能为PDL1抗体药物不敏感患者提供可替代治疗方案[35]。上述疫苗与双佐剂结合的方式提高了疫苗的抗肿瘤能力,但要在临床治疗中使用仍需更深入的研究。
5 靶向新生抗原疫苗的临床应用
分子靶向药物在大多数存在驱动基因阳性的患者中具有良好效果,但易出现耐药性。Carreno等[36]为经单克隆抗体伊匹木单抗(ipilimumab)治疗后的3位黑色素瘤患者静脉接种新生抗原和DC的混合疫苗,研究证实新生抗原表位可使肿瘤特异性T细胞的免疫反应更广泛和多样化。部分临床试验结果也支持这项研究结果,证明个体化肿瘤新生抗原疫苗方法的可行性[37]。杜学明团队报道1例化疗及靶向治疗后仍有进展的肺鳞状细胞癌患者,通过新生抗原疫苗治疗后病灶明显缩小[38]。Zaidi团队筛选并制备新生抗原疫苗PancVAX,该疫苗与其他免疫疗法联用比单用该疫苗抗肿瘤效果更好[39]。
在一项临床试验中对局部晚期及以上黑色素瘤患者接种新生抗原疫苗后,中位随访时间为25个月(范围为20 ~ 32个月),其中4名患者未见复发,2名患者出现肺转移,经4次抗PD-1抗体派姆单抗治疗后病情得到缓解(派姆单抗治疗转移性黑色素瘤的影像评估的缓解率为6.1%)[40]。另外,多个研究团队发现,黑色素瘤患者细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)单抗治疗效果与该患者是否产生新生抗原表位以及新生抗原表位的产生数量密切相关[39-41]。McGranahan等[42]研究证实,PD-1单抗药物对非小细胞肺癌的治疗效果同样与新生抗原表位有关联性。因此,新生抗原疫苗可以单独用于肿瘤治疗,也可与佐剂结合增强免疫应答。新生抗原疫苗与传统治疗方法如手术治疗、放疗、化疗联用可延长患者生存期,与免疫检查点抑制剂、靶向药联用可提高临床治疗疗效,为患者提供真正意义上的个体化治疗。
6 存在问题与展望
目前,已明确肿瘤新生抗原疫苗可引起CD4+T和CD8+T的免疫应答,从而达到抗肿瘤目的。但CD4+T细胞表位与新生抗原相关免疫应答之间的关系及其抗肿瘤机制尚不清楚。肿瘤新生抗原表位的结构特征与其免疫原性强弱之间的联系尚不明确;新生抗原预测算法、新生抗原的筛选鉴定方法及平台仍需优化。通常胃肠外注射的可溶性亚基抗原或分子佐剂由于分子小可迅速扩散到全身循环系统中,但其仅有少部分在引流淋巴结中积累并引起有限的免疫反应。皮下给药的可溶性分子佐剂通常会引起明显的全身炎性毒性。肿瘤新生抗原疫苗制备成本高、耗费时间长。如何低成本、高效率、安全生产副作用小的疫苗是研究难点。肿瘤新生抗原疫苗的临床疗效评价标准暂未完全统一。缺乏治疗期间及结束后免疫监测方法及评价标准。虽然面临诸多挑战,仍有部分新生抗原疫苗设计制备成功并用于临床治疗,且疗效显著。相信随着更深入的研究,更多患者将从基于新生抗原疫苗的个体化抗肿瘤治疗中获益。
