MRI弥散加权成像在腰椎间盘退变分级中的应用价值
2022-01-07韩玺铭朱兵兵刘凤霞马景旭
韩玺铭,朱兵兵,刘凤霞,马景旭,王 红
(新疆医科大学1基础医学院解剖教研室,乌鲁木齐 830011;2第二附属医院影像中心,乌鲁木齐 830000)
全球约2/3的成年人曾出现不同程度的腰腿痛,并且已经成为全球最大的公共卫生问题之一[1-2]。主要表现为下腰痛、下肢放射性痛,严重时会直接影响患者的生活质量,给家庭和社会造成严重的负担[3]。研究发现,椎间盘退变(lumbar degenerative disease,LDD)是腰腿痛的发病基础[4]。椎间盘作为无血管组织,其营养供应依赖终板和周围毛细血管的渗透[5]。糖尿病、高脂血症会严重破坏椎间盘周围的毛细血管网,造成椎间盘营养缺乏,增加LDD的患病率。磁共振成像(magnetic resonance imaging,MRI)是临床上检查腰椎间盘疾病的首选方法,根据椎间盘信号的变化以及椎体形态的改变做出相应诊断。弥散加权成像(diffusion weighted imaging,DWI)技术作为一种MRI功能成像方法,其定量指标表观弥散系数(appar⁃ent diffusion coefficient,ADC)可以宏观的描述水分子的移动[6]。目前,在中枢神经系统DWI技术被广泛使用,在骨肌系统的应用尚有报道。本研究通过评估DWI技术在腰椎间盘退变中的应用价值,分析DWI与糖尿病患者和高脂血症患者的关系,以期为腰椎间盘退变等级的评估提供参考。
1 资料与方法
1.1 研究对象收集2018年9月-2020年6月因腰腿痛来第二附属医院就诊的患者。纳入标准:①有半年以上腰腿痛病史;②年龄不小于20周岁;③腰部无外伤史。排除标准:①不能配合检查的患者;②有脊柱炎症、结核、肿瘤等;③血糖、血脂均升高的患者。所有患者均签署知情同意书。符合上述标准的受试者共294例,男性143例,年龄21~80岁,平均年龄(50.87±11.89)岁,女性153例,年龄25~80岁,平均年龄(50.01±12.13)岁。
1.2 MRI扫描MRI采用Philips 1.5T核磁共振扫描仪,行常规腰椎MRI及DWI矢位扫描。扫描参数:矢位T1加权,TR350 ms,TE10 ms;矢位T2加权,TR2400 ms,TE100 ms;轴位T2加权,TR2600 ms,TE125 ms,层厚2.0 mm,间隔0.5 mm。DWI序列扫描参数:TR2650 ms,TE55 ms,视野35×35 cm,矩阵130×90,b值取0、600 s/mm2,层厚3 mm,间隔1.5 mm。
1.3 腰椎间盘退变Pfirrmann(Pm)分级[7]由两名主治及以上医师根据Pm分级标准在T2加权矢位上对髓核信号强度和椎间隙高度将椎间盘退变程度分为I~V级。
1.4 图像处理将DWI图像传入Philips工作站,自动形成表观弥散系数(apparent diffusion coefficient,ADC)图,在ADC图中手动勾画椎间盘髓核区域作为感兴趣区(regions of interest,ROI),大小约45~65 mm2(图1d、2d),每个椎间盘测量3次取平均值,以上工作由从事MRI诊断工作5年以上医师完成。
1.5 糖尿病、高脂血症患者数据的收集收集294例研究对象的空腹血糖、胆固醇和甘油三酯,并记录数据。按照临床诊断高糖、高脂患者的标准[8]分为正常组、高血糖组和高血脂组3个亚组,分别为177例、40例、77例。
1.6 统计学分析所有数据采用SPSS 26.0统计软件处理,定量数据以计量资料均数±标准差(±s)表示。采用ANOVA分析不同腰椎间盘退变等级的ADC值差异;分析相同节段不同亚组间ADC值的差异,进一步比较采用SNK法。采用Spearman法分析Pm分级和ADC值的关系。应用多元线性回归分析年龄、血糖、胆固醇、甘油三酯对ADC值的影响,以P<0.05差异有统计学意义。
2 结果
2.1 不同腰椎间盘Pm分级的ADC值比较共1 470个椎间盘,Pm I~V级椎间盘数量,见表1。不同级别的椎间盘ADC值差异显著(P<0.001),其中Pm II级和III级较多。图像分析发现部分椎间盘发生膨出、突出和椎间隙狭窄等退变见图1、2。
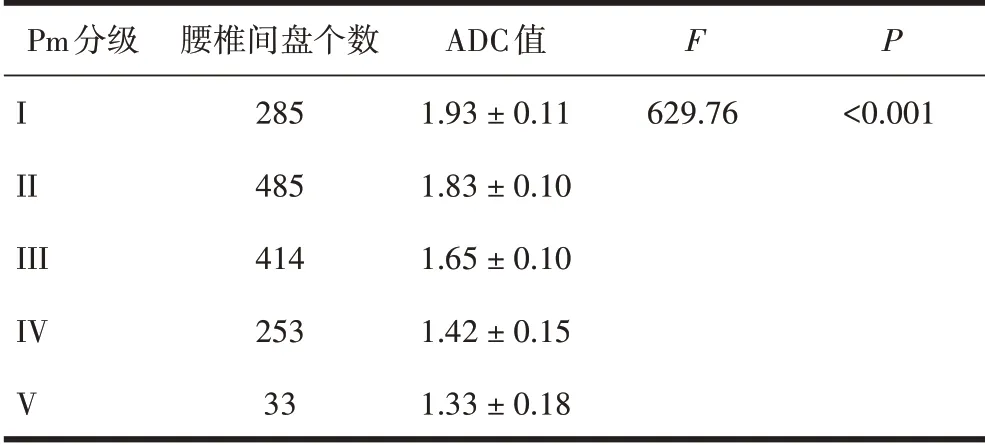
表1 各级椎间盘ADC值的比较(×10-3 mm2/s)
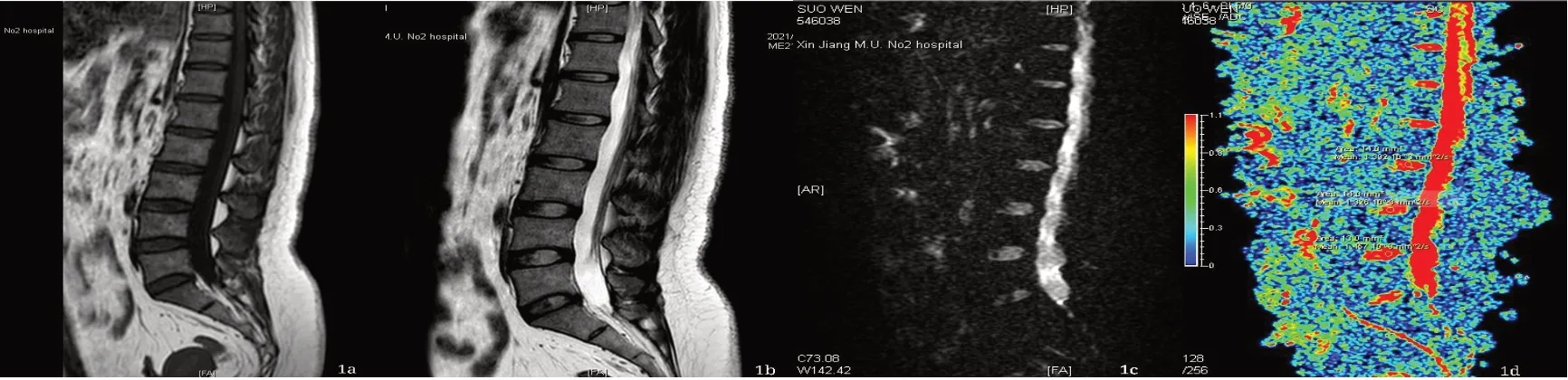
图1 腰椎退行改变伴腰椎间盘突出图
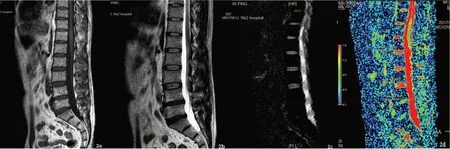
图2 腰椎生理曲度僵直伴部分椎体终板退变图
2.2 Pm分级与ADC值的相关性腰椎间盘Pm分级与ADC值呈强负相关(r=-0.823,P<0.001),见图3。
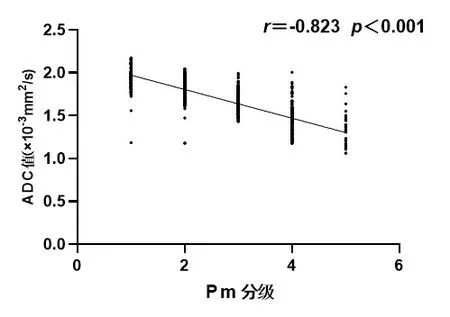
图3 椎间盘Pm分级与ADC值相关性分析的散点图
2.3 不同亚组间ADC值的比较相同腰椎间盘节段不同亚组之间ADC值差异有统计学意义(P<0.001),见表2;SNK法比较相同节段正常组ADC值均大于高糖组和高脂组,且差异有统计学意义(P<0.05),见图4。
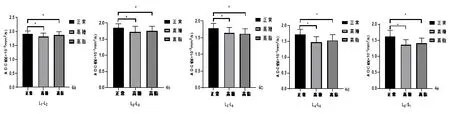
图4 各节段腰椎间盘正常组ADC值均大于高糖组和高脂组
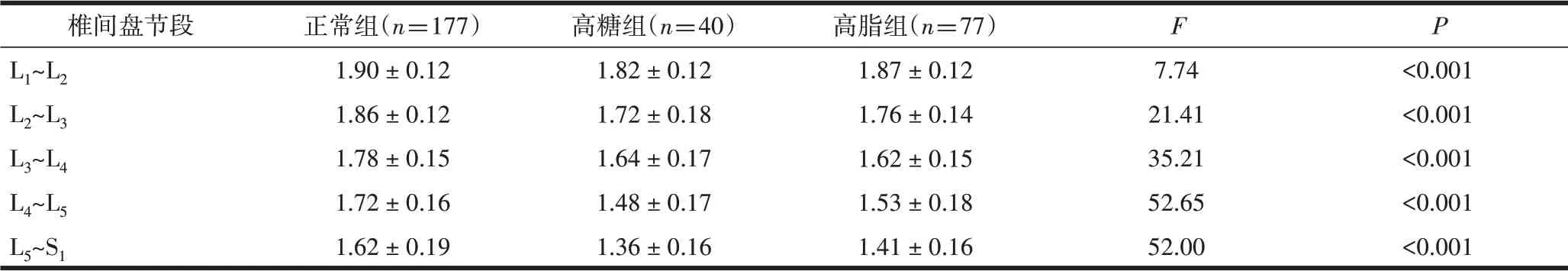
表2 不同亚组之间各节段腰椎间盘ADC值的比较(×10-3mm2/s)
2.4 ADC值的影响因素多元线性回归显示胆固醇与ADC值无相关性(P>0.05)。ADC值的大小受年龄、血糖、甘油三酯的影响,呈负相关(P<0.005)。见表3。

表3 多元线性分析年龄、血糖、胆固醇、甘油三酯对ADC值的影响
3 讨论
近几年越来越多的MRI功能成像技术如:DWI、DTI、MRS、磁化传递等技术应用到椎间盘退变的诊断中[9],由以往形态学阶段发展到定量分析的阶段[10]。DWI技术作为一种简便的检查方法,其定量指标ADC值可以宏观的描述水分子的移动。目前,DWI技术应用到全身多个系统的影像诊断中,如中枢神经系统、认知功能障碍的评估、心肌纤维的走形、骨关节等[11-12]。本研究选择21~80岁腰痛患者作为研究对象,并根据高血糖、高血脂的临床诊断指标分为三个亚组进行比较,定量评估不同腰椎间盘退变等级ADC值的变化,为进一步探讨髓核中水分子的弥散情况提供基础。
Pm分级系统于2001年提出[13],目前广受大家认可。本研究结果发现椎间盘的ADC值随Pm等级增加而降低,二者呈显著负相关,与以往的研究结果一致[14]。原因为椎间盘髓核具有较强的储水功能,其主要原因是组织结构疏松的蛋白多糖和II型胶原纤维的存在。当椎间盘发生退变时,由于髓核中胶原纤维成分增加,蛋白多糖合成量下降,储水量减少,水分子运动明显受限,从而导致ADC值变小。所以本研究运用DWI对水分子具有强敏感性这一优势在评估椎间盘退变中发挥重要作用。
本研究通过多元线性回归发现年龄与ADC值呈负相关。当前,年龄作为椎间盘退变的主要影响因素已被反复证实,但其影响机制目前尚不明确[15]。Norbert Boos[16]研究发现椎间盘退变最早开始于青少年时期,随着细胞基质黏液样变性和终板结构紊乱,在31~50岁椎间盘退变持续增加,最终导致髓核水分减少,瘢痕修复组织增生,T2WI图像上呈低信号,称为“黑间盘”。褚相乐等[17]报道,ADC值的变化可以用来量化椎间盘的退变程度,但r值明显低于本研究结果,其研究对象为30~50岁青壮年人群,身体各项机能处在相对平衡时期,所以相关系数低于本研究结果。在体外研究发现,由于年龄的增长,毛细血管减少,细胞氧化能力降低,无氧酵解产生酸性物质增加,椎间盘在酸性环境中将增加其分解代谢[18]。其次,年龄的增长伴随椎间盘内细胞的衰老,降低各种细胞代谢因子和降解酶的表达,使椎间盘周围的微环境不断恶化,进一步加快椎间盘的退变[19]。所以通过本研究可以进一步证实年龄是椎间盘发生退变的关键因素。
椎间盘退变引起的下腰痛的众多因素中营养供应降低也是主要原因之一[20]。有学者认为首先在高糖、高脂状态下改变椎间盘细胞的外环境,PH降低,其次微血管病变将影响椎间盘的营养供应,不能及时排出代谢产物,进一步加剧椎间盘的退变。本研究结果发现高糖组、高脂组的ADC值均小于正常组,说明高糖、高脂患者较正常人更易发腰椎间盘退变,这与Kad等[21]研究结果相同。由于高糖环境将产生氧化应激作用、自噬作用或醛糖还原酶的异常代谢[22],加速椎间盘内细胞的凋亡,继而导致椎间盘的退变。胆固醇、甘油三酯对血管平滑肌细胞和内皮细胞有很强的毒性,可加速血管损伤及斑块形成,阻断血管营养物质运输,引起椎间盘营养缺乏。此外,高脂应急状态下将激活炎性因子,并且炎性因子在椎间盘的退变中发挥重要作用[23]。同时,研究人员发现血脂水平与促炎因子的表达呈正相关[24],炎症反应随血脂的增高而增强,所以当高脂血症患者发生腰腿痛时将加快椎间盘变性。本研究存在一定的不足,在绘制ROI时可能存在主观的偏见,特别是髓核与纤维环分界不清时。其次研究对象应补充无腰腿疼痛但有椎间盘的患者。本研究结果表明Pm等级与ADC值成负相关,但未能基于DWI技术的量化指标制定椎间盘分级标准,这也是本研究今后的方向。
综上,DWI技术目前是检测活体组织内水分子扩散的唯一无创方法,近几年广泛应用于临床诊断工作中,而且其定量指标ADC值可以准确的反应组织内结构的变化。通过本研究结果可以发现,DWI作为一种敏感、客观的检查方法应用于椎间盘退变的分级和评估椎间盘的致病因素具有重要价值。
