DFO对糖尿病大鼠心肌缺血再灌注损伤的保护作用
2022-01-07陈宇黄一丹杨龙吴建江
马 宁,陈宇,黄一丹,杨龙,吴建江
(新疆医科大学第一附属医院麻醉科,乌鲁木齐 830054)
糖尿病作为一组由多病因引起的代谢疾病,发病率已经达到11.6%[1]。糖尿病患者在病程中易合并心血管疾病,这种风险每10年增加1.38倍[2]。患有糖尿病和缺血性心脏病的病人一旦需要接受手术治疗,相比无合并症的病人发生缺血性心肌损伤的风险显著升高[2]。目前尚无能够有效减轻糖尿病患者围手术期间发生缺血性心肌损伤的临床干预措施。围术期心肌缺血/再灌注损伤(Ischemia-reperfusion injury,IR/I)对于罹患糖尿病的病人来说后果是非常严重的。有研究显示,非糖尿病状态下,七氟醚后处理(Sevoflurane postconditionning,SPostC)可以通过促进低氧诱导因子-1α(HIF-1α)入核表达,调控线粒体呼吸功能,减轻大鼠缺血性心肌损伤[3]。但在糖尿病状况下七氟醚后处理保护作用减退[4],具体机制尚不明确。本课题组前期研究认为,受损的HIF-1α在糖尿病状态下无法调控线粒体呼吸链关键酶可能是导致七氟醚后处理作用失败的重要原因。本研究旨在观察去铁胺(DFO)处理后如何改善糖尿病大鼠线粒体呼吸功能,恢复七氟醚对心肌的保护作用。
1 材料与方法
1.1 心脏离体灌注模型SPF级雄性非胰岛素依赖非肥胖自发Ⅱ型糖尿病(GK)大鼠80只,体重300~350 g,14~16周龄。实验动物生产许可证号:SCXK(苏)2016-0010。建立Langendorff模型[5]:戊巴比妥钠腹腔麻醉,取出心脏,丝线绑于Langendorff灌注架上,逆行灌注(K-H液,37℃平衡95%O2-5%CO2),连接Powerlab多道生理记录仪。上述步骤2 min内完成。纳入标准:离体心脏平衡(37℃K-H液)20 min后,心率(HR)>250次/min、左室舒张压(LVDP)>80 mmHg、室性早搏<2次/min。
1.2 实验分组80个离体灌注心脏按随机数字表法分为5组(n=16):对照组(C组)、缺血再灌注组(I/R组)、七氟醚后处理组(SPostC组)、去铁胺+七氟醚后处理组(DFO+SPostC)、去铁胺+七氟醚后处理+HIF-1α抑制剂二甲氧基雌二醇(2ME2)组(DFO+SPostC+2ME2)。C组持续灌注K-H液180 min;I/R组平衡20 min,缺血40 min,再灌注120 min;SPostC组在缺血末灌注2.4%七氟醚(批号:67081,Maruishi Pharmaceuti⁃cal公司,日本)饱和的K-H液15 min后,续灌正常KH液105 min;DFO+SPostC组:在缺血前24 h腹腔给予200 mg/kg DFO,其余同SPostC组;2ME2组复灌含2ME2(批号:S1233,Selleck公司,美国)+2.4%七氟醚饱和的K-H液15 min后,续灌正常K-H液105 min。
1.3 线粒体(State3)、呼吸控制率RCR测定参照文献[6-7]方法,采用汉莎氧电极(Hansatech Ltd公司,英国),按照Bradford蛋白浓度定量试剂盒(碧云天),测定线粒体3态、4态呼吸,记录耗氧曲线变化情况,RCR=State3/State4。
1.4 线粒体呼吸酶活性测定采用Clark-氧电极,参照文献[8]方法,分别测定烟酰胺腺嘌呤二核苷酸氧化酶(NADHO)、细胞色素c氧化酶(CcO)、琥珀酸氧化酶(SUCO)等5~10 min反应曲线,测定线粒体呼吸酶活性。
1.5 心肌超微结构观察再灌注结束各组随机取1 mm×1 mm×1 mm左室心肌,按流程脱水包埋染色后经H-600型透射电镜观察心肌超微结构(×10 000,Hitachi公司,日本)。
1.6 Western blot法检测HIF-1α表达取液氮中左室心肌组织,提组织蛋白、裂解、电泳、转膜后分别加入一抗即鼠抗HIF-1α单克隆抗体和山羊抗GAP⁃DH多克隆抗体,在4℃条件下孵育过夜,用TBST液洗3次,每次10 min,加入二抗抗鼠IgG-HRP和抗山羊IgG-HRP室温孵育1 h(抗体均购自Sigma公司,美国)。应用Quantity One系统在ECL-plus试剂盒显色后行灰度值分析。
1.7 统计学分析采用SPSS25.0软件分析,计量资料符合正态分布结果以均数±标准差(±s)表示,组间比较采用one-way ANOVA,P<0.05为差异有统计学意义。
2 结果
2.1 线粒体呼吸功能比较与C组相比,I/R组、SPostC组、DFO+SPostC组、DFO+SPostC+2ME2组State3、RCR降 低(P<0.05);与I/R组 比 较,DFO+SPostC组State3、RCR增高(P<0.05),但SPostC组、DFO+SPostC+2ME2组 与I/R组 的State3和RCR差 异无统计学意义(P>0.05),见表1。
表1 心肌细胞线粒体State3和RCR活性的比较(n=8,nmol/min-1·mg-1·pro-1,±s)
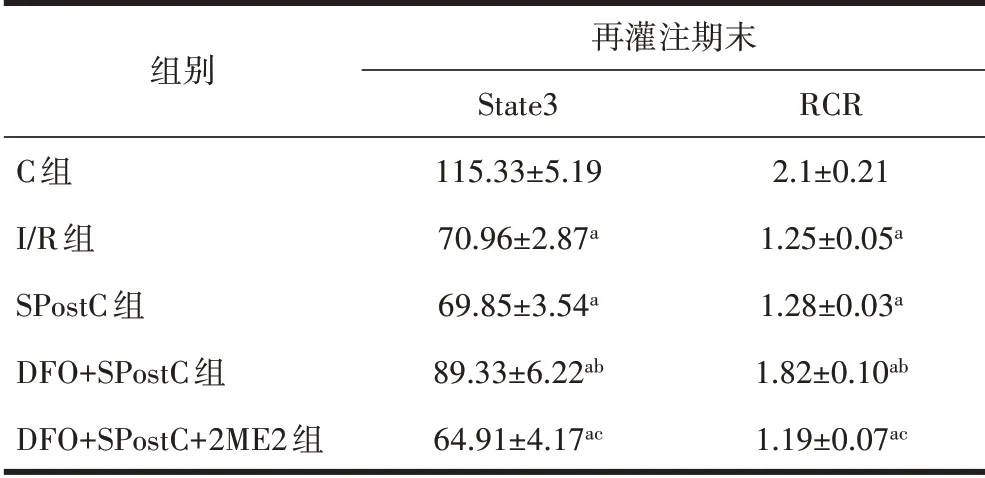
表1 心肌细胞线粒体State3和RCR活性的比较(n=8,nmol/min-1·mg-1·pro-1,±s)
注:与C组比较,aP<0.05;与I/R组比较,bP<0.05;与DFO+SPostC组比较,cP<0.05。
组别C组I/R组SPostC组DFO+SPostC组DFO+SPostC+2ME2组再灌注期末State3 115.33±5.19 70.96±2.87a 69.85±3.54a 89.33±6.22ab 64.91±4.17ac RCR 2.1±0.21 1.25±0.05a 1.28±0.03a 1.82±0.10ab 1.19±0.07ac
2.2 5组线粒体呼吸酶活性比较与C组比较,I/R组、SPostC组、DFO+SPostC、DFO+SPostC+2ME2组CcO、NADHO和SUCO活性降低(P<0.05);与I/R组比较,DFO+SPostC组CcO、NADHO及SUCO活性升高(P<0.05),但SPostC组、DFO+SPostC+2ME2组与I/R组CcO、NADHO和SUCO活性差异无统计学意义(P<0.05);与DFO+SPostC组比较,DFO+SPostC+2ME2组CcO、NADHO和SUCO活性降低(P<0.05),见表2。
表2 心肌细胞线粒体NADHO、CcO和SUCO活性的比较(n=8,nmol/min-1·mg-1·pro-1,±s)

表2 心肌细胞线粒体NADHO、CcO和SUCO活性的比较(n=8,nmol/min-1·mg-1·pro-1,±s)
注:与C组比较,aP<0.05;与I/R组比较,bP<0.05;与DFO+SPostC组比较,cP<0.05。
组别C组I/R组SPostC组DFO+SPostC组DFO+SPostC+2ME2组再灌注期末NADHO 231.61±6.16 161.40±4.25a 159.95±3.18a 184.62±4.31ab 157.29±5.57ac CcO 71.67±5.05 46.64±4.20a 48.97±3.41a 61.03±2.31ab 44.12±3.10ac SUCO 77.16±6.14 44.97±4.64a 45.96±4.16a 63.45±3.29ab 42.32±4.00ac
2.3 心肌线粒体超微结构C组心肌结构未见明显损伤,线粒体排列整齐。I/R组、SPostC组、DFO+SPostC+2ME2组心肌结构严重受损,肌丝溶解;线粒体肿胀且数量少。DFO+SPostC组线粒体形态完整,嵴膜清晰可见,未见溶解破裂。见图1。

图1 电镜下各组心肌超微结构(×10 000)
2.4 5组HIF-1α蛋白表达比较DFO+SPostC组HIF-1α表达显著提高,与I/R组、SPostC组相比差异具有统计学意义(P<0.05),见图2、表3。

图2 各组HIF-1α蛋白表达Western blot条带图
表3 各组HIF-1α蛋白表达(n=8,±s)
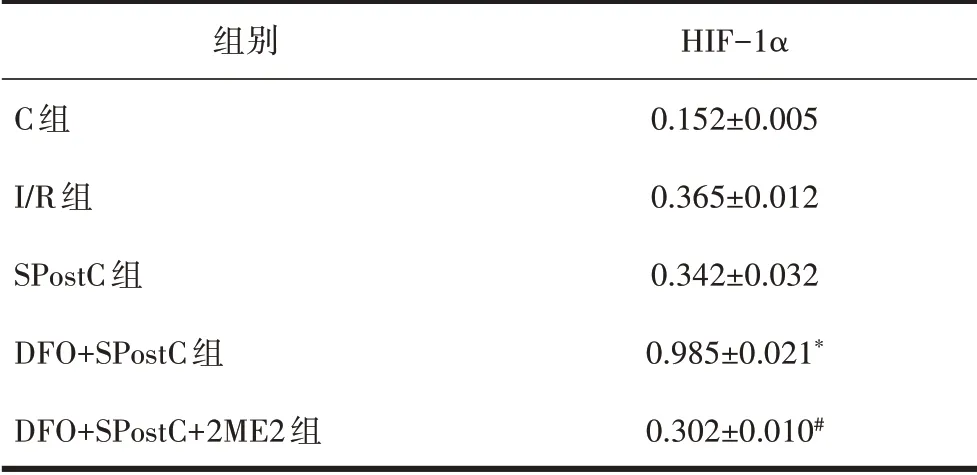
表3 各组HIF-1α蛋白表达(n=8,±s)
注:与I/R组相比,*P<0.05;与DFO+SPostC组相比,#P<0.05。
组别C组I/R组SPostC组DFO+SPostC组DFO+SPostC+2ME2组HIF-1α 0.152±0.005 0.365±0.012 0.342±0.032 0.985±0.021*0.302±0.010#
3 讨论
本研究选择Langendoff离体灌注模型,实验结果表明糖尿病大鼠心肌在I/RI后心肌肌丝溶解,结构受损严重,线粒体数量减少且肿胀,提示心肌I/RI模型制备成功。此外,SPostC组各指标与I/R组并无统计学差异,说明在糖尿病状态下后处理无法有效减轻心肌缺血的伤害,这与GAO等[4]利用胰岛素治疗无法逆转SPostC保护作用的研究结论一致。
线粒体以ATP的形式产生能量,是细胞中具有核心地位的“发动机”。除此之外,线粒体也是能量代谢中心与细胞内各种生存信号的靶效应器。心肌能量代谢紊乱是导致糖尿病心肌对抗I/RI能力下降和易损性增加的关键,而功能完整的线粒体是确保心肌动力充足的根源。本研究通过测定State3和RCR反应细胞的能量产生,测定线粒体3态、4态呼吸,以判断线粒体呼吸功能。
缺氧诱导因子(HIF)对心血管系统的正常重构发挥重要作用,YEO等[5]及Li等[9]研究发现,I/RI时线粒体结构被破坏导致ATP合成减少,会进一步使得缺血性心肌损伤程度恶化,但GAO等[4]研究证实,心肌组织缺氧时HIF-1α显著上调,能通过减少线粒体来源的氧自由基(ROS)生成且维持CcO活性,从而避免心肌线粒体损伤。因此HIF-1α可能是缓解心肌缺血缺氧致线粒体损伤的内源性调控靶点。新近研究发现,非糖尿病状态下SPostC可以上调HIF-1α表达,改善线粒体呼吸功能及呼吸酶活性,减轻缺血性心肌损伤[3],但这种优势无法在糖尿病状态下体现[4],具体原因尚不明确。本研究发现,糖尿病大鼠SPostC组与I/R组相比,线粒体呼吸功能及呼吸酶活性差异无统计学意义,并且心肌超微结构受损程度相似,这与GAO[4]实验结论相符。本研究结果显示,DFO+SPostC组反映线粒体呼吸功能的各指标较SPostC组与I/R组明显改善,在一定情况下DFO干预是恢复糖尿病状态下SPostC心肌保护作用的关键。
DFO已被广泛用作铁超载状态的螯合疗法,在血浆组织中快速被酶代谢。DFO是一种高选择性的铁螯合剂,糖尿病患者全身或者局部应用DFO都能稳定并激活HIF-1α,从而促进糖尿病患者伤口的愈合[10]。本实验结果表明,I/R组HIF-1α表达并没有增加,这与Wu等[11]的研究结论一致,说明在糖尿病状态下HIF-1α无法正常入核表达。本实验给予DFO后发现,DFO+SPostC组的HIF-1α蛋白表达明显升高,并且State3、RCR及NADHO等酶活性明显优于I/R组、SPostC组,同时心肌线粒体结构损伤明显减轻。这表明HIF-1α可能是介导SPostC减轻糖尿病心肌缺血性损伤的关键靶标,DFO作为HIF-1α的激动剂,能够激活糖尿病状态下受损的HIF-1α,在此基础上结合SPostC能够进一步促进HIF-1α入核表达,从而改进线粒体呼吸功能及呼吸酶活性,最终减轻糖尿病大鼠缺血性心肌损伤。
本研究在给予DFO处理后,发现DFO+SPostC组3态呼吸、RCR及NADHO等酶活性较I/R组明显改善,但是给予HIF-1α抑制剂后发现,DFO+SPostC+2ME2组3态呼吸、RCR及NADHO等酶活性明显降低,且伴随心肌结构严重受损、肌丝溶解、线粒体明显肿胀。提示在糖尿病状态下,DFO对线粒体呼吸功能产生影响的关键在于稳定HIF-1α的功能,而给予SPostC进一步促进HIF-1α入核表达,调节线粒体呼吸功能及呼吸链酶活性,维持缺血再灌注期的心肌能量供应以减轻缺血性心肌损伤。
综上所述,DFO能够恢复糖尿病状态下SPostC的保护作用,其机制可能与调控HIF-1α、进一步改善线粒体呼吸链能量生成,从而减轻心肌缺血再灌注损伤。
