Hippo信号通路中Phospho-MOB1和TEAD4蛋白在口腔鳞状细胞癌中的表达及临床意义
2022-01-07童乔莹陈青立夏嘉男龚忠诚
苏 毓,童乔莹,陈青立,夏嘉男,龚忠诚
(1新疆医科大学口腔医学院,2新疆医科大学第一附属医院/附属口腔医院颌面肿瘤外科,乌鲁木齐 830054)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)在我国是口腔颌面部最常见的恶性肿瘤,其发病率仍呈现出上升趋势,且发病年龄越来越趋于年轻化[1],然而随着口腔鳞状细胞癌的诊治技术的进步,其发病率和死亡率仍居高不下。Hippo信号通路是一条高度保守的首次在果蝇体内被发现的信号通路,具有调控细胞增殖与凋亡,控制组织器官大小和维持内环境稳态的功能[2]。目前研究发现Hippo信号通异常与食管鳞状细胞癌[3]、乳腺癌[4]、卵巢癌[5]、肺癌[6]、肝细胞癌[8]等肿瘤的发生发展密切相关[8]。Yes相关蛋白(Yes-associated protein,YAP)被认为是细胞调控机制中的关键蛋白,细胞学实验发现YAP在多种肿瘤中呈现出高表达和核累积趋势,对肿瘤细胞的增殖、迁移、侵袭等生物学行为具有重要意义[9]。
Hippo信号通路中核心蛋白Mst1,Lats1/2和YAP与OSCC细胞的增殖、转移及OSCC患者预后具有明显相关性[10]。然而关于Hippo信号通路在OSCC中机制的研究尚不清晰,本研究探讨Hippo信号通路中YAP上游的蛋白Phospho-MOB1和下游的TEAD4蛋白在OSCC中表达及其临床相关性,以期为临床中OSCC的诊断、治疗提供新的思路与靶点。
1 资料与方法
1.1 一般资料选取新疆医科大学第一附属医院口腔颌面肿瘤外科2005年12月-2016年9月经病理科确诊的口腔鳞状细胞癌患者,85例OSCC病例(实验组)和14例癌旁正常组织病例(对照组)完整的临床资料,收集OSCC患者的临床资料样本时剔除临床随访资料不全者。本研究已通过新疆医科大学第一附属医院伦理审查委员会的审核,所有患者均签署了知情同意书。
1.2 随访通过电话的形式进行随访,随访至患者出现复发为止,对于无复发病例随访截止至2017年10月30日;本研究无失访患者,有效随访率为100%。复发定义为出现肿物,经过临床及影像学检查,并最终病理确诊的患者为复发患者。
1.3 主要试剂及设备兔抗人Phospho-MOB1单克隆抗体(Cell Signaling,#8699,1:100);兔抗人TEAD4多克隆抗体(Abcam,#97460,1:300);免疫组化SP法检测试剂盒(北京中杉金桥生物技术有限公司);二氨基联苯胺(diaminobenzine,DAB)显色试剂盒(北京中杉金桥生物技术有限公司)。
1.4 免疫组织化学染色采用免疫组化染色方法检测Phospho-MOB1及TEAD4的表达。切片经脱蜡、水化、3%过氧化氢阻断内源性过氧化物酶、蒸馏水及磷酸盐缓冲液浸泡,枸橼酸微波加热修复抗原。分别滴加一抗4℃15 h(Phospho-MOB1 1:100;TEAD4 1:300)。二抗37℃孵育30 min、DAB染色。常规苏木精复染、脱水、透明、中性树脂封片后镜下观察。磷酸化MOB1以肺鳞状细胞癌为阳性对照,TEAD4以卵巢癌为阳性对照,磷酸盐缓冲液代替一抗作阴性对照。免疫组化染色结果判断:Phospho-MOB1、TEAD4均以细胞核出现棕黄色颗粒作为阳性细胞,只有胞质阳性视为非特异染色。每张切片选择5个典型的高倍视野(×400),计数至少500个细胞,根据阳性细胞核百分数进行分类。用染色强度联合阳性细胞百分比进行评分:染色强度分4个等级:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比为5个等级:阳性细胞<10%为0分(阴性),10%~25%为1分,26%~50%为2分,51%~75%为3分,>76%;两者之和为最后分:0分为阴性,1~2分为(+),3~4分为(++),>4分为(+++),1~4分为低表达,>4分为高表达。
1.5 统计学分析应用SPSS22.0统计软件对结果行统计学处理,非正态分布计量资料采用中位数(四分位数间距)表示,两组间比较采用Mann-Whitney U检验。OSCC患者生存分析使用Kaplan-Meier法,采用Cox进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Phospho-MOB1和TEAD4蛋白在OSSC及癌旁正常组织中的表达情况Phospho-MOB1表达于细胞核内,呈淡黄色颗粒,癌组织与癌旁正常组织中均有散在分布(图1),差异无统计学意义(P=0.151)。TEAD4蛋白表达于细胞核内,呈棕黄色或棕褐色颗粒,以癌巢周边表达强烈,小部分OSCC组织与癌旁正常组织中未见黄染或呈淡黄色(图2);TEAD4蛋白在OSCC与癌旁正常组织中的表达差异有统计学意义(P=0.02),相较于癌旁正常组织,TEAD4蛋白在OSCC组织细胞核中明显高表达(表1)。
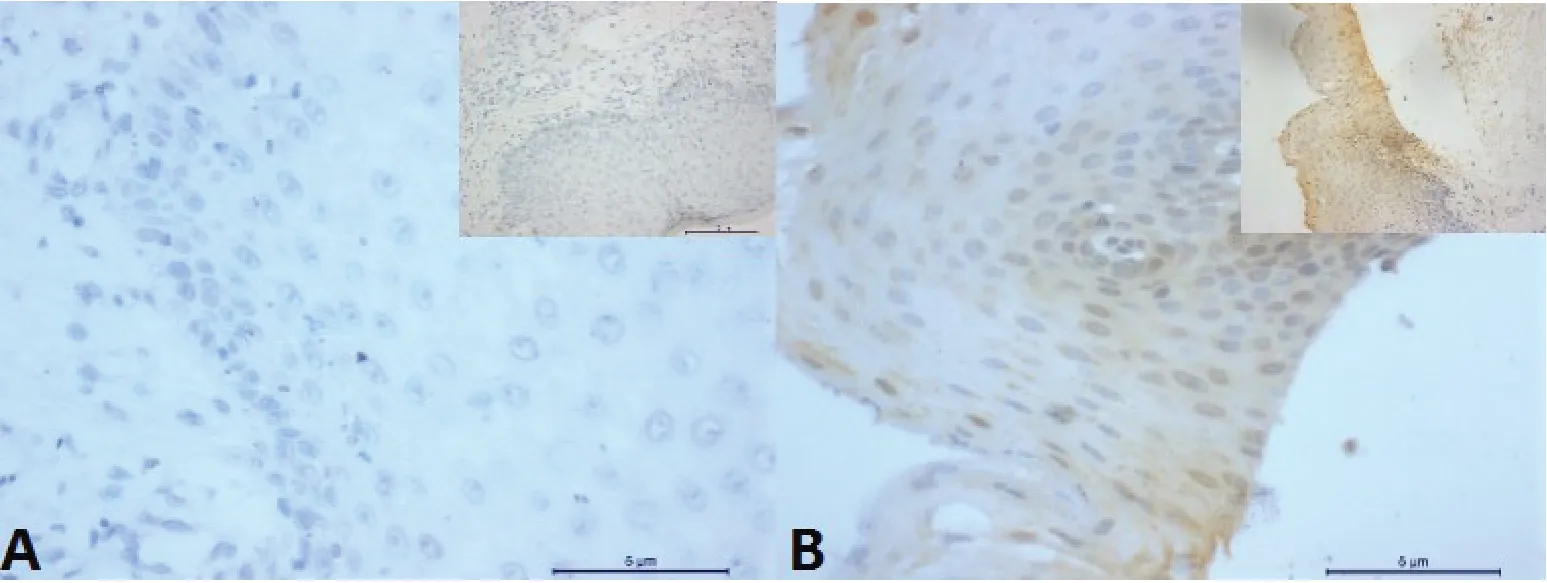
图1 Phospho-Mob1蛋白在OSCC中的表达
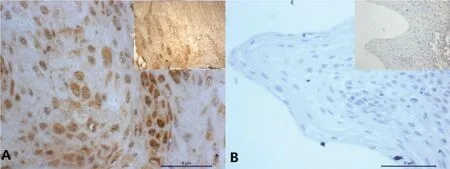
图2 TEAD4蛋白在OSCC中的表达
2.2 TEAD4蛋白表达情况与临床病理特征关系TEAD4的高表达与患者的饮酒习惯、结局、肿瘤的复发差异均有统计学意义;TEAD4的表达与患者的性别、年龄、族别、吸烟习惯、肿瘤的分化程度、临床分期、淋巴结转移、神经累及差异均无统计学意义(P>0.05)。见表1。
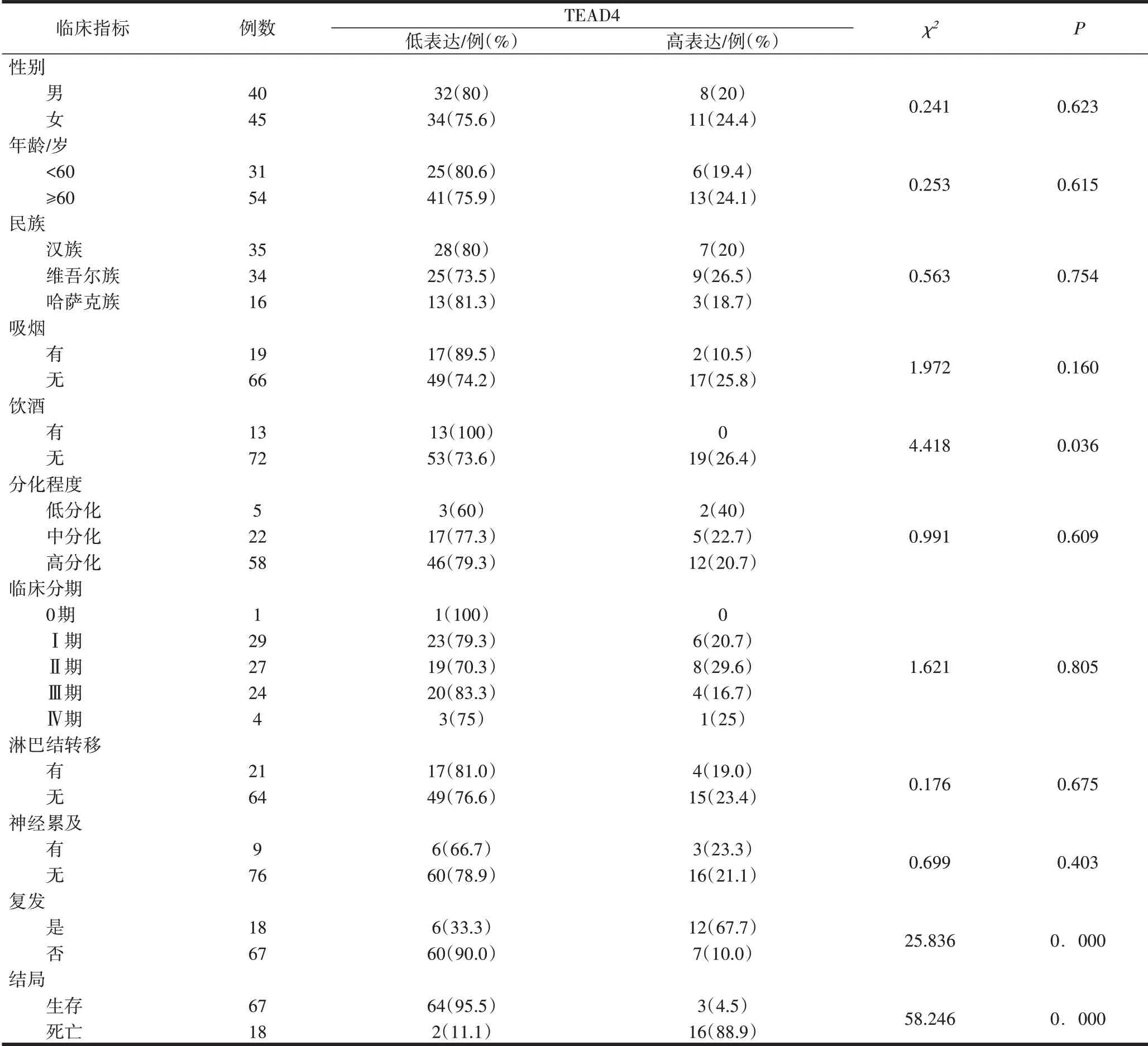
表1 口腔鳞状细胞癌患者TEAD4表达情况与临床病理特征的关系
2.3 TEAD4蛋白表达情况与OSCC患者生存分析85例患者随访至术后1~130个月,中位随访时间为16.5个月。85例患者中18例患者死亡(21.2%),18例出现复发(21.2%),复发患者中13例患者死亡(72.2%)。TEAD4蛋白的表达和OSCC患者的带瘤生存时间、无瘤生存时间差异均有统计学意义(P<0.01)。见图3~4。
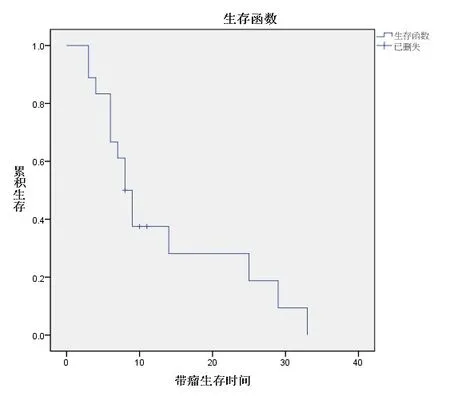
图3 OSCC患者Kaplan-Meier带瘤生存时间曲线
2.4 TEAD4蛋白的Cox分析肿瘤的分化程度(HR<1;P=0.009)是OSCC患者的预后独立保护性因素,即肿瘤分化程度越高,患者预后越好;TEAD4蛋白的高表达是OSCC患者的预后不良的独立危险因素(HR>1;P=0.000029)。见表2。
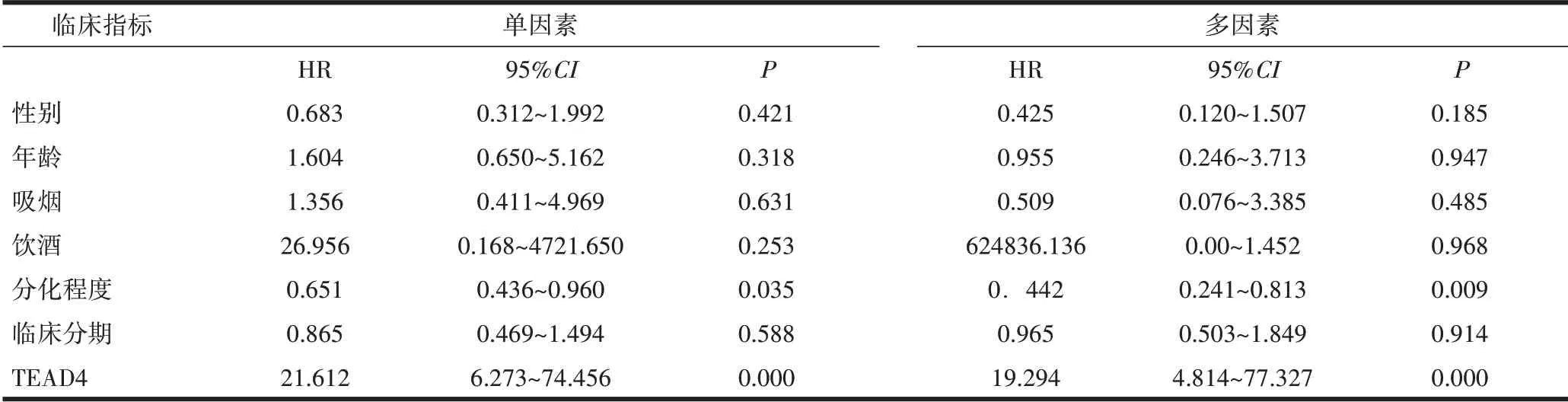
表2 OSCC患者临床资料单因素与多因素Cox分析
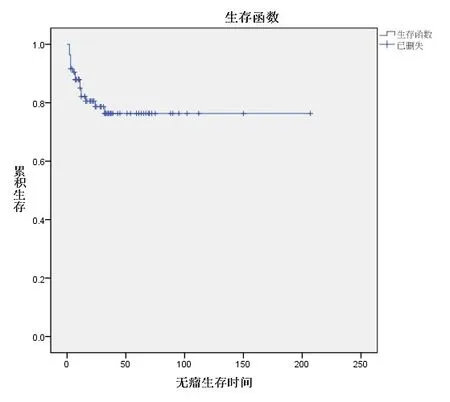
图4 OSCC患者Kaplan-Meier无瘤生存时间曲线
3 讨论
口腔鳞状细胞癌的治疗主要以手术治疗为主,放化疗为辅[11],但依旧面临术后局部复发,淋巴结转移等问题。Hippo信号通路可以调节肿瘤细胞的增长和凋亡,YAP作为Hippo信号通路中的关键蛋白,直接或间接靶向作用于YAP从而对肿瘤细胞的生长进行调控,或许对OSCC的诊治提供了的新的方向[[12]。
本研究发现Phospho-MOB1蛋白在OSCC和癌旁正常组织中的表达差异无统计学意义;可能存在其他调控途径,或与其他蛋白共同作用生成磷酸化复合物后再调控下游产物,其研究结果有待进一步证实。已有研究发现通过MOB1蛋白的缺失将异常激活YAP蛋白,导致胆管细胞异常增生,促进肿瘤发生,是小鼠和人肝癌重要的驱动因素[13]。
本研究结果显示,TEAD4蛋白高表达与OSCC患者的饮酒习惯、复发及结局转归有关;TEAD4低表达的患者带瘤生存时间与无瘤生存时间明显长于TEAD4蛋白高表达的患者;TEAD4蛋白的高表达是OSCC患者的预后不良的独立危险因素,即TEAD4蛋白表达水平高,提示患者预后差。在Hippo信号通路与胃癌[14]、大肠癌[15-16]等的研究中也发现TEAD4蛋白与患者的转移、复发及不良预后有关。但本研究方法较为单一,后续可改进实验方法、增加实验方法的多样性,扩大样本含量以补充研究。
综上,TEAD4蛋白表达水平与OSCC的发展、预后密切相关,可为OSCC的治疗提供TEAD4/YAP轴的潜在选择,有望作为评估OSCC患者预后的生物标志物,但其具体机制还有待进一步探究。
