核酸检测时代再议免疫印迹试验在HIV感染诊断中的意义
2022-01-05杨瑞锋沙文彬北京大学人民医院北京大学肝病研究所国家感染性疾病临床医学研究中心分中心丙型肝炎和肝病免疫治疗北京市重点实验室非酒精性脂肪性肝病诊断北京市国际科技合作基地北京00044临夏州人民医院检验科甘肃临夏7300
杨瑞锋,沙文彬(.北京大学人民医院 北京大学肝病研究所 国家感染性疾病临床医学研究中心分中心 丙型肝炎和肝病免疫治疗北京市重点实验室 非酒精性脂肪性肝病诊断北京市国际科技合作基地,北京00044;.临夏州人民医院检验科,甘肃临夏7300)
人类免疫缺陷病毒(HIV)流行率在我国仍然呈逐年升高趋势。根据中国疾病预防控制中心(CDC)数据,2012—2020年期间,艾滋病的新发病例数和死亡人数双双逐年上升的趋势并未得到有效遏制,2020年全国HIV感染者高达62 167例。艾滋病也是我国法定传染病中死亡人数最高的病种,2020年死亡人数高达18 819例[1]。
1 免疫印迹试验在HIV感染诊断中的作用及局限性
诊断HIV感染依赖于实验室检测。现阶段我国HIV感染的诊断,主要由HIV初筛试验和抗体“确证试验”(或称 “补充试验”)两部分组成[2]。初筛试验检测HIV抗体(第三代试剂)或联合检测抗原和抗体(第四或第五代试剂)[3],确证试验以免疫印迹试验(western blot,WB)为主,此外,线性杂交技术也属于确证试验,原理和结果判断与WB类似。
WB原理是将HIV裂解并在纤维膜上电泳,不同相对分子质量的蛋白质分布于纤维膜的不同位置。待测血清HIV抗体与蛋白质结合并显色,在相应位置显现条带。不同WB试剂的阳性判断结果有所不同,一般来说,若出现多条条带[如糖蛋白(gp)160/gp120和蛋白(p)24,或更多]则判别为HIV抗体“阳性”;没有条带,则为“阴性”;而当出现条带又不满足阳性标准时,为“不确定”。现阶段,我国HIV感染者要得到明确诊断和免费抗病毒治疗,一般要有WB试验“阳性”报告。WB在我国沿用至今,但现实应用中存在一些问题。
1.1WB“不确定”结果过多 WB“不确定”结果可占4%~20%甚至更高比例[4]。多种原因可造成WB结果“不确定”。(1)从原理上讲,WB试验仅检测HIV IgG抗体,无法检测IgM抗体和抗原,因此诊断早期HIV感染有天然的劣势[5]。笔者曾遇到1例被检者,HIV抗体初筛试验(第三代化学发光试剂)在2周内由“阴性”转为“阳性”,转阳时进行WB试验,出现gp160和p24条带,结果“不确定”,但这两条带已经高度提示处于感染早期[6]。另一位被检者有HIV暴露史,HIV抗原/抗体联合筛查化学发光试剂检测为“强阳性”,而WB为“不确定”,这是由于筛查试验“强阳性”信号主要由p24抗原而非IgG抗体所贡献。也有文献报道,终末期艾滋病患者免疫系统被严重破坏,抗体(如p24抗体)水平下降甚至消失,WB同样可出现“不确定”结果,经抗逆转录病毒治疗(ART)后,WB又可复阳[7]。此外,新近研究提示,HIV暴露前预防(PrEP)或暴露后预防(PEP)人群若预防失败,感染HIV,床旁检验(POCT)试剂测到抗体转阳可延迟1周,而WB转阳则延迟10 d以上[8]。还有一种情形值得注意——若在感染极早期(Fiebig Ⅰ期)即启动ART,治疗中,39%的患者会出现1次或多次WB结果“不确定”,48%的患者WB始终不转为阳性,仅有13%的患者WB转为阳性[9]。最后,HIV-2或HIV-1的O组毒株都可导致WB结果“不确定”。总之,早期感染、终末期艾滋病、感染极早期ART、预防性用药、罕见病毒株感染等情形,都挑战WB的诊断性能。(2)HIV低危人群血清存在干扰物质,导致WB出现假阳性显色条带,降低诊断特异性。在临床上,孕妇、自身免疫病患者、淋巴瘤患者等人群HIV抗体初筛试验,可呈现“弱阳性”,WB结果也往往为“不确定”。被检测者徒增精神负担的同时,其后续诊治也会受阻,给被检测者造成很大困扰。(3)WB结果判读本身主观性强,缺乏统一标准。不同品牌WB试剂的结果判断标准不同,不同学术组织判断标准也有所差别(见表1)。面对模棱两可的条带模式,操作者顾虑给被检者扣上“HIV阳性”帽子,选择保守地发送“不确定”结果,让被检者继续随访,从而牺牲了诊断的灵敏度和时效性;另一面,即使明知被测者是低危人群,“弱阳性”的酶联免疫吸附试验或化学发光筛查结果,极有可能是非特异性免疫反应引起,同样可导致非特异性WB条带,但顾虑发送“阴性”结果可能存在漏诊HIV感染,WB结果“不确定”便成了无奈的折中,同样降低了诊断特异性和时效性。
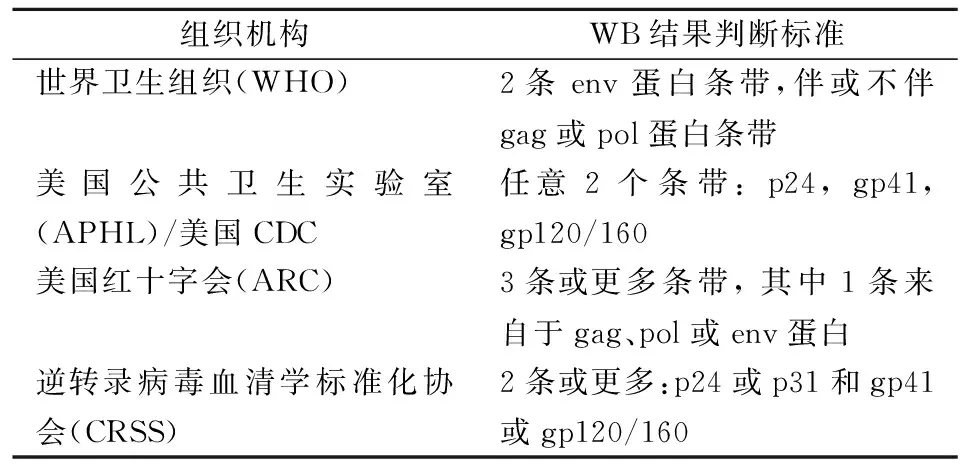
表1 不同组织判断HIV-1抗体WB结果的标准
1.2WB操作繁琐 从操作层面讲,WB手工操作繁琐、耗时,也无法实现全自动。与高通量、自动化、易于标准化的化学发光免疫检测和核酸检测相比,劣势明显。
1.3我国大部分地区WB报告流程周期过长 在现行HIV诊断体系下,大部分医院HIV初筛阳性样本需送至各级CDC,统一、批量进行WB,并出具确证报告,短则需要1~2周,长要近1个月;WB试验“不确定”结果,又建议2~4周后复测,周期进一步变长。对真正的HIV感染者,在感染早期,病毒载量高,传染力强,及时诊断并及时启动ART,可明显提高治疗应答率,并减少病毒传播,过长的结果报告周期不利于早诊和早治。另一方面,对很多非HIV感染的急症患者,面对“不确定”的WB结果,背负不必要的心理负担的同时,疾病诊治也有阻力。
2 HIV RNA检测的优势
鉴于WB的局限性,美国CDC从2014年起,不再推荐WB作为确证试验。筛查试验阳性样本,使用HIV-1/2抗体鉴别试剂复测,这种POCT在30 min内提供结果。抗体鉴别阴性或不确定样本,再继续检测HIV-1 RNA以明确是否感染(见图1)[10]。类似地,美国CDC在2013年即推荐用丙型肝炎病毒(HCV)RNA替代抗体确认试验,以明确诊断丙型肝炎。这2个导则仅相隔1年,理念也“异曲同工”。随着HCV RNA检测的推广,我国现阶段也没有了HCV抗体确认试验的临床需求,由此推断,降级甚至摒弃WB,符合病毒学诊断的发展趋势。
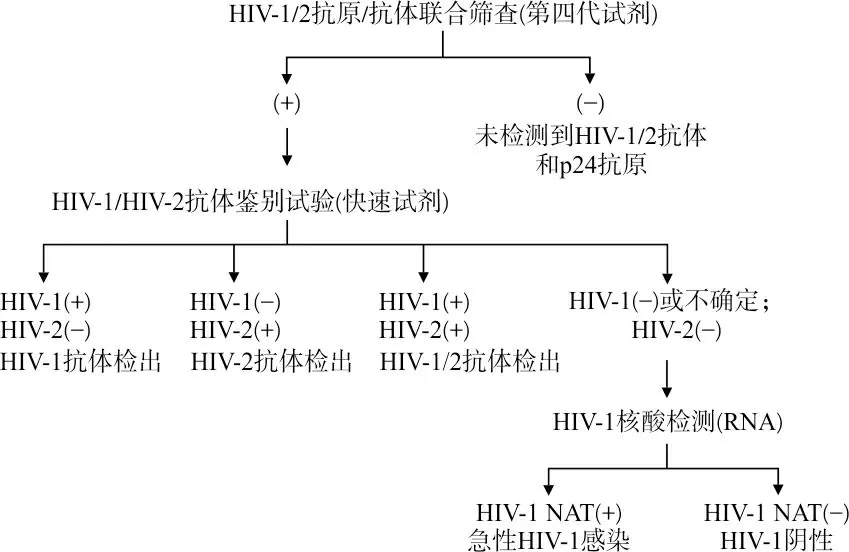
图1 美国CDC推荐的HIV实验室诊断策略
HIV RNA检测的优势在于:(1)缩短检测窗口期,提高急性感染诊断的灵敏度。在血站普及的献血者HIV RNA筛查已经证实,核酸筛查对进一步降低HIV经输血传播的残留风险功不可没;(2)如前所述,在感染早期启动ART患者、PrEP或PEP人群中,RNA仍然展现了比抗体更高的诊断灵敏度;(3)RNA可做筛查手段,也可作为确诊方法,还是启动抗病毒治疗及监测抗病毒治疗疗效的指标;(4)可用于新生儿HIV感染的确诊;(5)特异性高,很少受“不确定”结果的困扰;(6)更易实现检测的标准化,减少结果判断的主观性。
从临床诊断领域的大环境看,新型冠状病毒肺炎疫情极大促进了“核酸检测”概念的全民普及,各级医院PCR实验室建设和人员配备也趋于完善,客观上也为推广HIV RNA检测奠定了良好的基础。从技术上看,病毒核酸检测技术已相当成熟。基于实时荧光逆转录(RT)PCR技术的检测试剂是主流,高敏、宽线性范围的HIV RNA定量检测试剂的出现,使核酸检测用于感染筛查、临床确诊或治疗监测的界限日趋模糊。此外,目前还有部分试剂是基于等温扩增技术[11-12],如依赖核酸序列的扩增(NASBA)、转录介导的扩增(TMA)、环介导等温扩增(LAMP)等,相关专利也陆续到期,为其快速市场化提供了机遇。近些年,微流控芯片技术也在快速发展,促使检测平台微型化和POCT试剂的发展[13],有助于推动HIV RNA的个体化检测。
3 HIV RNA检测需要注意的问题
当然,在我国推广HIV RNA检测并取代WB也并非一蹴而就,HIV RNA检测本身也有一些问题亟待解决。
3.1HIV RNA试剂的性能尚未得到充分评价 获得国家药品监督管理局注册的进口或国产HIV-1 RNA试剂屈指可数,试剂性能并未得到充分的比对与评价。众所周知,HIV高度变异,设计引物和探针需避开突变。德国红十字会在270万例献血者中,发现4例献血员感染HIV,但某些国际主流品牌RNA试剂结果为“阴性”。 其中2例是由于试剂灵敏度不足而造成漏检,另外2例则是因为5′长末端重复序列(LTR)出现碱基缺失或突变,影响了引物或探针的结合,造成病毒载量被低估甚至漏检[14]。据此,德国Paul-Ehrlich研究所要求用于献血者筛查的HIV RNA试剂,应至少检测2个不同的病毒基因(如LTR、pol和gag等)[15],以规避漏检风险,当今SARS-CoV-2 RNA试剂的多靶点引物和探针设计理念与此不谋而合。相比欧美,我国HIV-1的组(group)和亚型分布有明显不同[16],现有核酸试剂(包括POCT试剂)可否覆盖我国特有的病毒株及其突变,灵敏度是否足够,都亟待充分的比较与评价。
3.2高敏HIV RNA的重要意义尚待强化 我国更新的指南或操作规范逐步提升了HIV RNA检测的地位[2,17],但又规定>5 000拷贝/mL的定量结果可作为诊断依据,而对≤5 000拷贝/mL的阳性HIV RNA结果,需要重新采样复测或结合其他指标综合判断。笔者认为,5 000拷贝/mL界限的设置有待商榷。第一,当前主流HIV RNA试剂,灵敏度可达每毫升几十拷贝,在遵循实验操作规范、杜绝气溶胶污染的前提下依然设置5 000拷贝/mL的诊断界值,是对其“高敏”性能的浪费。第二,现实世界中,有相当数量未经治疗的HIV感染者病毒载量在0~5 000拷贝/mL之间[18-19]。例如,陕西省有9.3%的感染者HIV RNA≤1 000拷贝/mL。设置>5 000拷贝/mL作为诊断界值,相当于无形中也设置了核酸检测存在“不确定”结果,和WB“不确定”结果一样,降低诊断效率。第三,高敏HIV RNA检测不仅是献血者筛查、临床确诊的需求,也是ART疗效监测和判断耐药的需求。例如,我国指南对病毒学失败的定义为,患者ART治疗48周后,病毒载量持续高于200拷贝/mL,或病毒学完全抑制后HIV RNA重新超过200拷贝/mL。低病毒血症(LLV)是病毒学失败和耐药的风险因素,新近一项研究发现LLV(2次或多次病毒载量在51~200拷贝/mL之间)与病毒学失败相关[20],提示使用高敏HIV RNA检测LLV,有潜在的预后预测价值。
需要注意,有2种情形可能单凭高敏RNA检测也无法做到HIV感染诊断,一种是HIV感染后不加干预,但外周血RNA被控制到无法检测水平,即处于所谓“精英控制者”(elite controllers)状态;另一种是感染者ART治疗后病毒血症消失,如果刻意隐瞒病史,单凭RNA检测也无法做到诊断。所幸这2种情形患者预后一般较好,病毒传播风险也极低[21]。
3.3预防性抗病毒治疗或感染极早期干预使HIV RNA结果解读复杂化 最新文献报道,PrEP或PEP以及感染极早期的抗病毒治疗,都可能延迟HIV RNA和抗体产生时间,并抑制其血清浓度,使HIV感染诊断变得极具挑战性[22],见图2。这些情形下,单凭一次或单个指标检测,很难得以确诊,需动态监测多种病毒标志物并结合其他临床指标综合诊断。
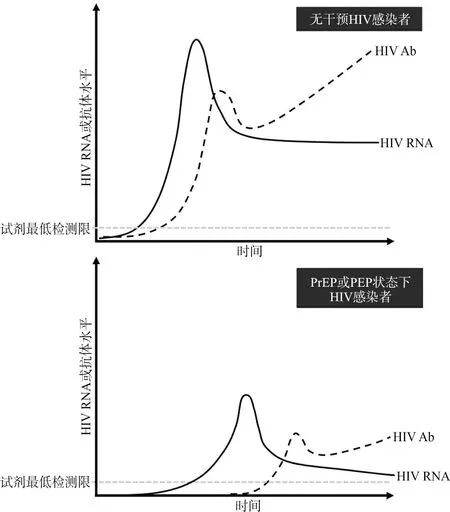
图2 预防性抗病毒治疗对HIV检验标志物的影响
3.4目前全球HIV-2感染情况尚不明晰 我国从上世纪末开始有零星的HIV-2病例的报道,随着国际交流合作的日益频繁,HIV-2在我国的流行情况需要密切关注[23]。因此,HIV-2 RNA试剂的市场前景需进行成本效益分析。
3.5HIV RNA定价过高 当前国内HIV RNA试剂价格远高于同类产品(如HCV RNA和SARS-CoV-2 RNA),一次HIV RNA检测动辄上千元,从检验技术角度看,HIV RNA检测并没有特殊的技术门槛和研发成本,因此其价格不应一直高高在上,阻碍其推广应用。
4 HIV实验室诊断发展趋势展望
我国各省市经济情况不同,实验室水平不一,同时,大部分HIV感染者并非处于早期阶段,WB作为传统的诊断技术,可以解决大部分的感染诊断问题。但HIV RNA检测对解决WB“不确定”结果,以及诊断早期感染和部分终末期艾滋病都有重要意义。此外,当今病毒感染实验室诊断已迈向核酸检测时代,条件成熟的地区,应考虑由HIV RNA逐步替代WB,成为HIV感染确诊的主要方法;中心化、高通量、全自动、高灵敏核酸检测和快速、个体化核酸检测2种模式共存,将进一步提高HIV感染诊断的准确性和时效性,助力达成联合国提出的“2030年终结艾滋病流行”的目标。
