亚抑菌浓度抗菌药物联合应用对多重耐药鲍曼不动杆菌生物膜形成的影响
2022-01-05李婧温海楠王惠刘焱超张盼邢恩鸿孙启玉谢守军承德医学院附属医院南区检验科河北承德067000
李婧,温海楠,王惠,刘焱超,张盼,邢恩鸿,孙启玉,谢守军(承德医学院附属医院南区检验科,河北承德 067000)
鲍曼不动杆菌(Acinetobacterbaumannii,Ab)是临床常见的革兰阴性条件致病菌,易引发呼吸系统、中枢神经系统、泌尿系统等多种系统的感染[1]。近年来,由于抗菌药物的滥用,多重耐药鲍曼不动杆菌(multidrug-resistantAcinetobacterbaumannii,MDR-AB)越来越多见,给临床的治疗带来极大的困难。鲍曼不动杆菌耐药性形成的机制复杂,其中生物膜的形成是其耐药性增加的重要因素之一。研究发现,当细菌以生物膜的形式存在时,抗菌药物很难穿透生物膜杀死其深部的细菌,从而易导致患者出现感染反复或迁延不愈的现象[2]。由于Ab耐药性的日益增加,常规的治疗药物在体内多处于亚抑菌浓度(subinhibitory concentration,sub-MIC)水平,即低于最低抑菌浓度(minimum inhibitory concentration, MIC)而对细菌具有选择作用的抗菌药物浓度。sub-MIC抗菌药物虽不能有效杀灭病原菌,却对细菌的生理行为存在潜移默化的影响,且其对菌株生物膜的影响也因抗菌药物和菌株种类的不同存在差异[3]。头孢哌酮舒巴坦为国内常用的治疗Ab感染的药物,具有较好的抗菌活性,但面对多重耐药的菌株时还需进行药物的联合使用[4]。研究发现,舒巴坦与亚胺培南或替加环素联合应用时,可以增加对MDR-AB的体外抗菌活性,但对生物膜的相关研究还未见报道[5]。故本研究拟探究sub-MIC头孢哌酮舒巴坦与替加环素或亚胺培南联合应用时对生物膜体外活性的影响。
1 材料与方法
1.1材料
1.1.1菌株来源 临床分离的MDR-AB 60株(对3类或3类以上抗菌药物中的每类抗菌药物至少1种药物获得性不敏感[6],同时剔除分离自同一患者相同部位的重复菌株),均由承德医学院附属医院南院检验科微生物室提供。鲍曼不动杆菌标准菌株ATCC19606购于北纳生物公司。
1.1.2主要试剂 头孢哌酮标准品,批号:903C021;舒巴坦钠标准品,批号:917A021;亚胺培南标准品,批号:924I022;替加环素,批号:608A022;LB肉汤,批号:1127L031;M-H肉汤,批号:119L031;结晶紫水溶液,批号:20210115,均购自北京索莱宝公司。培养细胞/细菌总RNA提取试剂盒,批号:W9202;cDNA第一链合成试剂盒,批号:W9209;荧光定量预混试剂,批号:U9208,均购自北京天根公司;引物由上海生工生物公司合成。
1.1.3主要仪器 基质辅助激光解吸电离飞行质谱仪、Vitek 2全自动微生物分析仪(法国生物梅里埃公司);酶联仪(美国Thermo公司);荧光定量PCR仪(美国罗氏公司)。
1.2方法
1.2.1结晶紫半定量法测定目标菌株生物膜形成能力 将收集的临床分离菌株复苏后接种于血平板上过夜培养,隔日挑取新鲜的单个菌落用生理盐水配制成0.5麦氏浊度单位的菌悬液,再用LB肉汤以1∶100的比例将其稀释,以每孔200 μL加入到96孔板中,每个菌株设3个复孔及1个不加细菌培养的阴性对照孔。在37 ℃温育48 h后,弃上层培养液,用PBS轻柔冲洗孔壁3次,置于通风处晾干。固定后于每孔内加入200 μL 10 g/L结晶紫水溶液染色10 min,弃去染液后用蒸馏水冲洗3次,于通风处晾干。每孔加入200 μL 30%冰醋酸,在结晶紫充分溶解后使用酶联仪在590 nm处检测其吸光度(A590 nm)。每株菌所测得的A590 nm值均值为X,阴性对照组所测A590 nm值均值为Xa,通过计算和比较,将目标菌株生物膜形成能力分为以下4类:X≤Xa为阴性(-),Xa
1.2.2微量肉汤稀释法测定目标菌株MIC值 挑选生物膜形成能力较强(阳性和强阳性)的菌株,分别检测其头孢哌酮舒巴坦(头孢哌酮与舒巴坦钠的比值为2∶1)、替加环素和亚胺培南的MIC值。菌株划线接种于血平板,37 ℃培养24 h,用接种环挑取单菌落将菌悬液调至0.5麦氏浊度单位,后用1∶100的M-H肉汤进行稀释,每孔加入100 μL菌液。将药物通过M-H肉汤分别倍比稀释为1 024 μg/mL、512 μg/mL、256 μg/mL、128 μg/mL、64 μg/mL、32 μg/mL、16 μg/mL、8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL后,再将其分别以100 μL加入相应孔中,每株设3个复孔,并记录每孔的终浓度。37 ℃温育24 h后,无细菌生长处对应浓度即为该菌的MIC。
1.2.3结晶紫半定量法测定sub-MIC联合用药后菌株生物膜形成能力 将挑选的生物膜形成能力较强的菌株复苏后接种于血平板上过夜培养,隔日挑取新鲜的单个菌落用生理盐水配制成0.5麦氏浊度单位的菌悬液,再用LB肉汤以1∶100的比例将其稀释,以每孔100 μL加入96孔板。用LB培养基分别将替加环素、头孢哌酮舒巴坦和亚胺培南稀释成0、1/8、1/4、1/2 MIC系列浓度,采用棋盘法将不同浓度的替加环素和头孢哌酮舒巴坦、亚胺培南和头孢哌酮舒巴坦分别进行两两组合,再以每孔100 μL加入相应孔中(每组设立1个不加药物的阳性对照组)。37 ℃温育48 h后,用结晶紫半定量法测定生物膜形成情况,每株进行2次重复实验。
1.2.4荧光定量PCR测定生物膜形成相关基因的表达水平 选取具有代表性的5株临床分离株A2、A5、A17、A41、A43(分别分离自尿液、痰液、导管尖端、脓液和胆汁)和ATCC19606进行生物膜形成相关基因的检测。采用实时荧光定量PCR(RT-PCR)技术分别检测联合用药前后ompA、adeG、bap和abaI基因的相对表达情况,并以16S RNA作为内参。按照培养细胞/细菌总RNA提取试剂盒的要求分别提取用药前后细菌的总RNA,按照cDNA第一链合成试剂盒的说明书将RNA逆转录为cDNA,以cDNA为模板进行荧光定量PCR(引物序列见表1)。荧光定量PCR反应体系共20 μL:2×SuperReal PreMix Plus 10 μL,上、下游引物(10 μmol/L)各0.6 μL,cDNA模板1 μL,无酶ddH2O 7.8 μL。反应条件:95 ℃预变性15 min;95 ℃变性10 s,55~60 ℃退火20 s,72 ℃延伸20 s,共40个循环。采用相对定量法计算目的基因的2-△△Ct值从而测定其相对表达量,△Ct=目的基因Ct值-内参基因Ct值。

表1 引物序列和退火温度
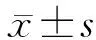
2 结果
2.1MDR-AB生物膜形成能力 阴性对照组所测A590 nm值均值Xa=0.05,X>Xa即表明该菌株具有生物膜形成能力。60株MDR-AB中57株(占95%)具有生物膜形成能力。其中生物膜形成能力弱阳性(+)的有25株(占44%),形成能力阳性(++)的有28株(占49%),形成能力强阳性(+++)的有4株(占7%)。
2.2MIC的测定 替加环素对MDR-AB的MIC范围为0.5~8 μg/mL,头孢哌酮舒巴坦(2∶1)对MDR-AB的MIC范围为128~256 μg/mL,亚胺培南对MDR-AB的MIC范围为64~512 μg/mL。
2.3单独及联合用药对MDR-AB生物膜的体外效果 sub-MIC下,单独应用头孢哌酮舒巴坦、替加环素和亚胺培南与阳性对照组相比,A590 nm值差异均存在统计学意义(P<0.05)。
加入1/2 MIC替加环素后与单独应用1/8、1/4和1/2 MIC头孢哌酮舒巴坦相比,A590 nm值显著下降,加入1/4 MIC替加环素后与单独应用1/8和1/4 MIC头孢哌酮舒巴坦相比,差异也存在统计学意义(P均<0.05);加入1/4和1/2 MIC头孢哌酮舒巴坦后与单独应用1/8、1/4和1/2 MIC替加环素相比,A590 nm值显著下降,加入1/8 MIC头孢哌酮舒巴坦后与单独应用1/8和1/4 MIC替加环素相比,差异也存在统计学意义(P均<0.05)。见表2。

表2 头孢哌酮舒巴坦联用替加环素对MDR-AB生物膜的作用效果
加入1/8、1/4和1/2 MIC亚胺培南后与单独应用1/8和1/4 MIC头孢哌酮舒巴坦相比,A590 nm值显著下降;加入1/2 MIC亚胺培南与单用1/2 MIC头孢哌酮舒巴坦相比,差异也存在统计学意义(P均<0.05);加入1/4和1/2 MIC头孢哌酮舒巴坦后与单独应用1/8、1/4和1/2 MIC亚胺培南相比,A590 nm值显著下降;加入1/8 MIC头孢哌酮舒巴坦与单用1/8和1/4 MIC亚胺培南相比,差异也存在统计学意义(P均<0.05)。见表3。

表3 头孢哌酮舒巴坦联用亚胺培南对MDR-AB生物膜的作用效果
2.4生物膜相关基因的相对表达 以1/4 MIC替加环素+1/4 MIC头孢哌酮舒巴坦和1/4 MIC亚胺培南+1/4 MIC头孢哌酮舒巴坦作用于菌株ATCC19606、A2、A5、A17、A41和A43后,对细菌生物膜均具有较好的抑制作用,故以该2种联合用药的浓度为代表,对其生物膜相关基因的表达情况进行分析,结果见图1。在替加环素+头孢哌酮舒巴坦的作用下,ATCC19606的ompA、adeG和bap表达水平受到显著抑制,A2和A43的ompA、abaI、adeG和bap表达受到显著抑制,A5的adeG和bap表达受到显著抑制,A17和A41的abaI、adeG和bap表达受到显著抑制(P均<0.05);在亚胺培南+头孢哌酮舒巴坦的作用下,ATCC19606的abaI、adeG和bap表达受到显著抑制,A2和A43的ompA、abaI、adeG和bap表达受到显著抑制,A5的ompA、abaI和bap表达受到显著抑制,A17和A41的abaI、adeG和bap表达受到显著抑制(P均<0.05)。

注:SCF,头孢哌酮舒巴坦;IMP亚胺培南;TGC,替加环素。*,与无药物作用的对照株相比,P<0.05。图1 sub-MIC头孢哌酮舒巴坦联合替加环素或亚胺培南对MDR-AB生物膜相关基因表达的影响
3 讨论
本实验中95%的MDR-AB均具有形成生物膜的能力,且其中56%的菌株该能力较强,这与Badave等[12]的研究存在一致性,提示生物膜的形成与其耐药性之间可能存在正相关性。本研究发现,在MIC范围内单独应用头孢哌酮舒巴坦、替加环素和亚胺培南时,该3种药物对MDR-AB生物膜的形成均具有一定的抑制作用,且生物膜的抑制效果与药物浓度呈正比。对于sub-MIC亚胺培南的生物膜作用效果,本研究与国内学者曹诗悦[13]的结果一致。但近年来也有学者发现sub-MIC的亚胺培南可上调Ⅳ型菌毛基因的表达并诱导MDR-AB生物膜的形成[14],说明sub-MIC抗菌药物对菌株生物膜的调节机制复杂,还存在较多争议,有待进一步的研究确认。当sub-MIC头孢哌酮舒巴坦与替加环素或亚胺培南联合应用时,相比于单独的药物应用均具有更好的生物膜抑制效果,提示该2种药物的联合应用也许可以更有效地穿透生物膜并影响生物膜形成相关的调控因子,从而使得较低浓度的药物联用也能有效抑制生物膜的形成,达到更好的抗菌效果。
Ab生物膜形成的机制十分复杂,与细菌群体感应系统(quorum sensing,QS)、外膜蛋白、生物膜相关蛋白以及外排泵等多种因素都存在密切关系[15-18]。因此,本研究分别选择群体感应相关基因abaI、外膜蛋白A基因ompA、生物膜相关蛋白基因bap和外排泵相关基因adeG为代表,检测sub-MIC头孢哌酮舒巴坦联用替加环素或亚胺培南时是否会对上述调节系统产生影响。结果发现,在这2种方式的药物联合作用下,该4种基因的表达均呈现出下调的趋势,与生物膜的减少存在显著相关性。提示该4种调控机制可能都参与该2种联合用药对MDR-AB生物膜抑制的调节当中,且abaI、ompA、bap和adeG可能是sub-MIC头孢哌酮舒巴坦联用替加环素或亚胺培南抑制生物膜形成的作用靶点,但由于检测的菌株量较少,具体的机制还有待进一步研究。
综上所述,MDR-AB具有较强的生物膜形成能力,sub-MIC头孢哌酮舒巴坦与替加环素或亚胺培南联合应用,对MDR-AB生物膜的形成仍具有较好的抑制作用,为临床治疗MDR-AB的相关感染提供了一定的理论依据。
