基于Ru/HZSM-5的生物油在线催化提质耐久性研究
2022-01-05熊永莲卢东升樊永胜侯光喜陈玉炜
熊永莲 ,卢东升 ,樊永胜,2,* ,侯光喜 ,陈玉炜
(1.盐城工学院 汽车工程学院,江苏 盐城 224051;2.京都大学 能源科学研究科,日本 京都 6068501)
生物质直接热解所得生物油具有含氧量高、热值较低、腐蚀性强和稳定性差等缺点[1]。在线催化裂解技术因其有效性和经济可行性,受到广泛关注[2]。HZSM-5分子筛因具有适宜的孔道结构、较强的酸性和较高的水热稳定性,被广泛用于生物油催化裂解[3]。ZHAN等[4]采用多种催化剂(ZrO2、TiO2、HZSM-5、MCM-41和 Mg(Al)O)进行生物质热解催化提质实验,结果表明,在减少含氧化合物、制取芳香烃方面,HZSM-5是最有效的催化剂。然而,在提质过程中催化剂上逐渐沉积的焦炭和焦油导致催化提质效率降低[5]。Mullen等[6]采用HZSM-5对缺氢生物质进行催化裂解时,发现烃类生成逐渐受到限制,并会在催化剂上沉降聚合形成焦炭,最终致使催化剂失活;而Muller等[7]在甲醇制烯烃(MTO)的实验中研究HZSM-5结焦和失活,发现催化剂失活是个由快到慢的过程,而催化提质生物油亦存在失活过程,但对该变化过程的研究报道较少。
目前,众多金属改性HZSM-5被用于生物油催化提质研究,可以明显提高催化剂对芳香烃的选择性和抗结焦性能[8]。Wang等[9]发现,Ru和Ni改性HZSM-5可以显著提升费托合成制取汽油碳数范围烃类的反应效率;Dong等[10]研究表明,Ru/HZSM-5是将糠醛还原胺化为糠胺的高效且可回收的催化剂;Sun等[11]采用Ru-Mo改性碳纳米管作为催化剂,可以在生物质含氧化合物加氢脱氧制备烃类中,明显提升产物产率和烃类选择性。因此,Ru改性HZSM-5在提质生物油方面具有较大潜力,但在这方面研究报道较少。同时,现有研究主要集中在改性催化剂性能和生物油品质及组成的比较[12]。而从生物油燃料品位和催化剂性能两方面变化,综合分析生物油在线催化提质耐久性的研究则鲜有报道。
因此,本研究采用Ru改性HZSM-5在线催化提质生物油,从生物油和催化剂两方面的劣化过程,分析Ru/HZSM-5催化提质生物油的耐久性。分析催化剂使用不同时间后生物油的产率和理化性质,提出生物油的综合品质指数(Total quality index,TQI),表征其品质劣化过程;并对生物油化学组成变化进行分析。对使用不同时间的催化剂进行结焦量分析和微观形貌表征,探讨催化剂结焦失活机理,为生物质高效转化利用提供理论参考和实验依据。
1 实验部分
1.1 材料准备和分析
采用的生物质原料为油菜籽壳,收集于盐城市郊农场。实验前,将自然风干的油菜籽壳粉碎成粒径100-150 μm的细小颗粒,并在105 ℃下干燥24 h,以除去外部水分。参照ASTM D-2974,对试样进行工业组成分析,结果表明,油菜籽壳是由6.12%水分、72.84%挥发物、17.35%固定碳和3.69%灰分组成。采用FLASH 1112A型元素分析仪进行元素分析,油菜籽壳含有42.22%碳、5.53%氢、0.41%氮和51.84%氧。根据元素组成[13]计算的高位热值(Higher heating value, HHV)为15.92 MJ/kg。
1.2 催化剂的制备与表征
HZSM-5分子筛原粉购自于天津南化催化剂厂,硅铝物质的量比为50。采用浸渍法制备Ru改性催化剂:将HZSM-5原粉置于马弗炉中于550 ℃下煅烧 2 h,将 3.35 g RuCl3·H2O(CAS: 14898-67-0)溶解在100 mL去离子水中并滴加到30 g原粉中,在磁力搅拌器中于80 ℃恒温搅拌4 h,然后转移至干燥箱中于110 ℃恒温干燥4 h,最后在马弗炉中于550 ℃煅烧4 h,得到改性催化剂,标记为Ru/HZSM-5。金属Ru与HZSM-5质量比为5%。
采用Bruker D8 Advance型X射线衍射(X-ray diffraction, XRD)仪表征催化剂晶体结构,以CuKα(波长λ= 0.15406 nm)为辐射源,管电流为30 mA,管电压为 40 kV,扫描速率为 5(°)/min,扫描 5°-80°。采用Frontier型红外光谱仪配合真空吸脱附系统,进行吡啶-红外光谱(Pyridine/infrared spectrum,Py-FTIR)分析,测定B酸和L酸分布,测试和计算方法如文献[2]所述,得到B酸(红外吸收波段为1545 cm-1)和L酸(红外吸收波段为1450 cm-1)的浓度。采用Micromeritics ASAP 2460型分析仪测量催化剂纹理性质:将样品装入试管中,加热至280 ℃,在预处理器上真空处理2 h,冷却至室温(20 ℃)后,于-196 ℃ 进 N2吸附-脱附测试,通过密度泛函理论(Density functional theory, DFT)获得比表面积(SDFT)和孔容(vDFT),并根据t-plot法获得微孔比表面积(Smicro)、微孔孔容(vmicro)和平均孔宽。
1.3 实验装置和过程
生物油在线催化提质实验系统如图1所示,该系统主要由温控器、催化反应器、过滤器、截止阀、集气袋、真空泵、稳压筒、冷却塔、生物油收集器、冷阱、热解反应器等组成[14]。

图1 生物油在线催化提质实验系统Figure 1 Experimental system for online catalytic upgrading of bio-oil
每次实验,热解反应器中填装的生物质质量为150 g,催化反应器装载的催化剂质量为30 g,对应催化床层高度为30 mm。通过截止阀B调节体系压力至5 kPa,使反应体系处于无氧状态,避免了惰性载气的消耗,且有利于降低产物沸点,同时,产物在真空泵的抽吸下易快速逸出[15]。然后将催化反应器加热至500 ℃,再以20 ℃/min的升温速率开始加热生物质,终温为500 ℃,并保持终温10 min。在真空泵的抽吸下,生物质热解气逸出并进入催化层,经过提质后的热解气在冷却塔中经充分冷凝后流入生物油收集器。不可冷凝气体经真空泵后,进入集气袋。实验结束后,关闭截止阀B,打开截止阀C,氮气瓶向系统中引入保护气,防止生物油和催化剂与空气发生反应。待系统冷却至室温后,停止通入氮气,并对生物油和催化剂进行分离和采样。催化剂保存在真空袋中以避免化学组成和性质的改变。称量得到生物油质量,并以生物质质量为基准,计算生物油产率。
每次实验耗时约为30 min。每次实验后,重新填装生物质,催化剂连续使用4次,生物油品质出现明显恶化,理化性质接近生物原油。实验进行30、60、90和120 min后,分别收集催化剂样品,并标记为SC-1、SC-2、SC-3、SC-4。并将得到的对应生物油分别标记为BO-1、BO-2、BO-3和BO-4。作为对照,将生物质直接热解制取的生物原油标记为BO-0。
1.4 生物油分析
参照GB/T 7304—2014,采用CT-6021A型数字pH计测定生物油酸度。参照GB/T 213—2008,采用YINGTE ZDHW-5G型量热仪测定生物油HHV。参照GB/T 17144—1997,借鉴石油产品残炭测定法(微量法),测量生物油残炭量。采用FLASH 1112A型元素分析仪检测生物油元素组成。为便于分析比较,定义综合品质指数(TQI),计算公式如下:
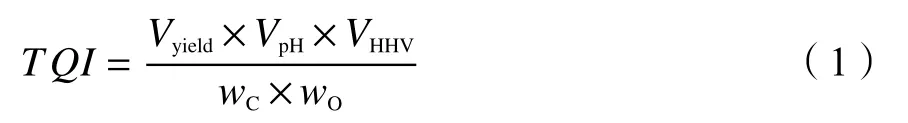
式中,Vyield、VpH、VHHV、wC和wO分别是生物油产率、pH值、高位热值、残炭量和含氧量基于均值归一化后的数值,即归一化前的真实数据除以对应数据组的平均值。因为不同理化性质数据之间的数量级差异较大,不能简单地将真实值代入。
为更加清晰地分析生物油化学组成的变化,采用Agilent 7890A型气相色谱-质谱联用仪(Gas chromatography/mass spectroscopy, GC-MS)分析BO-0、BO-2和BO-4试样的有机物组成。采用HP-5型色谱柱,载气为He(99.999%),进样口温度为250 ℃,进样量为 1 μL,离子源温度为 250 ℃,传输线温度250 ℃,电离模式为EI,电离能为70 eV,30-500 (质荷比)质量扫描,扫描1 s,溶剂(二氯甲烷)延迟时间3 min。升温程序:40 ℃保持2 min后,以 20 ℃/min升至 100 ℃,再以 10 ℃/min升至250 ℃,并在 250 ℃ 保持 3 min。
1.5 使用后催化剂表征
采用Thermo TGA 1型热重分析仪测量不同使用时间时催化剂的结焦量。试样质量为10 mg,载气为空气,流量为50 mL/min,以10 ℃/min升温速率将试样从40 ℃加热至800 ℃,同步记录热重曲线(Thermo-gravimetric, TG)和微分热重曲线(Differential thermo-gravimetric, DTG)。
采用Hitachi S-4800型扫描电子显微镜(Scanning electron microscope, SEM)观察催化剂使用前后颗粒形态特征;同时,采用Phlipis Tecnai 12型透射电子显微镜(Transmission electron microscopy, TEM)观测催化剂上焦炭分布情况。
2 结果与讨论
2.1 催化剂的表征
HZSM-5及Ru/HZSM-5的XRD谱图如图2所示。由图2可见,HZSM-5分子筛的典型衍射峰(2θ= 7.96°、8.83°、23.18°、23.99°、24.45° (粉末衍射标准联合委员会(Joint committee on powder diffraction standards, JCPDS): 粉末衍射文件(Powder diffraction file, PDF) 44-0003))均明显,但Ru改性后,由于改性物质的覆盖遮挡,使衍射峰强度明显降低。在Ru/HZSM-5上,检测到RuO2(JCPDS: PDF 43-1027)和Ru2Al3(JCPDS: PDF 19-0046),表明可能有少量Ru与骨架铝发生键合。

图2 催化剂的XRD谱图Figure 2 XRD patterns of catalysts
催化剂酸性和纹理性质的表征结果列于表1中。由表1可见,Ru改性后,催化剂上L酸量减少,主要因为非骨架铝的减少;而B酸量明显增加,表明Ru改性物种引入了更多的强酸位,有利于生物油大分子的裂解过程[16]。同时,Ru改性导致催化剂比表面积和孔容降低。相关研究表明,较多的金属负载物会部分团聚,并进入部分微孔孔道,形成阻塞,进而使比表面积和孔容降低[17];而少量Ru和骨架Al的键合会使部分骨架结构塌陷,同样会造成比表面积和孔容降低。而催化剂改性后平均孔宽有所增大,得益于改性过程中所形成的HCl,会去除晶间堆积通道中的一些非晶态颗粒,使平均孔宽增大。

表1 催化剂的酸性和纹理性质Table 1 Acidity and texture properties of catalysts
2.2 生物油分析
2.2.1 产率与理化特性
生物油产率、理化特性和TQI数值列于表2中。由表2可见,使用新鲜催化剂时,生物油含氧有机物中的氧元素以CO、CO2和H2O形式被大量去除,以芳香烃为主的烃类产物显著增加,因此,生物油残炭量和含氧量分别从16.72%和50.86%大幅下降至3.35%和22.09%,pH值和HHV则显著升高至6.20和32.81 MJ/kg,但生物油产率则由43.52%降至32.08%,综合品质指数TQI达到6.45。与其他金属改性相比,采用Ru/HZSM-5制取的生物油产率较高,且品质相对较好。李小华等[18,19]采用P、Zn、Fe、Co、Cu改性 HZSM-5催化提质生物质热解气,所得生物油产率在20%左右,生物油pH值亦偏低。Veses等[20]采用多种金属改性HZSM-5催化提质生物油,结果表明,Mg、Ni、Cu、Ga改性催化剂对生物油pH值和HHV的提升均低于本研究。

表2 生物油产率、理化特性和TQI的变化Table 2 Change of bio-oil yields, physicochemical properties and TQI values
当催化剂使用第2次时,与BO-1相比,生物油BO-2产率升高,但pH值和含氧量均有所下降,HHV和残炭量则略有升高,TQI进一步升高至6.68,增幅较小,表明使用一定时间的催化剂有利于同时提升生物油产率和理化特性。Wang等[21]对改性HZSM-5进行了预结焦处理,并利用预结焦的催化剂提质生物油,结果发现,当HZSM-5预结焦量为2.7%时,尽管催化剂部分理化性质有所钝化,但在提高烃类产物选择性和提升碳转化率方面均具有较好的效果。当催化剂使用第3次时,与BO-2相比,生物油BO-3产率继续升高,但各项理化特性参数恶化明显,pH值和HHV分别从6.12和32.90 MJ/kg降至 4.44和 26.26 MJ/kg,而残炭量和含氧量分别从3.55%和21.98%升高至7.89%和33.93%,表明由于较多焦炭覆盖活性位点,并堵塞孔道,此时催化剂已经部分丧失了催化重整能力,生物油产率的升高,主要是由较多较大的含氧有机物未被充分转化而引起,TQI从6.68急剧下降至1.25,催化剂活性损失明显。当继续使用催化剂时,与BO-3相比,生物油BO-4的产率与各项理化特性均接近BO-0,表明此时催化剂活性几乎全部丧失;与BO-0相比,产率仍下降,理化特性参数亦较优,但这已经不是催化反应引起的,而是主要由热解气在催化剂层的二次裂解造成的。
2.2.2 GC-MS分析
由TQI变化可见,BO-2品质较优;当催化剂使用3次后,生物油品质明显恶化。为分析生物油品质的差异性,对BO-0、BO-2和BO-4的化学组成进行分析比较,结果如图3(a)所示。由图3(a)可见,按有机物类别,将生物油中检测到的有机物分为烃类、酸类、醇类、醛/酮类、酚类等6类。与BO-0相比,BO-2中各类含氧有机物均明显减少,烃类相对含量达53.79%,其中,轻质脂肪烃(light aliphatic hydrocarbons, LAHs)相对含量为16.87%,单环芳香烃(monocyclic aromatic hydrocarbons, MAHs)相对含量为32.65%,还有少量多环芳香烃(polycyclic aromatic hydrocarbons, PAHs),相对含量为 4.27%;而BO-0中不含芳香烃,仅有相对含量为5.01%的轻质脂肪烃。因此,在使用初期,Ru改性HZSM-5具有较强的芳构化性能,且转化性能处于逐渐上升阶段,这是因为新鲜改性的催化剂具有较多B酸性位点,拥有较强的酸性,初期对生物油中有机物的裂解作用较强,使用一定时间后,随着部分B酸位的弱化和钝化,更适合有机物分子在B酸位上经过β位断裂生成以C2-C4为主的烯烃碎片,此类烯烃碎片更容易齐聚环化,并在L酸位上环脱氢生成芳香烃[22]。在反应产物扩散和冷凝过程中,会有少量MAHs聚合形成PAHs[23]。与BO-2相比,BO-4组成明显恶化,各类含氧有机物相对含量均升高,烃类相对含量大幅下降至9.32%,包括3.07%的LAHs和6.25%的MAHs,催化剂芳构化转化性能损失较大,主要归因于大量孔道被沉积的焦炭堵塞,活性位点被大量覆盖[24]。因此,在生物油在线提质过程中,Ru/HZSM-5芳构化性能先增强后快速下降,结焦致使活性下降过程极为迅速。
对生物油中有机物的碳原子数进行统计分析,结果如图3(b)所示。由图3(b)可见,生物油中检测到的主要有机物碳数分布在C4-C14,与汽油的C4-C12碳数高度重合,表明Ru/HZSM-5催化所得生物油具有进一步制成汽油组分或添加剂的潜力。与BO-0相比,BO-2的碳数趋向降低,且更加符合正态分布,C7为中间高位值,没有检测到C14化合物,主要得益于催化剂此时良好的裂解与芳构化性能,形成了以MAHs为主的有机产物。与BO-2相比,BO-4的碳数明显增加,C8为中间高位值,接近BO-0的碳数分布,但C5、C9、C11和C14化合物明显多于BO-0,此时催化剂层已基本丧失提质性能,并带来两个方面的影响:一是部分有机物在催化剂层发生二次热裂解形成较小碳数的有机物;二是部分有机物受到催化剂层的缓冲和阻滞,可能会聚合产生较大碳数的有机物。从分析结果判断,两方面影响应当是并存的。
为了更好分析上述判断的准确性,对生物油中有机物的氧原子数进行统计分析,结果如图3(c)所示。由图3(c)可见,与BO-1相比,BO-2中含1个氧原子的O1化合物稍有增加,其他含氧有机物均明显减少,且未检测到O4化合物。与BO-2相比,BO-4中O1、O2和O3化合物均增加,但未检测到O4化合物,表明此时催化作用微弱,但仍存在裂解效应,使高含氧有机物部分裂解脱氧为低含氧有机物;同时,与BO-0相比,BO-4中O2和O3化合物含量有限的下降,是其转化为O1化合物与O1化合物聚合形成O2或O3化合物的综合结果。在BO-0中共检测到20种主要化合物,而在BO-4中共检测到25种主要化合物,其中,有10种化合物相同,其名称、结构、分子式及含量列于表3中。由表3可见,与BO-0相比,BO-4中10种化合物中有7种化合物含量低于BO-0,仅有2-甲基-2-环戊烯-1-酮、2-甲氧基-4-甲基-苯酚和 (4-羟基-3-甲氧苯基)-2-乙醇的含量高于BO-0,表明大部分有机物确实在催化层经历了二次裂解,少数化合物会聚合使部分有机物含量增加。因此,丧失提质作用的催化剂层对生物油组成会产生不利影响。

表3 BO-0与BO-4中相同化合物含量对比Table 3 Comparison of the contents of the same compounds in BO-0 and BO-4

图3 生物油的化学组成Figure 3 Chemical compositions of bio-oils
2.3 结焦催化剂的表征
2.3.1 TGA分析
对不同使用次数的催化剂进行热重分析,结焦催化剂的TG和DTG曲线如图4所示。由图4可见,结焦催化剂的失重过程可分为3个阶段:300 ℃以下为第一失重阶段,主要由水和低沸点物质挥发引起;300-700 ℃为主失重阶段,归因于焦炭及其前驱物的氧化分解;700 ℃以上为失重恢复稳定阶段。从800 ℃时的总失重量变化角度,第2次使用后的失重增加量相对较小,此时催化剂具有较高活性;而当第3次使用后,催化剂失重量急剧增大,结合生物油TQI值及GC-MS分析,表明催化剂快速结焦引起催化活性迅速恶化;当继续使用催化剂时,催化剂失重量继续小幅增加,但DTG失重峰形状和位置变化较大。

图4 结焦催化剂的TG和DTG曲线Figure 4 TG and DTG curves of coked catalysts
采用高斯法对300-700 ℃主失重阶段的失重峰进行拟合分析,以更好地分析焦炭组成的差异性,拟合结果列于表4中。将500 ℃左右的低温主失重峰对应的焦炭,定义为L型焦炭,而将600 ℃左右的高温肩峰对应的焦炭,定义为H型焦炭。由表4可见,第2次使用后催化剂DTG曲线失重峰位置未发生明显变化,焦炭的增加量主要以L型焦炭为主。Mukarakate等[25]在HZSM-5催化提质松木热解气过程中,发现结焦反应最初发生在催化剂外表面,微孔孔道结构在初期基本上是完好无损的。Valle等[26]指出结焦HZSM-5的低温失重峰主要由热解型焦炭引起,而在较高温度下分解的为催化型焦炭。前者主要为半氢化或含氧型焦炭,后者多为完全碳化型焦炭[27]。因此,使用2次后催化剂上结焦的焦炭仍以半氢型或含氧型热解焦炭增加为主。而当使用3次后,失重峰峰值温度明显向高温方向偏移,且两种类型焦炭均明显增加,表明此时催化剂活性迅速下降,主要是由碳化型催化焦炭在孔道中产生,并迅速堆积堵塞而造成的。Jia等[28]指出在生物质热解气提质过程中产生的微孔焦炭毒性明显大于外部焦炭和中孔焦炭,微孔焦炭前期深埋于催化剂中,严重恶化催化性能且难以去除。使用3次后的催化剂已严重失活,因此,继续使用后,结焦催化剂的失重峰,尤其是主失重峰向低温方向明显回偏,表明催化剂失活后,热解气在催化层的二次裂解继续增加了半氢化或含氧型热解焦炭。

表4 不同使用时间后催化剂的结焦量Table 4 Coke contents of the catalysts after different usage time
2.3.2 SEM与TEM分析
不同使用次数后催化剂的电镜扫描和透射照片如图5所示。由图5(a)-(c)可见,与新鲜催化剂相比,使用2次后催化剂的颗粒粒度有所增大,色泽明显黯淡,表明此时催化剂经过两次使用,表面结焦明显,但焦炭并未明显堆积生长。而当使用4次后,催化剂颗粒明显增大,细颗粒及颗粒间隙因为焦炭包裹粘连而基本消失,色泽更加灰黑,此时催化剂颗粒间的孔隙大多被阻塞,会阻滞热解气通过催化层,进而诱使热解气发生二次裂解或聚合,进一步加剧催化剂结焦情况。由图5(d)、5(e)可见,催化剂使用2次后颗粒部分区域由于表面焦炭的阻挡呈灰褐色,但色泽分布均匀,表明内部孔道未出现明显焦炭堆积。当催化剂使用4次后,颗粒黑色区域加大加深,且出现很多浓黑点状区,表明孔道中确实出现焦炭堆积堵塞现象,造成催化性能恶化。即使仍有部分孔道清晰区域,也因为颗粒的交织重叠和相互黏连,而失去催化反应机会,致使催化层完全丧失提质能力。

图5 不同使用次数后催化剂的电镜扫描和透射照片Figure 5 SEM and TEM images of the catalysts after different usage time
3 结 论
采用Ru改性HZSM-5在线催化提质生物油,所得生物油产率和理化特性均较高,生物油TQI从0.15升至6.45;当第2次使用催化剂时,TQI继续小幅升高至6.68;而当第3次使用催化剂时,所得生物油TQI大幅下降至1.25,第4次使用后TQI为0.27,较接近生物原油。
初期少量结焦反应有利于钝化强酸位点,提升芳构化性能;当催化剂使用2次时,生物油中含氧有机物明显减少,烃类相对含量达53.79%,其中,LAHs相对含量为16.87%,MAHs相对含量为32.65%,且生物油碳数范围与汽油碳数范围高度重叠,具备制成汽油组分或添加剂的潜力;当使用4次时,生物油组成明显恶化,含氧有机物明显增加,烃类相对含量仅有9.32%,且丧失提质作用的催化剂层对热解气会产生二次裂解或聚合等不利影响。
前2次使用,催化剂焦炭主要为附着在表面的半氢型或含氧型低温热解焦炭,内部孔道结构基本保持完好;当使用3次时,热解焦炭和碳化型高温催化焦炭均显著增多,且孔道中焦炭快速堆积生长,催化剂活性急剧下降;当使用4次时,由于热解气二次裂解或聚合,使焦炭继续小幅增加,且以热解焦炭为主。
随着使用次数的增加,催化剂颗粒由于焦炭的覆盖包裹而逐渐增大,并相互黏连,进而阻滞热解气,导致二次裂解或聚合;当催化剂使用2次时,内部孔道未出现明显焦炭聚集,而当使用4次时,仍有部分孔道完好,但因为颗粒的重叠黏连,而失去催化机会,致使催化剂层完全丧失提质能力。
