直径<5 mm颅内动脉瘤破裂预后不良危险因素分析
2022-01-05郝以姝周天梅
郝以姝 周天梅
未破裂颅内动脉瘤(UIAs)在普通人群中较为常见,在全球成年人群中患病率约为3.2%[1],而我国流行病学调查则显示发病率约为7%[2]。随着头颅CTA、MRA及DSA等医学影像技术的快速发展进步,小直径颅内动脉瘤(IAs)检出率增高,但偶然发现的UIAs是否需要处理、一旦破裂影响其预后的危险因素等问题目前均未形成统一定论,且小动脉瘤的大样本临床研究相对较少。本文旨在探讨直径<5 mm的IAs破裂的危险因素及破裂所致蛛网膜下腔出血(SAH)患者预后不良的危险因素。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月至2020年1月杭州市中医院102例经CTA或DSA检查确诊的直径<5 mm颅内动脉瘤患者的临床资料。纳入标准:(1)经DSA或CTA确诊的直径<5 mm的单发UIAs;(2)头颅CT诊断有SAH,并经DSA或CTA证实为直径<5 mm的颅内责任动脉瘤(均为单发)。排除标准:(1)资料不全;(2)头颅CT诊断有SAH,但DSA阴性;(3)既往有动脉瘤性蛛网膜下腔出血(aSAH)史;(4)多发颅内动脉瘤;(5)既往有UIAs治疗史。其中未破裂组27例,男15例,女12例;年龄43~83岁,平均年龄(62.56±10.27)岁;破裂组75例,男29例,女46例;年龄18~84岁,平均年龄(59.15±11.81)岁。根据出院后28 d格拉斯哥预后量表(GOS)分级将破裂组分为预后不良组(I~III级)和预后良好组(IV~V级)。预后不良组29例,男14例,女15例;前循环动脉瘤18例,后循环动脉瘤11例;Hunt-Hess分级IV~V级15例,I~III级14例;行开颅动脉瘤夹闭手术3例,血管内介入治疗14例,保守治疗12例。预后良好组46例,男15例,女31例;前循环动脉瘤25例,后循环动脉瘤21例;Hunt-Hess分级 IV~V级2例,I~III级44例;行开颅动脉瘤夹闭手术7例,血管内介入治疗24例,保守治疗15例。
1.2 方法 分析未破裂组和破裂组患者的临床资料,包括一般情况(性别、年龄)、基础疾病(高血压病、糖尿病)、动脉瘤特征(部位、形态)。对破裂组患者预后良好和预后不良进行单因素分析,并对其预后不良的影响因素进行多因素分析。
1.3 统计学方法 采用SPSS 20.0统计软件。符合正态分布的计量资料以(x±s)表示;计数或等级资料以n表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 破裂组与未破裂组患者一般资料比较 破裂组和未破裂组在糖尿病、动脉瘤部位及形态方面差异有统计学意义(P<0.05)。见表1。
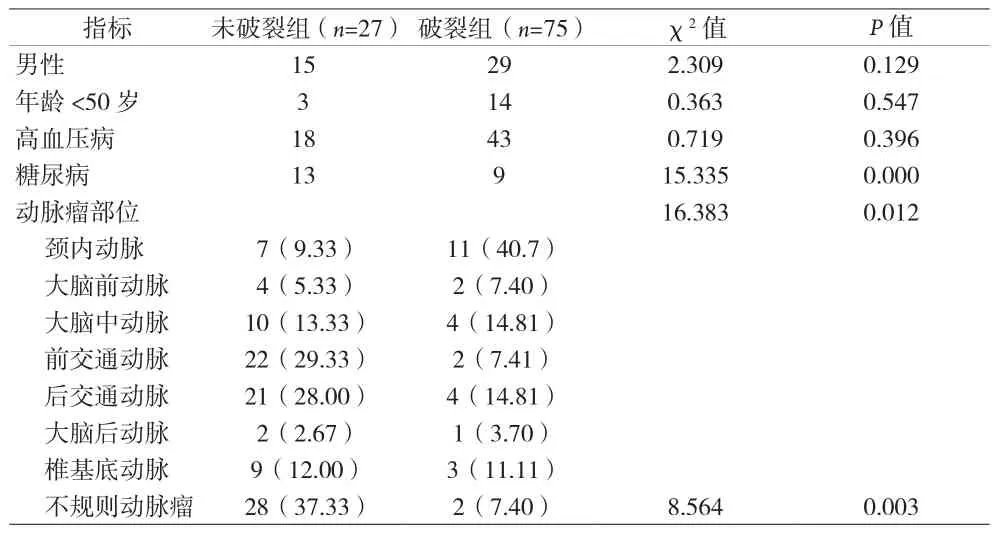
表1 破裂组与未破裂组患者的一般资料比较(n)
2.2 破裂颅内动脉瘤预后不良组和预后良好组资料比较 两组在Hunt-Hess分级方面差异有统计学意义(P<0.05)。见表2。
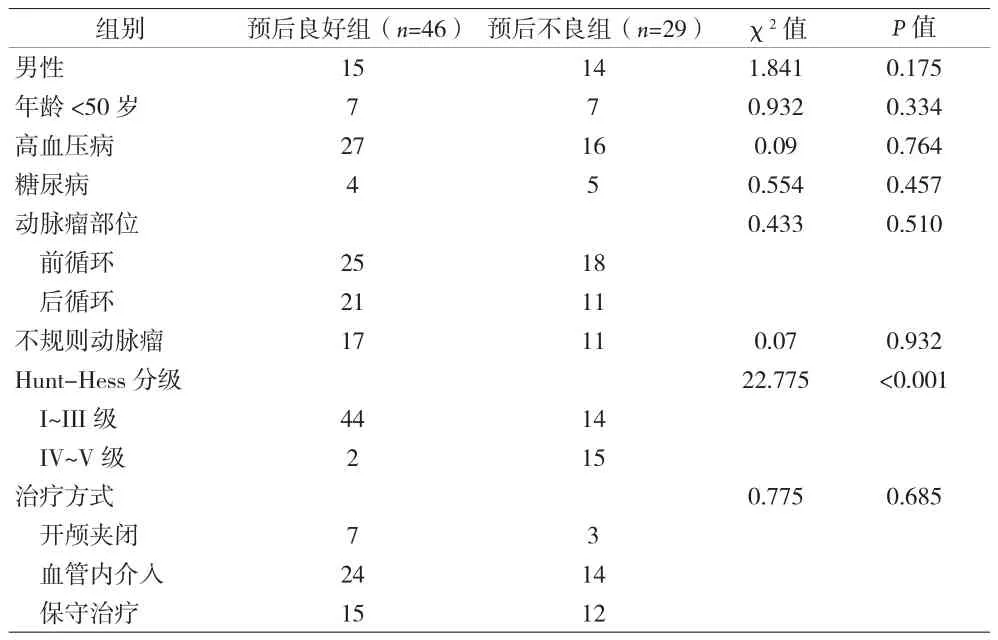
表2 破裂组与未破裂组患者动脉瘤特征比较(n)
3 讨论
2010 年SONOBE等[3]对374例患者共448个直径<5 mm的IAs进行平均41个月的随访,发现年龄<50岁、高血压、多发动脉瘤及直径≥4 mm为破裂的独立预测因素;2013年GURESIR等[4]对直径<7 mm的前循环小动脉瘤的研究发现类似结论,认为年龄<50岁和高血压为破裂的独立危险因素。本资料结果显示,未破裂组和破裂组在高血压、年龄<50岁方面差异无统计学意义。2015年UIAs管理指南中指出,和男性相比,女性患者的 IAs更易增大及破裂[5]。PALIWAL 等[6]与XU K等[7]在研究中均发现,女性为IAs破裂的独立预测因素。本资料中,破裂组女性患者(61.33%)比未破裂组(44.44%)高,但差异无统计学意义。性别对颅内动脉瘤破裂的影响可能与女性激素水平相关,绝经后女性雌激素水平下降,导致动脉管壁胶原蛋白含量减少,从而引起管壁弹性降低、脆性增加,IAs破裂出血风险升高[8]。
患者血糖水平对IAs破裂的影响目前尚有争议。CAN等[9]研究发现降糖药物使用与IAs破裂破裂呈负相关;而SCHLENK等[10]认为高血糖与IAs的破裂无明显相关性。本资料结果显示,与破裂组相比,未破裂组糖尿病患者比例显著增高,且差异有统计学意义。可能与破裂组患者平均年龄更小、糖尿病患病率低及糖尿病漏诊相关。仍需大量本随机对照研究进一步验证。日本未破裂脑动脉瘤研究(UCAS)显示,前交通、后交通动脉瘤破裂风险增高[11]。WIEBERS等[12]对1692例患者、2686个未破裂动脉瘤的随访研究发现,无蛛网膜下腔出血病史、直径<7 mm的前循环动脉瘤无破裂,而后循环、后交通动脉瘤破裂风险达2.5%/年。而2013年日本札幌对直径<5 mm的小动脉瘤研究则发现破裂与动脉瘤部位无关[13]。本资料结果显示,动脉瘤部位为破裂的危险因素,破裂组前、后交通动脉瘤比例显著增高,而未破裂组颈内动脉瘤比例更高,这与UCAS研究结论一致。形态不规则的IAs具有低壁切应力、高振荡切变指数的血流动力学特征,因而更易发生破裂[11]。本资料同样显示不规则形态动脉瘤为破裂的危险因素。
既往研究多表明,年龄≥60岁的aSAH患者病死率显著高于中青年[14];合并高血压、糖尿病、冠心病等基础疾病的aSAH患者病死率明显升高[15]。本资料中,预后不良组和预后良好组在年龄、基础疾病方面差异无统计学意义,可能与样本量较少相关。动脉瘤Hunt-Hess分级对患者的神经系统症状、体征和意识状态等进行综合评估,分级越高,预后越差;WATANABE等[16]研究显示分级为III~V级的aSAH患者,预后良好率明显降低。本资料中,预后不良组Hunt-Hess分级IV~V级患者比例明显增高。
颅内小动脉瘤一般破裂风险较低、临床症状出现较少,然而一旦破裂导致的SAH具有较高的致死率和致残率,严重影响患者的生活质量。目前颅内小动脉瘤的主要治疗方式包括内科保守治疗、血管内介入治疗及开颅夹闭手术,后两种干预措施各有利弊。KOTOWSKI等[17]Meta分析显示,开颅夹闭动脉瘤的总体病死率为1.7%,致残率为5%,术后1年总体转归不良率为6.7%;但对动脉瘤的再生长可提供更长久的预防保护。而国际动脉瘤性蛛网膜下腔出血试验(ISAT)则发现血管内弹簧圈治疗优于开颅夹闭治疗,围术期并发症发生率更低[18];但手术受动脉瘤大小及形态的限制,同时有术后动脉瘤再生长、辐射暴露的风险。目前,对于治疗方式的选择尚无统一标准,需综合考虑患者年龄、动脉瘤部位及大小、瘤体形态等因素。
临床工作中偶然发现的无症状小直径UIAs,是否需处理预防其破裂,需全面评估患者年龄、基础疾病、动脉瘤部位及形态是否规则。而对于已发生破裂的IAs,也需全面评估动脉瘤形态、大小、部位等,以选择保守治疗、血管内介入治疗或开颅夹闭。
