核酸适配体修饰聚酰胺-胺负载5-氟尿嘧啶纳米给药体系的制备表征及体外抗肝癌作用
2022-01-04欧阳湖陈思维贺冬秀谢伟全
欧阳湖, 宁 玲, 陈思维, 贺冬秀, 王 肖, 何 健, 谢伟全
(南华大学衡阳医学院药物药理研究所,湖南省衡阳市 421001)
ConclusionsThe preparation method of ZY1-PAMAM-FUA is simple, and the ZY1-PAMAM-FUA drug delivery system has splendid stability and biocompatibility. It can effectively deliver drugs to SMCC-7721 cells to inhibit the proliferation of hepatocellular carcinoma cells.
肝细胞癌是临床上常见且病死率极高的恶性肿瘤,化疗是肝癌临床首选治疗方法,由于化疗药物组织特异性差,对正常组织产生毒副作用,限制了其临床治疗,肝癌靶向治疗越来越受到人们关注。众多研究证实,肿瘤主动靶向给药体系能将药物有效递送至病变部位,可明显增强化疗药物的选择性,增强疗效降低毒副作用[1]。适配体是能够特异性地结合细胞、蛋白质等的寡聚单链DNA或RNA[2],具有高特异性、稳定性好和易化学合成等优点,在肿瘤诊疗中显示巨大的应用潜力[3]。越来越多研究利用核酸适配体修饰聚合物、脂质体、纳米颗粒等不同类型药物载体用于靶向肝癌的药物递送[4]。聚酰胺-胺(polyamidoamine,PAMAM)具有低毒、无免疫原性等优点,其表面存在众多活性基团能被多种分子修饰而被用做药物载体[5-6]。本文以一线抗肝癌药5-氟尿嘧啶(5-fluorouracil,5-Fu)为模型药物,对其修饰转化成带羧基的FUA[7],将FUA和聚乙二醇(PEG)分别与PAMAM偶联获得PEG-PAMAM-FUA,再与适配体(ZY1)通过静电结合制备肝癌靶向ZY1-PAMAM-FUA纳米给药体系,并研究其体外抗肝癌作用。
1 材料和方法
1.1 试剂和仪器
UV-1750紫外-可见分光光度计(岛津Shimadzu公司,日本);核磁共振仪(EFT-60,美国Anasazi公司);Nano ZS90纳米粒径及Zeta电位分析仪(Malvern仪器有限公司,英国);酶标仪(Biotek仪器有限公司,美国);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司);透析袋(美国Spectra/Pro);细胞培养箱(美国Thermo公司);倒置荧光显微镜(日本Olympus公司)。5-氟尿嘧啶(美国Sigma公司);核酸适配体(上海生工生物股份有限公司);树状大分子聚酰胺-胺(5代,相对分子质量28 826,威海晨源分子新材料有限公司);1-(3-二甲氨基丙基)-3乙基碳二亚胺盐酸盐(EDC·HCl)、N-羟基琥珀酰亚胺(NHS)、三羟甲基氨基甲烷盐酸盐(Tris·HCl)(上海麦克林生化科技有限公司);肝癌细胞SMMC-7721购于中科院上海生命科学研究院;其他试剂均为分析纯。
1.2 ZY1-PAMAM-FUA纳米给药体系的制备
将420 nmol FUA与504 nmol EDC和504 nmol NHS在室温下搅拌活化后缓慢滴加至N2氛围下的PAMAM溶液中并在室温下继续反应过夜(得到PAMAM-FUA)。随后将PEG-COOH用同样方法活化后滴加至PAMAM-FUA溶液中继续反应24 h,反应结束后透析2天并冷冻干燥得到PEG-PAMAM-FUA。最后通过静电吸附作用将核酸适配体(ZY1)与PEG-PAMAM-FUA缀合,经冷冻干燥得ZY1-PAMAM-FUA纳米给药体系。
1.3 纳米给药体系化学结构表征分析
用水作为空白对照除去背景影响后,用UV-1750紫外分光光度计分别测定FUA、PEG-PAMAM-FUA、ZY1-PAMAM-FUA的紫外吸收谱图。先将KBr片置于红外光谱仪中除去KBr的背景影响。随后分别取1 mg FUA、PAMAM-FUA与199 mg KBr混合研磨压片并检测FUA、PAMAM-FUA的红外吸收谱图。
配制PAMAM-FUA与ZY1-PAMAM-FUA溶液用纳米粒度及Zeta电位分析仪检测PAMAM-FUA与ZY1-PAMAM-FUA的粒径跟Zeta电位。将FUA、PAMAM-FUA溶解于氘代二甲基亚砜中,用核磁共振氢谱仪(Varian)检测FUA、PAMAM-FUA的化学结构。
1.4 纳米给药体系载药量考察
配制0.5、1、2、5、10、15、20 mg/L FUA溶液。以水为空白参比,用紫外分光光度法检测,以光密度值(OD)对质量浓度(c)进行线性回归,求得FUA标准曲线方程。
将1 g/L PAMAM-FUA溶液与1 mol/L和5 mol/L KOH混匀后在3 000 r/min下离心12 min。取上清液稀释后于273 nm波长处测定其光密度求得上清液中FUA量(即未与PAMAM偶联的药物量),根据未与PAMAM偶联的药物量从而间接求得PAMAM-FUA体系中的载药量(n=3),载药量(%)=(纳米体系药物含量/纳米体系质量)×100%。
1.5 纳米给药体系体外释放性能考察
配制pH为7.4、6.8和5.0的Tris缓冲溶液和1 g/L ZY1-PAMAM-FUA溶液。取3 mL ZY1-PAMAM-FUA溶液装至透析袋中(截留相对分子质量为3 500),随后将透析袋转移至不同pH环境中,在37 ℃考察FUA的体外释放性能。
在0.5、1、2、4、6、8、12、24、48、72、96、120、144 h,分别取袋外释放液在273 nm处测定释放液光密度值,并根据FUA标准曲线方程计算各时间点释放液中FUA质量浓度,随后进一步计算FUA的累积释药率,累计释药率(%)=(药物实际释放质量/纳米给药体系药物总质量)×100%。
1.6 纳米给药体系稳定性考察
取适量PAMAM-FUA分别用磷酸缓冲盐溶液(PBS)、生理盐水(Saline)复溶,然后用纳米粒度及Zeta电位分析仪测定纳米给药体系在上述两种溶液中1周内粒径变化,观察纳米给药体系是否有聚集或降解,以此来考察PAMAM-FUA的稳定性。
1.7 SMMC-7721肝癌细胞对纳米给药体系摄取能力考察
将SMMC-7721、Bel-7402、L02细胞接种至6孔板中,在3孔中加入2 mL无血清培养基,另外3孔中加入2 mL含ZY1-PAMAM-FUA培养基,混匀后孵育4 h。随后先用多聚甲醛固定细胞15 min,再用4′,6-二脒基-2-苯基吲哚(DAPI)染色5 min,润洗后置于倒置荧光显微镜下观察不同细胞对ZY1-PAMAM-FUA的摄取情况。如上所述,将SMMC-7721细胞接种至6孔板中并在每孔中加入含不同比例ZY1的ZY1-PAMAM-FUA,随后用流式细胞仪检测SMMC-7721细胞对不同比例ZY1-PAMAM-FUA的摄取情况来筛选最优的ZY1投料比。
1.8 纳米给药体系生物相容性评价
将正常肝细胞L02和人脐静脉内皮细胞(HUVEC)接种到96孔板中培养24 h。配制含500、250、125、62.5、31.25 mg/L共5个质量浓度的5-Fu和ZY1-PAMAM-FUA的低血清培养基溶液加入到相应孔中继续孵育24、48 h。到达相应时间点后,加入MTT继续孵育4 h,随后用酶标仪检测每孔的OD值来评价ZY1-PAMAM-FUA的细胞相容性。
先配制2%新西兰兔血,配制同样5个质量浓度的5-Fu和ZY1-PAMAM-FUA,以纯化水作为阳性对照。将0.5 mL兔血跟0.5 mL 5-Fu或ZY1-PAMAM-FUA混合静置3 h后在3 500 r/min下离心10 min,取上清液100 μL在540 nm处检测各组上清液OD值来评价ZY1-PAMAM-FUA纳米给药体系的血液相容性,溶血率(%)=[(样品组OD-阴性对照组OD)/(阳性对照组OD-阴性对照组OD)]×100%。
1.9 纳米给药体系抗肝癌细胞增殖作用评价
将SMMC-7721细胞种入到96孔板中与不同质量浓度的5-Fu和ZY1-PAMAM-FUA共孵育24 h和48 h后检测各孔的光密度值(OD)来计算肿瘤细胞增殖情况。细胞存活率(%)=[(药物组OD-空白对照组OD)/(阴性对照组OD-空白对照组OD)]×100%。
1.10 统计学处理
2 结 果
2.1 ZY1-PAMAM-FUA纳米给药体系的化学结构表征
由图1A可见,FUA的最大吸收波长λmax=273 nm,ZY1-PAMAM-FUA纳米给药体系的λmax=276 nm较FUA有红移,这是由于FUA与PAMAM反应形成了酰胺键使得共轭效应增强从而λmax向长波长移动。由图1B可见,PEG-PAMAM-FUA在3 447/cm和1 553/cm有对应氨基上N-H的伸缩振动和弯曲振动的特征峰,在1 641/cm处有对应酰胺键上—(C=O)—伸缩振动的特征吸收峰,以及在953/cm处有对应—CF伸缩振动的特征吸收峰。由图1C和图1D对峰的归属可见,FUA、PEG均与PAMAM成功偶联,通过对峰面积进行积分计算出每个PAMAM上偶联了3个PEG链段。根据紫外光谱图、红外光谱图和核磁共振氢谱图的结果,ZY1-PAMAM-FUA纳米给药体系被成功制备。

图1 ZY1-PAMAM-FUA纳米给药体系的化学结构表征A为紫外光谱图;B为红外光谱图;C为PEG-PAMAM-FUA核磁共振氢谱图;D为FUA核磁共振氢谱图;E为PAMAM-FUA粒径分布;F为PEG-PAMAM-FUA粒径分布;G为ZY1-PAMAM-FUA粒径分布;H为ZY1-PAMAM-FUA Zeta电位图谱。
由图1E~H可见,PAMAM-FUA平均粒径为130.2 nm,PDI为0.201;PEG-PAMAM-FUA平均粒径为169.9 nm,PDI为0.259;ZY1-PAMAM-FUA平均粒径为102.3 nm,PDI为0.215,其Zeta电位为+13.9 mV。PEG-PAMAM-FUA较PAMAM-FUA的粒径增大是由于连接上PEG链段后,PEG链段在水溶液中伸展而使得纳米给药体系的粒径增大;而ZY1与PAMAM-FUA通过静电吸附原理缀合后,让纳米粒子的结构更加紧密所以纳米给药体系的粒径有减小。
2.2 纳米给药体系的载药量
由图2所示,以FUA质量浓度对光密度OD进行线性回归,得标准曲线方程为y=0.0419c+0.0031,线性回归系数R2=0.9997,表明FUA在0.5~20.0 mg/L范围内,其质量浓度与光密度之间存在良好的线性关系。基于此标准曲线,按照1.4所述的载药量测定方法得出PAMAM-FUA的载药量为8.70%±0.43%。
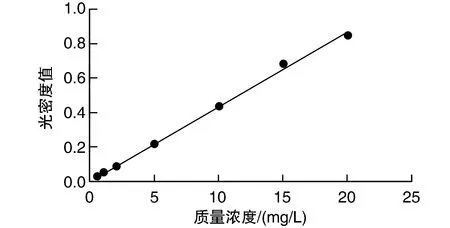
图2 FUA标准曲线
2.3 纳米给药体系的体外释放性能
由图3所示,ZY1-PAMAM-FUA纳米给药体系在不同pH介质中均具有良好的缓释性能,此外ZY1-PAMAM-FUA在上述模拟不同pH体液环境下具有一定的pH敏感性,在弱酸性的肿瘤微环境下能够更加快速地释放,以更大发挥5-Fu的抗肿瘤作用。

图3 ZY1-PAMAM-FUA纳米给药体系体外药物释放情况(n=3)
2.4 纳米给药体系的稳定性
由图4可见,PEG-PAMAM-FUA纳米粒子在PBS和Saline中的粒径一直处于164.2 nm附近,既没有聚集形成的大颗粒也无降解形成的小颗粒,结果证明PEG-PAMAM-FUA在类生理条件下能够保持稳定,也进一步说明该纳米载药体系适宜体内应用。
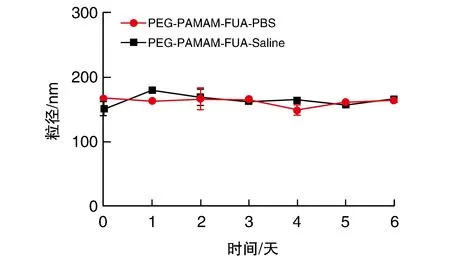
图4 纳米给药体系在不同条件下的稳定性(n=3)
2.5 SMMC-7721肝癌细胞对纳米给药体系的摄取能力
如图5所示,核酸适配体ZY1修饰的PAMAM-FUA纳米给药体系能够特异性靶向至SMMC-7721细胞,且几乎不被正常肝细胞L02摄取,该结果说明ZY1能够特异性识别靶细胞SMMC-7721,可以选择性地将化疗药物5-Fu递送至肿瘤细胞发挥抗肿瘤效果。从组合图来看,虽然仅有小部分的ZY1-PAMAM-FUA纳米给药体系已经进入到细胞内,大部分的荧光仍分布在细胞膜表面,但在这种情形下可以通过延长共孵育的时间来增加纳米给药体系被摄取至细胞内的量。

图5 荧光显微镜观察SMMC-7721肝癌细胞对ZY1-PAMAM-FUA给药体系的摄取能力(200×)
由图6可见,在加入3.75×10-2、5.00×10-2、6.25×10-2、7.50×10-2nmol/L的ZY1时,SMMC-7721细胞对ZY1-PAMAM-FUA纳米给药体系的摄取量几乎没有差异,提示ZY1投入量为3.75×10-2nmol/L时,ZY1-PAMAM-FUA纳米给药体系达到靶向SMMC-7721细胞的最优效果。

图6 流式细胞术检测SMMC-7721肝癌细胞对ZY1-PAMAM-FUA给药体系的摄取能力
2.6 纳米给药体系的生物相容性
生物相容性是纳米载药体系是否适宜体内应用的关键。溶血实验是考察纳米载药体系能否适宜体内注射给药的关键,当溶血率低于5%时认为该体系的血液相容性良好;而良好的细胞相容性,则是改善化疗药物毒副作用的重要方法。
由于PAMAM表面具有高密度的正电荷,易与带负电的细胞膜结合使得细胞膜破裂而产生毒性,所以在其表面修饰上惰性的PEG分子来改善其毒性。由图7所示,偶联PEG后能够显著降低PAMAM-FUA和5-Fu对L02和HUVEC的毒性;另外,ZY1-PAMAM-FUA的溶血率即使在高质量浓度下也低于5%。以上结果说明,ZY1-PAMAM-FUA纳米给药体系具有良好的生物相容性。
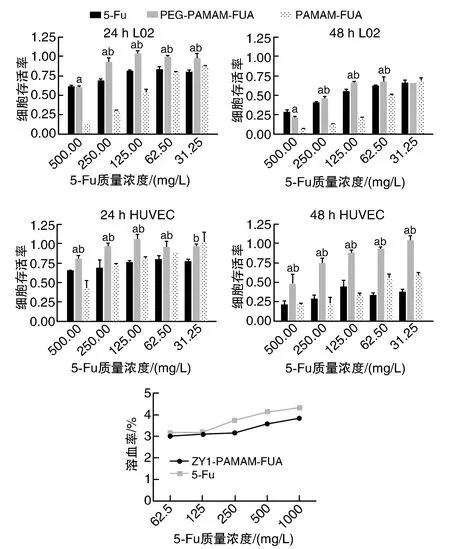
图7 ZY1-PAMAM-FUA给药体系的生物相容性(n=3)a为P<0.05,与PAMAM-FUA组比较;b为P<0.05,与5-Fu组比较。
2.7 纳米给药体系的抗肝癌细胞增殖作用
由图8所示,5-Fu和ZY1-PAMAM-FUA给药体系对SMMC-7721细胞增殖均具有明显抑制作用,呈现出时间依赖性和剂量依赖性。与游离5-Fu比较,ZY1-PAMAM-FUA在高质量浓度呈现出相当甚至更好的抑制增殖效果,这可能是因为通过ZY1的主动靶向作用纳米给药体系能更早的被细胞摄取,其次则是因为ZY1-PAMAM-FUA带有正电荷,能够与细胞膜结合,可以进一步增加纳米给药体系被摄入胞内的量。
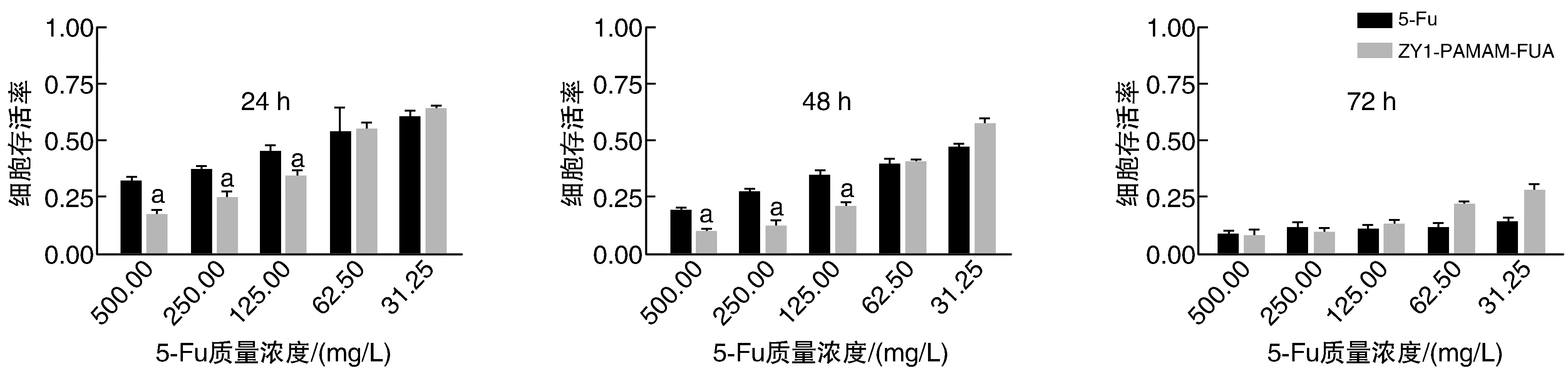
图8 ZY1-PAMAM-FUA和5-Fu对SMMC-7721细胞增殖活性的影响(n=3)a为P<0.05,与5-Fu组比较。
3 讨 论
本研究采用共价交联法和静电吸附原理制备出了粒径均匀、稳定、生物相容性好的ZY1-PAMAM-FUA纳米给药体系。该纳米给药体系具有良好的缓释性能,在酸性环境下能更快速地释放;此外通过核酸适配体(ZY1)的介导,ZY1-PAMAM-FUA能够高效地识别并将5-Fu递送至SMMC-7721细胞增强5-Fu抗肝癌效果的同时也显著降低5-Fu对正常细胞的毒副作用。
本研究中的创新主要体现在:①将5-Fu溴乙酸化制备为5-氟尿嘧啶-1-基乙酸(FUA)前药,既让带羧基的FUA能与PAMAM通过酰胺反应偶联避免物理包封5-Fu产生的泄露,也能一定程度上降低5-Fu毒副作用[7];②选定具有肝癌靶向性的核酸适配体作为配体,能提高纳米给药体系靶向性能,也能为肿瘤的靶向治疗和核酸适配体的应用提供新思路[8-9]。然而本研究使用PEG修饰PAMAM-FUA,虽一定程度上降低了PAMAM-FUA的细胞毒性但与此同时也降低了纳米给药体系的载药量,后续可以优化PEG的连接量来提高体系的载药量,还可以基于肿瘤微环境来设计pH敏感型或氧化还原敏感型的纳米载药体系来提高药物在肿瘤部位的释放率,释放速度和降低药物在正常体液环境中的泄露释放[1,9-10];此外还可以设计既具有肿瘤靶向性又具有荧光性能的核酸适配体来介导纳米给药体系,此时的纳米给药体系不仅能主动靶向递送至肿瘤部位且还具有示踪纳米载药体系体内分布的特性[2,11]。
