腹型过敏性紫癜发生消化道出血患儿HP感染及免疫反应分析
2022-01-04田文朋
张 强, 田文朋
(1.山东省立第三医院消化内科,山东省济南市250031;2.青岛市市立医院儿科,山东省青岛市266000)
过敏性紫癜(henoch-schonlein purpura,HSP)是一类儿童常见的弥漫性血管炎性变态反应性疾病,患儿的主要表现为皮肤紫癜、腹痛、关节痛和肾脏损害等[1]。随着过敏性紫癜疾病发展可造成消化道出血,且病情容易反复发作,甚至出现胃肠穿孔、坏死,导致出血性休克,给患儿及家属带来重大痛苦和负担。研究显示,幽门螺杆菌(Helicobacter pylori,HP)感染率在儿童中较高,而腹型过敏性紫癜(AHSP)所导致的肠胃损伤与幽门螺杆菌感染症状相似[2]。肠道黏膜病变使肠道内菌群生长的环境被破坏,导致菌群失调,肠道免疫发生紊乱。目前,关于AHSP的发病机制尚不明确,多数研究认为AHSP与免疫异常有关[3-4]。因此,本文对AHSP发生消化道出血患儿幽门螺杆菌感染情况及免疫功能进行研究,以期为AHSP并发消化道出血的预防、治疗和改善预后提供参考。
1 资料和方法
1.1 一般资料
选取本院2017年3月—2020年3月收治的AHSP患儿80例,按是否消化道出血分为出血组(n=33)和非出血组(n=47);出血组男18例,女15例,年龄2~14岁,平均(8.0±1.7)岁;非出血组男26例,女21例,年龄2~13岁,平均(8.1±1.5)岁;另选择同期40例健康小儿作为健康组,男22例,女18例。3组小儿性别、年龄比较差异无显著性(P>0.05),具有可比性。本研究经医学伦理委员会批准通过,患儿家属知情同意。
纳入标准:①符合AHSP的诊断标准[5];②患儿年龄2~14岁;③均为初诊病例。排除标准:①合并其他系统基础疾病;②存在AHSP肾病综合征;③近期服用抗生素、微生态制剂;④依从性差,无法配合完成研究。
1.2 HP检测及分型
所有小儿均行血清抗HP抗体检测,HP抗体分型试剂盒购自深圳伯劳特生物制品有限公司。均取10 μL血清,加入抗体室温孵育30 min,充分洗涤后加入底物静置5 min显色。抗体分型检测结果判断:HP细胞毒素CagA(116 kDa区带)、空泡毒素VacA(91 kDa与95 kDa区带)、尿素酶UreA(30 kDa区带)和尿素酶UreB(66 kDa区带),有CagA区带或VacA区带的定义为Ⅰ型,无CagA区带或VacA区带的定义为Ⅱ型,Ⅰ型、Ⅱ型符合其一即为阳性;无CagA区带、VacA区带及UreA、UreB区带的定义为阴性[6]。
1.3 肠道菌群检测
入院后留取粪便样本,用无菌棉签剥开粪便表层,避免有杂物、尿液混入,棉签挑取约1 g粪便置入无菌冻存管中-70 ℃保存待测。
取70 mg冷冻样本粪便采用QIAamp DNA Stool试剂盒(QIAGEN公司)提取样本总DNA,并行16S rDNA高通量测序,由北京安诺优达基因科技有限公司完成。检测结果以2 μL DNA中细菌量×357.14作为每克粪便样本中细菌含量[5]。
1.4 炎症细胞因子水平测定
入院后抽取3 mL空腹静脉血,3 000 r/min离心10 min分离血清。采用酶联免疫吸附法检测血清白细胞介素-6(interleukin-6,IL-6)、IL-8、IL-17、IL-23、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,试剂盒购自上海生工生物工程有限公司。
1.5 免疫功能测定
入院后抽取3 mL空腹静脉血,3 000 r/min离心10 min分离血清,采用ARRAY 360蛋白分析仪(美国贝克曼公司)及散色比浊法测定IgA、IgG、IgM水平。取小儿1 mL全血采用FCM流式细胞仪(美国贝克曼公司)测定T淋巴细胞各亚群CD3+、CD4+、CD8+、CD4+/CD8+水平。
1.6 统计学分析

2 结 果
2.1 各组HP感染情况及分型的比较
AHSP患儿HP阳性率高于健康组,出血组HP阳性率高于非出血组,且AHSP患儿Ⅰ型HP检出率高于Ⅱ型HP(P<0.05;表1)。
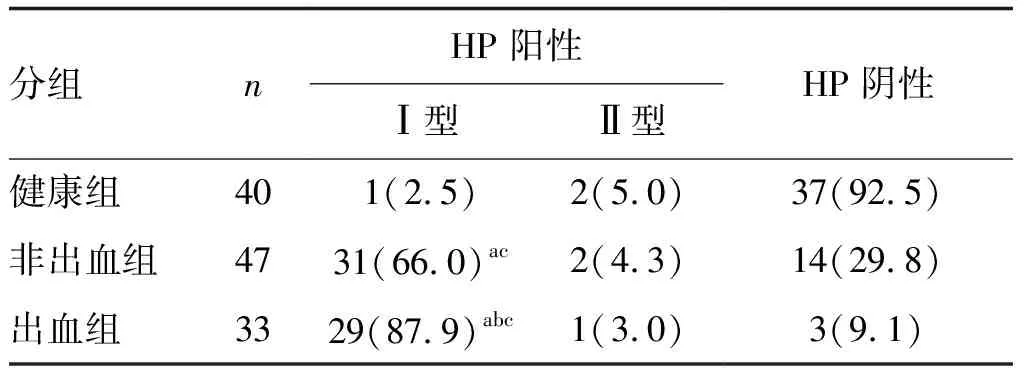
表1 各组HP感染情况及分型的比较 单位:例(%)
2.2 各组肠道菌群的比较
出血组和非出血组乳酸杆菌、双歧杆菌水平低于健康组,大肠杆菌水平高于健康组(P<0.05),出血组较非出血组更为显著(P<0.05;表2)。
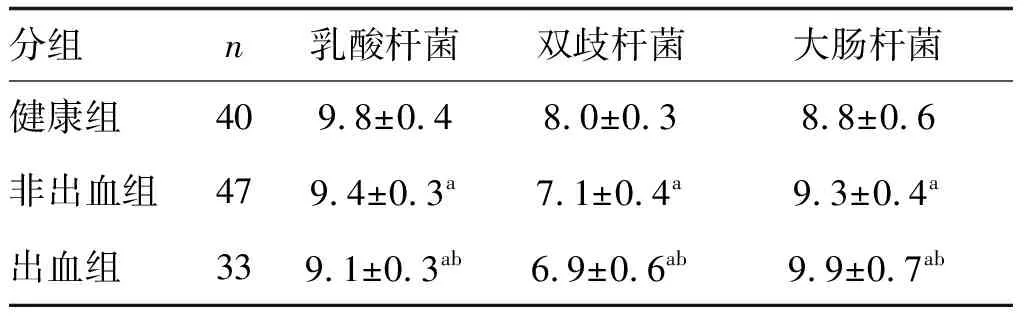
表2 各组肠道菌群定量检测结果的比较
2.3 各组血清炎症细胞因子水平的比较
出血组和非出血组血清炎症细胞因子水平均高于健康组(P<0.05),且出血组较非出血组更高(P<0.05;表3)。

表3 各组血清炎症细胞因子水平的比较 单位:ng/L
2.4 各组免疫功能的比较
出血组IgA、IgG、IgM水平低于非出血组和健康组(P<0.05),非出血组IgA水平低于健康组(P<0.05),而IgG和IgM与健康组比较差异无显著性(P>0.05)。出血组和非出血组T淋巴细胞亚群CD3+、CD4+、CD4+/CD8+低于健康组,而CD8+高于健康组(P<0.05);出血组较非出血组更为显著(P<0.05;表4)。
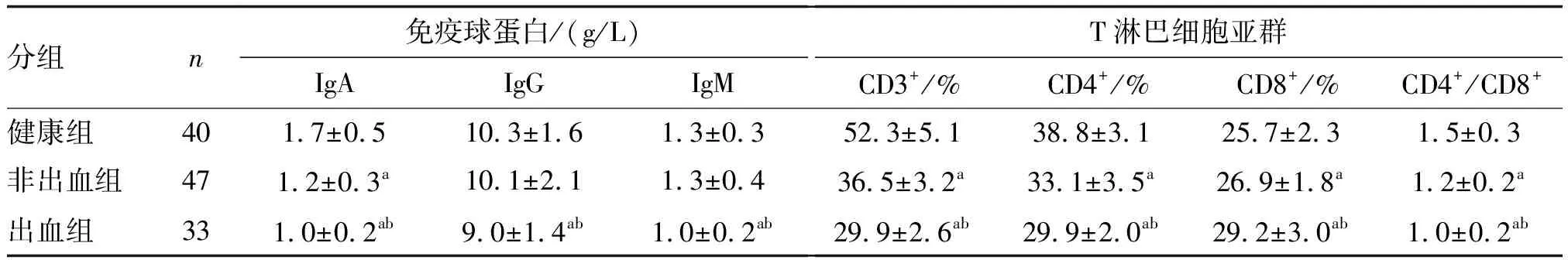
表4 各组免疫功能的比较
3 讨 论
过敏性紫癜是一种多系统参与的血管炎性疾病,对于皮肤、肾脏、关节和胃肠道都有影响,但具有一定的自限性。研究显示,HSP在3~10岁儿童中最为常见,以AHSP为主,主要表现为臀部区域和下肢皮疹[7]。AHSP胃肠道反应主要表现为腹痛和消化道出血,若腹痛出现在皮肤紫癜之后容易诊断,但反之容易发生误诊。病理学研究显示,AHSP主要为全身性小血管急性炎症反应,可累及微小动脉和静脉,导致炎症出血或渗出,从而导致胃肠道黏膜溃疡出血的发生[8]。AHSP的发病影响因素众多,如药物、感染、恶性肿瘤等均与HSP发生发展有关[9]。
研究表明,感染是AHSP发病的主要诱因[10]。另有多项研究证实,HP感染可以引发消化道黏膜损伤及变态反应[11-12]。本研究结果显示,AHSP消化道出血患儿HP阳性率高于AHSP未发生消化道出血患儿及正常儿童,且Ⅰ型HP检出率高于Ⅱ型HP,提示AHSP消化道出血可能与Ⅰ型HP感染存在密切关系。HP感染导致AHSP的发生可能与HP引发的炎症和免疫反应有关。HP感染导致血液自由基水平升高,加重血管内皮损伤,导致血管内皮持续性炎症经久不愈、反复发作。儿童体质较弱,免疫力较低,肠道微生态平衡容易遭到破坏而出现严重的肠道微生态紊乱。本研究中,AHSP消化道出血患儿乳酸杆菌、双歧杆菌数量明显降低,大肠杆菌数量明显升高,提示AHSP消化道出血患儿存在肠道菌群生态紊乱,这可能与HP感染及AHSP消化道出血导致的肠胃黏膜屏障损伤有关。本研究中,AHSP患儿血清IL-6、IL-8、IL-17、IL-23、TNF-α比健康组明显升高。HP感染会增加毒素因子分泌,促使炎症介质不断释放,加重损伤胃肠黏膜屏障,导致持续性炎症反应。
AHSP感染多发生于病毒细菌感染后,其本质为一种免疫性疾病,体液免疫和细胞免疫在机体免疫中发挥重要调节作用。研究显示,AHSP为IgA抗体所介导,表现为IgA水平增高[13],本研究结果与之相似。本研究中,IgG、IgM水平在AHSP无消化道出血患儿和健康儿童中无明显差异,但在AHSP消化道出血患儿中明显升高。本研究出血组和非出血组T淋巴细胞亚群CD3+、CD4+、CD4+/CD8+低于健康组,CD8+高于健康组,出血组较非出血组更为显著。T细胞在B细胞生长、分化和分泌免疫球蛋白过程中具有重要作用,活化的CD4细胞过度表达CD40L可与B细胞、内皮细胞上的CD40结合,刺激B细胞活化增殖和抗体形成,参与体液免疫过程[14]。研究认为,HSP患儿T淋巴细胞,CD3+、CD4+、CD4+/CD8+降低与自身淋巴细胞反应有关[15],但其具体机制尚未明了。因此,AHSP患儿监测免疫功能变化有助于病情的判断和治疗。
综上所述,AHSP消化道出血的发病与HP感染、免疫功能紊乱促使肠道菌群失调、炎症发展有关,进行HP及免疫指标检测有助于AHSP伴消化道出血的预防和治疗。
