APETx2及粪菌移植对母婴分离诱导肠易激综合征大鼠内脏敏感性的影响及机制
2022-01-04李欢闫波王金坤袁丽萍
李欢,闫波,王金坤,袁丽萍,3△
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性胃肠道疾病,主要表现为持续性或阵发性腹痛、腹胀,以及排便习惯和(或)大便性状改变。研究发现,IBS可能与脑-肠轴、黏膜屏障、精神心理因素、遗传因素、肠道微生物改变、饮食、感染等有关[1]。越来越多的研究证实肠道微生物改变在IBS的发生和发展中起着重要作用。IBS肠道微生物改变可引起炎症和疼痛,进一步导致内脏高敏感性和肠道动力异常[2-3],但肠道微生物改变参与IBS发生的机制至今尚未完全明确。
酸敏感离子通道(acid sensing ion channels,ASICs)是一类广泛存在于细胞膜上,由细胞外酸化激活的阳离子通道。ASICs在椎间盘退行性疾病、类风湿关节炎中的作用已被广泛研究。在椎间盘退变中,ASICs通过乳酸介导核苷酸结合寡聚化结构域样受体3(NLRP3)炎性小体调节髓核细胞炎症和细胞焦亡[4]。在类风湿关节炎中,ASIC3感应细胞外pH值变化调节关节炎症反应和痛觉敏感性[5]。另有研究发现ASICs在胃肠道内广泛存在,并作为酸感受器对胃肠道酸性环境的改变作出反应,对维持胃肠道内环境稳定起着重要作用[6]。在炎性肠病、胃排空障碍等胃肠道疾病中,肠道ASIC3表达增加,参与胃肠道慢性炎症和胃肠道动力功能紊乱[7]。本研究旨在探讨母婴分离诱导的IBS模型鼠肠道微生物对肠道ASIC3表达的影响,观察给予ASIC3阻断剂APETx2后内脏敏感性的变化并分析其可能机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级健康SD孕鼠10只,孕龄16~18 d,SPF级健康雄性SD大鼠36只,平均体质量(220±10)g,购自安徽医科大学实验动物中心。
1.1.2试剂 ASIC3抑制剂APETx2(上海信裕生物科技有限公司),以生理盐水溶解至所需浓度;ASIC3、c-kit一抗(Affinity);兔二抗、DAB(Dako Denmark);戊巴比妥钠、EDTA抗原修复液(福州迈新);含抗生素的鸡尾酒(氨苄西林、新霉素、甲硝唑)、无水乙醇、二甲苯、中性树胶(国药集团化学试剂有限公司);DMEM/F12培养基、M199培养基(Hyclone);Ⅱ型胶原酶(南京生兴)。
1.2研究方法
1.2.1母婴分离模型的制备 每只孕鼠约产下11只新生仔鼠,所有新生仔鼠在标准实验室条件下饲养,进行12 h的明/暗循环,室温为(23±1)℃,按照随机数字表法分为母婴分离组和未分离组。母婴分离组仔鼠在出生后2~22 d,每天从母鼠笼中取出3 h,分离期结束后,仔鼠被放回各自的母鼠笼。未分离组仔鼠不进行干预。仔鼠第22天时断奶,单独饲养。当仔鼠8周龄时,在20、40、60、80 mmHg(1 mmHg=0.133 kPa)压力下行结直肠扩张(colorectal balloon distention,CRD)刺激,引起大鼠的疼痛,表现为不同程度内脏痛引起的行为学反应,称为腹部回撤反射(abdominal withdrawal reflex,AWR)。根据AWR评分结果评估内脏敏感性,判断造模是否成功。AWR评分标准:0分,无行为学反应;1分,大鼠有动作停顿后出现短暂的头部运动行为;2分,可见腹部肌肉收缩;3分,有腹部抬起行为;4分,身体拱起,并抬起盆腔和阴囊。在充气压力为60 mmHg和80 mmHg时,与未分离组相比,母婴分离鼠腹部回撤反射评分明显升高,即为造模成功[8]。收集造模成功鼠的粪便,制备成粪菌液。
1.2.2粪菌液的制备 母婴分离鼠粪便混合,置于无菌搅拌器内,加入PBS(粪便与PBS质量比为1∶10)搅拌,依次通过孔径为2.0、1.0、0.5和0.25 mm的滤网过滤,匀浆并3 500 r/min离心20 min后分离纯化得到粪菌液沉淀,-80℃保存备用。
1.2.3无菌鼠模型制备及粪菌移植 18只健康雄性SD大鼠按照随机数字表法分为正常对照(Con)组、母婴分离(NMS)组、NMS+APETx2组,每组6只。NMS组、NMS+APETx2组均予以含有抗生素的鸡尾酒(ABX-water)连续灌胃5 d,构建伪无菌鼠模型[9],之后给予NMS大鼠粪菌液(1.6 mL/kg)灌胃;Con组给予等体积生理盐水灌胃,每天1次,连续灌胃5 d。灌胃结束后,NMS+APETx2组给予100µg/kg APETx2连续腹腔注射7 d,每天1次。Con组和NMS组则给予等体积生理盐水连续腹腔注射7 d,每天1次。实验结束后分别进行内脏敏感性和肠道动力评估,取结肠组织行免疫组化检测。
1.2.4内脏敏感性检测 大鼠放于特定的透明固定器,使之能自由活动,但不能转身、掉头,以便于观察。参照1.2.1进行CRD刺激,观察并记录AWR评分。
1.2.5肠道传输速率测定 大鼠禁食24 h,禁水12 h,经口灌入印度墨汁0.5 mL。30 min后处死,剖腹,取出贲门至回肠末段的小肠,快速测量墨汁在肠道的推进距离及小肠全长,计算肠道推进率。肠道推进率=墨汁推进长度(cm)/小肠全长(cm)×100%。
1.2.6免疫组化染色检测结肠中ASIC3和c-kit蛋白的表达 每组6只大鼠取结肠组织,PBS冲洗,4%多聚甲醛固定,常规包埋、切片、脱蜡、水化、抗原修复,滴加相应一抗,37℃过夜。滴加相应种属二抗后,二氨基联苯胺(DAB)显色,脱水封片,显微镜下观察。每张切片随机读取400倍视野进行拍照。拍照时尽量使组织布满整个视野,保证每张照片背景光一致。应用Image Pro Plus软件选取相同的棕黄色作为判断所有照片阳性的统一标准,分析得出每张照片阳性的累积光密度值(integrated optical density,IOD),IOD值越大表明阳性表达水平越高。
1.2.7结肠cajal间质细胞(ICC)的分离 另取SPF级18只健康雄性SD大鼠,分组及处理方法同1.2.3。实验结束后,大鼠禁食8 h,固定在操作台上颈椎脱臼处死。在无菌条件下,取大鼠结肠组织,放入预先装有D-Hank's液的培养皿中浸泡30 min,仔细剥去系膜和血管。参照文献[10]分离细胞,用含有Ⅱ型胶原酶(1.3 g/L)的消化液处理组织块。离心、用DMEM培养基重悬细胞后,200目筛网去除大块组织,将细胞加入等体积的密度梯度分离液,离心获得细胞悬液。细胞计数后,用M199培养基将细胞密度调整至1×105/mL,接种至6孔培养板。在37℃,5%CO2条件下培养,观察ICC形态并计数。
1.3统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠粪菌移植及药物干预后肠道动力变化 与Con组相比,NMS组大鼠小肠肠道推进率明显减慢(P<0.05);与NMS组大鼠相比,NMS+APETx2组大鼠小肠肠道推进率明显增加(P<0.05),见图1、2。

Fig.1 Ink movement state of small intestine in the three groups of rats图1 3组大鼠小肠墨汁推进状态

Fig.2 Comparison of intestinal transit rate between the three groups of rats图2 3组大鼠小肠肠道推进率比较
2.2 各组大鼠粪菌移植及药物干预后内脏敏感性的变化 当充气压力为20 mmHg时,3组大鼠AWR评分均为0。当充气压力为40、60和80 mmHg时,与Con组相比,NMS组腹部疼痛加重,AWR评分显著升高,差异有统计学意义(P<0.05);与NMS组相比,NMS+APETx2组腹部疼痛减轻,AWR评分下降(P<0.05),见表1。
Tab.1 Comparison of the AWR scores of the three groups of rats under different pressures表1 3组大鼠在不同压力下的AWR评分比较(n=6,分,±s)

Tab.1 Comparison of the AWR scores of the three groups of rats under different pressures表1 3组大鼠在不同压力下的AWR评分比较(n=6,分,±s)
*P<0.05,**P<0.01;a与Con组比较,b与NMS组比较,P<0.05
组别Con组NMS组NMS+APETx2组F 40 mmHg 0.00±0.00 0.67±0.18a 0.00±0.00b 10.000**60 mmHg 0.33±0.18 1.33±0.18a 0.67±0.18b 5.833*80 mmHg 1.00±0.22 2.00±0.22a 1.33±0.18b 4.375*
2.3 各组大鼠粪菌移植及药物干预后其结肠中ASIC3、c-kit蛋白表达水平变化 ASIC3主要表达于结肠黏膜层和黏膜下层的细胞胞浆中,呈暗黄色。c-kit主要表达于纵行肌和环形肌之间细胞的胞浆中,呈黄褐色,见图3。与Con组相比,NMS组结肠组织中ASIC3、c-kit蛋白表达水平均上调(P<0.05);与NMS组相比,NMS+APETx2组ASIC3、c-kit蛋白表达水平下调(P<0.05),见表2。
2.4 各组大鼠粪菌移植及药物干预后结肠中ICC形态和数量变化 光镜下Con组ICC胞体呈菱形或三角形,细胞核大,核周胞质较少,细胞胞体多见长突起;NMS组ICC胞体变大呈椭圆形,细胞胞体突起变短减少;NMS+APETx2组ICC胞体逐渐恢复呈菱形或三角形,细胞胞体的突起和邻近细胞间的联系增加,形态趋于正常,见图4。Con组、NMS组、NMS+APETx2组ICC数量(个/视野)分别为45.00±11.45、73.50±14.04、52.67±11.66,NMS组较Con组明显增多,NMS+APETx2组较NMS组明显减少(F=8.435,P<0.05)。
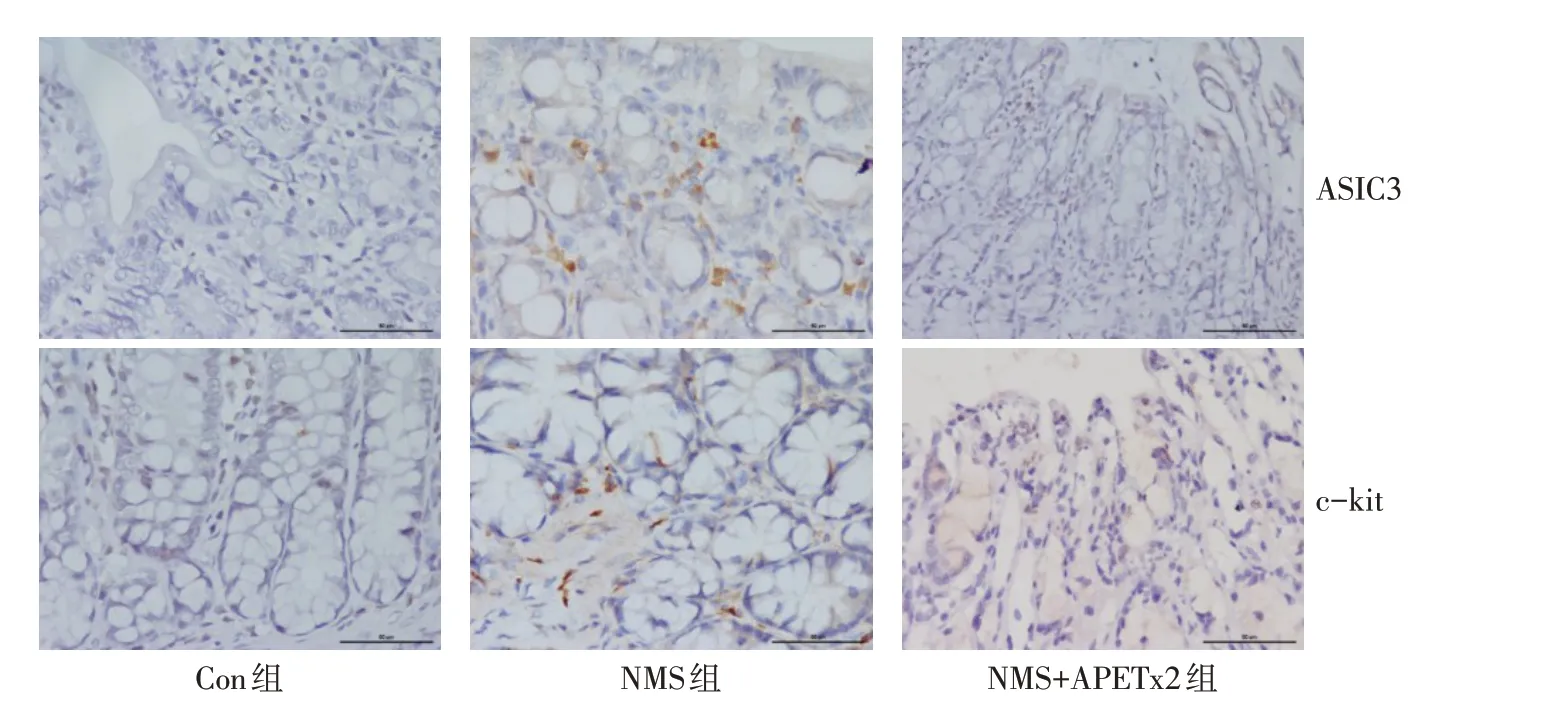
Fig.3 Immunohistochemical observation of ASIC3 and c-kit expression in rat colon tissue(×400)图3 免疫组化观察大鼠结肠中ASIC3、c-kit蛋白表达(×400)
Tab.2 Comparison of the expression levels of ASIC3 and c-kit protein in colon between the three groups of rats表2 3组大鼠结肠ASIC3、c-kit蛋白的表达水平比较(n=6,IOD值,±s)
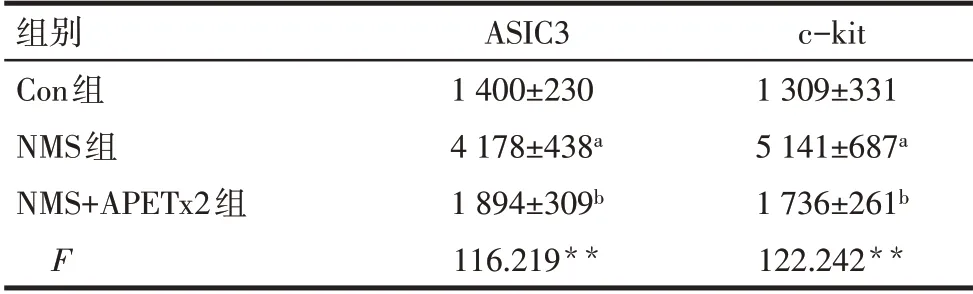
Tab.2 Comparison of the expression levels of ASIC3 and c-kit protein in colon between the three groups of rats表2 3组大鼠结肠ASIC3、c-kit蛋白的表达水平比较(n=6,IOD值,±s)
**P<0.01;a与Con组比较,b与NMS组比较,P<0.05
组别Con组NMS组NMS+APETx2组F ASIC3 1 400±230 4 178±438a 1 894±309b 116.219**c-kit 1 309±331 5 141±687a 1 736±261b 122.242**
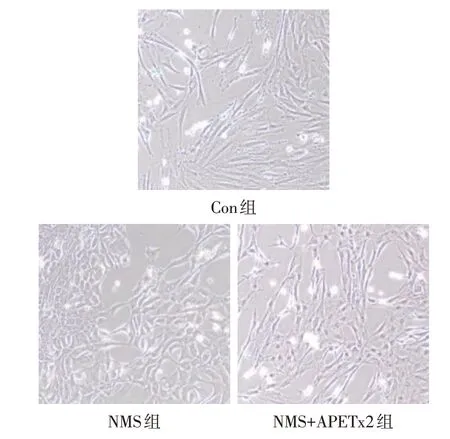
Fig.4 The morphology of interstitial cells of Cajal in rat colon tissue(×100)图4 大鼠结肠Cajal间质细胞形态(×100)
3 讨论
肠道微生物在维持肠道内环境、肠道疾病的发生和自身稳态过程中起关键作用。研究发现,将IBS大鼠粪菌移植到无菌鼠后,粪便内的代谢物与内脏高敏感性的发生密切相关[11]。IBS患者短链脂肪酸、硫化氢(H2S)较健康者明显增多,且短链脂肪酸浓度越高,腹痛越严重[12]。另外,肠道微生物可能调节宿主免疫应答,进一步影响IBS。IBS患者肥大细胞、T细胞等免疫细胞数量增多,其产生的活性物质可激活肠道的痛觉通路或增加肠道通透性[13]。本研究发现,IBS肠道微生物可以诱导NMS大鼠内脏敏感性增高及肠道动力改变,且既往研究已证实IBS粪菌移植引起无菌鼠肠道动力明显异常[14],但肠道微生物改变对肠道动力作用的机制未明确。
ASICs是一类由细胞外酸化直接激活的阳离子通道,ASICs在胃肠道分布广泛,参与胃肠道炎性痛觉反应和机械传导,对于维持胃肠道功能稳态起着特殊作用[6]。IBS和功能性便秘患儿粪菌移植大鼠肠道中ASIC3蛋白表达与健康儿童存在差异[15-16]。研究发现,一定的酸性环境可激活ASICs,提示其可介导炎症或损伤后组织酸中毒引起的疼痛,ASIC3的高表达加剧了慢性炎症性疼痛下的内脏超敏反应[7]。肠道菌群失调的代谢产物胆汁酸、乳酸、H2S以及大量的短链脂肪酸可降低细胞外pH[17]。另外,肠道菌群失调通过破坏黏膜屏障和改变肠道通透性,产生大量促炎因子,从而导致慢性低级别炎症,进一步降低肠道的pH值[18-19]。本研究发现,IBS大鼠肠道微生物可以激活肠道ASIC3表达,这可能与肠道微生物介导的肠道pH值降低有关。进一步研究发现,ASIC3阻断剂APETx2不仅能够恢复IBS大鼠粪菌移植无菌鼠的肠道传输功能,且能降低内脏敏感性。此外,与NMS组相比,NMS+APETx2组ASIC3蛋白的表达水平下调,表明肠道微生物参与了IBS的产生,而ASIC3在其中发挥一定的作用,阻断ASIC3对IBS有保护作用。
ICC是胃肠道起搏细胞,产生、传播慢波调节肠道蠕动,并能传导肠神经系统信号至平滑肌细胞,在肠道运动中起基础作用。ICC数量和形态学改变与胃肠动力功能异常有密切关系,可诱发胃轻瘫、慢性传输型功能性便秘、溃疡性结肠炎[20-22]。SCF/c-kit系统是一个配体/受体酪氨酸激酶信号系统,介导平滑肌收缩和炎症反应。SCF/c-kit系统刺激5-羟色胺、神经肽Y、降钙素基因相关肽和组胺等相关介质释放,参与神经内分泌-免疫调节,引起IBS的内脏高敏感性和胃肠动力紊乱;另外,SCF/c-kit与ICC相互依赖,两者共同调控ICC细胞生长发育,而ICC反之可上调神经递质控制其信号[23]。有文献报道,阻断SCF/c-kit信号明显抑制IBS大鼠内脏超敏反应,ICC的活化程度也明显降低[24]。本实验中,APETx2能下调IBS大鼠粪菌移植无菌鼠结肠c-kit蛋白表达水平,使ICC胞体逐渐恢复呈菱形或三角形,增加细胞胞体的突起和邻近细胞间的联系,改善ICC形态和数量,提示ASIC3阻断剂对IBS的保护作用可能与ICC相关的c-kit信号有关。
综上所述,ASIC3在肠道微生物参与的IBS的发生中可能起着一定作用。阻断体内ASIC3激活可以改善IBS内脏敏感性和肠道传输功能,其机制可能与ICC相关的c-kit信号有关。ASICs有可能成为IBS的潜在治疗靶点。
