低氧对HTR-8/SVneo细胞增殖及HIF-1α、VEGF、MMP-9、TIMP-1表达的影响
2022-01-04袁烁刘湘云张家旗邓高丕
袁烁,刘湘云,张家旗,邓高丕△
氧浓度的改变是妊娠滋养细胞增殖与侵袭的重要条件。在妊娠早期,低氧状态介导的滋养层分化与生物学效应对维系妊娠至关重要[1]。低氧状态会刺激滋养细胞入侵母体子宫内膜,并影响子宫壁动脉血管的重塑[2]。若妊娠早期滋养细胞因活性氧生成与抗氧化防御系统之间的不平衡导致氧化应激,造成滋养细胞入侵不足,可能会导致各种妊娠相关疾病,如子痫前期、宫内生长受限或流产等的发生[3-5]。有研究报道,物理低氧条件(8%O2)可诱导缺氧诱导因子(HIF)-1α上调,促进绒毛外滋养细胞分化与侵袭、迁移能力增强[6];化学低氧条件[250µmol/L二氯化钴(CoCl2)]可激活滋养细胞自噬途径并介导基质金属蛋白酶(MMP)-9上调和细胞内腺苷三磷酸(ATP)增多[7]。目前,有关不同浓度CoCl2对滋养细胞增殖的干预效应,以及CoCl2的浓度梯度对滋养细胞中HIF-1α、血管内皮生长因子(VEGF)、MMP-9、基质金属蛋白酶组织抑制因子1(TIMP-1)蛋白表达的影响鲜有报道。本研究旨在探讨CoCl2的浓度变化对滋养细胞系HTR-8/SVneo细胞增殖及蛋白表达的影响,为妊娠相关疾病的研究提供依据。
1 材料与方法
1.1材料 滋养细胞株HTR-8/SVneo细胞购自美国ATCC细胞库(批号:CRL-3271);南美胎牛血清购自武汉普诺赛(Procell)生命科技有限公司(批号:201909);胰酶(批号:25200072)、DMEM/F12培养基(批号:C11995500BT)购自美国Gibco公司;CCK8试剂盒购自日本同仁公司(批号:CK04);兔源HIF-1α一抗购自英国Abcam公司(批号:ab51608);GAPDH抗体(批号:5174s)、兔源VEGF一抗(批号:3408s)、兔源MMP-9一抗(批号:13667s)购自美国CST公司;鼠源TIMP-1一抗购自美国R&D公司(批号:MAB970)。山羊抗鼠IgG(H+L)、山羊抗兔IgG(H+L)二抗均购自英国Jackson Immuno Research公司(批号分别为113035003、111035003)。CoCl2购自美国Sigma公司(批号:232696)。CO2培养箱(NBS公司);超净工作台(东莞美维净化设备有限公司);细胞计数仪(美国Nexcelom公司);常温离心机、高速冷冻离心机(科大创新股份有限公司中佳分公司);荧光倒置显微镜(日本Nikon公司);凝胶成像系统、电泳仪、转膜仪(美国Bio-Rad公司)。
1.2细胞培养 选取生长状态良好的HTR8/SVneo细胞,加入含EDTA的0.25%胰酶消化,1~2 min后加入DMEM/F12培养基终止消化,收集细胞悬液离心,离心机转速为900 r/min,时间为5 min,离心后弃上清液,加入含10%胎牛血清的DMEM/F12培养基重悬为约1×106个/mL的细胞悬液继续培养,每隔24~48 h换液。
1.3化学低氧状态的药物制备 参考相关文献[8-9],拟定适宜诱导低氧环境的CoCl2培养基母液的浓度梯度。将化学缺氧剂CoCl2加入胎牛血清中稀释,配置成终浓度为50、100、200、400、800、1 000和1 200µmol/L的母液,用于模拟细胞低氧微环境。
1.4CCK8法检测不同时间点细胞增殖情况 按1.3的浓度配置分组,另设立空白组,共8组,以1×104个/孔的细胞接种于96孔板,加入不同浓度梯度的CoCl2培养基母液,每组设3个复孔,培养24 h和48 h。每孔加入10µL CCK8,继续于培养箱中继续培养4 h后取出,用FC型酶标仪于450 nm波长处检测光密度(OD)值。实验重复3次。根据实验结果,结合显微镜下细胞形态改变,以细胞增殖程度适中作为原则,选择最合适的时间点与梯度最适中的3个浓度作为CoCl2低、中、高浓度组,进行后续实验。
1.5Western blot法检测CoCl2低、中、高浓度组HIF-1α、VEGF、MMP-9、TIMP-1的蛋白表达量 HTR-8/SVneo细胞与相应浓度的CoCl2培养基共培养48 h后,PBS洗涤,细胞裂解液、超声破碎仪处理,取上清液,检测细胞表达的蛋白浓度,电泳并转膜,PBS清洗PVDF膜10 min,加入5%脱脂牛奶,置于室温中封闭1 h后,加入HIF-1α、VEGF、MMP-9、TIMP-1一抗,稀释比例为均1∶1 000,4℃孵育过夜,洗膜后添加二抗IgG(1∶5 000),37℃孵育1 h,洗膜,显色,曝片,Quantity One图像分析软件计算各蛋白与内参GAPDH灰度值的比值。
1.6统计学方法 采用SPSS 26.0对数据进行统计分析。计量资料用±s表示,多组间比较采用单因素方差分析,组间多重比较采用Bonferroni校正t检验。P<0.05为差异有统计学意义。
2 结果
2.1 低氧状态下不同时间点HTR-8/SVneo细胞增殖情况与形态变化 与空白组相比,CoCl2作用于HTR-8/SVneo细胞24 h后,浓度达200µmol/L时较100µmol/L时OD值略下降;达400µmol/L后随浓度增加,OD值上升。CoCl2作用于HTR-8/SVneo细胞48 h后,OD值随浓度增加而上升;同一CoCl2浓度作用下,作用48 h较作用24 h的OD值均上升,见图1。CoCl2各浓度组作用24 h及48 h后,HTR-8/SVneo细胞形态的改变随浓度变化显现出差异,但不同作用时间下同一浓度,细胞形态差异不明显。0µmol/L CoCl2组细胞形态以多边形、梭形为主,伸展良好,呈上皮样细胞表现;随着CoCl2浓度的增加,细胞密度均逐渐增加;400µmol/LCoCl2组细胞呈梭形、类圆形,细胞饱满,胞浆丰富,部分联合成片;800、1 000、1 200µmol/LCoCl2组细胞逐渐密集,同时见核固缩及缩小的死亡细胞。镜下细胞形态变化见图2、3。选择作用时间为48 h,拟定CoCl2100µmol/L为CoCl2低浓度组,200µmol/L为CoCl2中浓度组,400µmol/L为CoCl2高浓度组,进行后续实验。
2.2 CoCl2低、中、高浓度组细胞HIF-1α、VEGF、MMP-9、TIMP-1蛋白表达情况 与空白组相比,CoCl2低、中、高浓度组的HIF-1α、MMP-9的蛋白表达水平和MMP-9/TIMP-1比值逐步上调(P<0.05);与空白组相比,CoCl2低、中、高浓度组的TIMP-1蛋白表达水平下降(P<0.05),但随着CoCl2浓度增加而呈上升趋势;与空白组相比,CoCl2低浓度组的VEGF的蛋白表达水平下调,CoCl2中、高浓度组的VEGF的蛋白表达水平上调(P<0.05),见表1、图4。
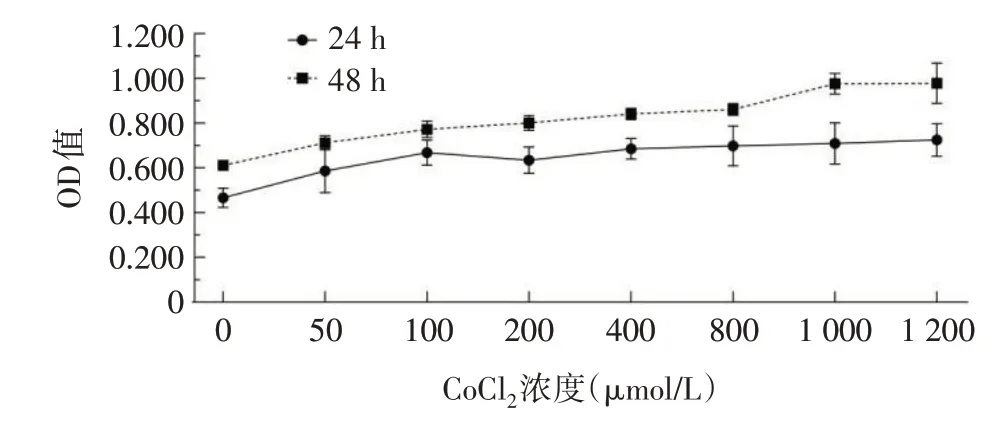
Fig.1 The proliferation of HTR-8/SVneo cells after treatment with different concentrations of CoCl2 for 24 h and 48 h图1 CoCl2各浓度组作用24 h和48 h后HTR-8/SVneo的细胞增殖情况

Fig.2 Proliferation of HTR-8/SVneo cells after treatment with different concentrations of CoCl2 for 24 h(×200)图2 CoCl2各浓度组作用24 h后HTR-8/SVneo细胞增殖情况(×200)
Fig.3 Proliferation of HTR-8/SVneo cells after treatment with different concentrations of CoCl2 for 48 h(×200)图3 CoCl2各浓度组作用48 h后HTR-8/SVneo细胞增殖情况(×200)
Tab.1 The effects of different concentrations of CoCl2 on expression levels of HIF-1α,VEGF,MMP-9,TIMP-1 and MMP-9/TIMP-1表1 CoCl2各浓度组对HIF-1α、VEGF、MMP-9、TIMP-1、MMP-9/TIMP-1表达的影响 (n=3,±s)

Tab.1 The effects of different concentrations of CoCl2 on expression levels of HIF-1α,VEGF,MMP-9,TIMP-1 and MMP-9/TIMP-1表1 CoCl2各浓度组对HIF-1α、VEGF、MMP-9、TIMP-1、MMP-9/TIMP-1表达的影响 (n=3,±s)
*P<0.05;a与空白组比较,b与CoCl2低浓度组比较,c与CoCl2中浓度组比较,P<0.05
组别空白组CoCl2低浓度组CoCl2中浓度组CoCl2高浓度组F HIF-1α 0.378±0.003 0.402±0.007a 0.486±0.002ab 0.570±0.006abc 920.214*VEGF 0.509±0.001 0.463±0.004a 0.618±0.004ab 0.620±0.005ab 1 312.614*MMP-9 0.344±0.002 0.387±0.001a 0.626±0.003ab 0.690±0.007abc 5 355.389*TIMP-1 0.886±0.003 0.737±0.003a 0.801±0.003ab 0.835±0.003abc 1 401.658*MMP-9/TIMP-1 0.388±0.002 0.525±0.002a 0.782±0.003ab 0.827±0.009abc 5 471.943*

Fig.4 The expression levels of HIF-1α,VEGF,MMP-9 and TIMP-1 protein detected by Western blot assay in different concentration of CoCl2 groups图4 Western blot检测CoCl2各浓度组HIF-1α、VEGF、MMP-9、TIMP-1蛋白表达水平
3 讨论
在一个完整孕期中,滋养细胞的局部氧环境一直处于动态变化过程。在妊娠早期,局部的生理性低氧环境刺激滋养细胞,使其侵袭能力明显增强[10]。当绒毛外滋养细胞通过侵袭效应在子宫内膜迁移,侵入子宫蜕膜,浸润到子宫约1/3的肌层与血管后,螺旋动脉重塑,逐渐获得血液供应,为胚胎建立适当的营养和氧气供应,滋养细胞局部氧浓度才随之逐渐上升[11]。可见,胚胎着床与发育早期是在相对缺氧的环境下进行的。本研究以CoCl2作为化学缺氧诱导剂模拟体外低氧环境以研究滋养细胞的行为,从CoCl2浓度为0、50、100、200、400、800、1 000、1 200µmol/L的细胞增殖实验中发现,作用时间为48 h,HTR-8/SVneo的细胞增殖随浓度增加呈上升趋势。在CoCl2浓度为100~400µmol/L时,显微镜下观察细胞形态,细胞的增殖程度适中。
HIF-1α作为低氧状态下的一种活性转录因子,参与机体对低氧环境和低氧反应的调节,影响滋养细胞在不同氧浓度状态下的细胞活动[12]。低氧促进滋养层细胞的侵袭和血管生成,上调HIF-1α的表达,HIF-1α抑制剂抑制了滋养层细胞的侵袭和血管生成[2]。VEGF是HIF-1的靶标之一,以低氧环境为介质,刺激血管内皮细胞增生,促进新生血管形成,故而在受精卵着床、胎盘血管形成、胎儿的生长发育等妊娠过程的多个阶段有重要作用。有研究报道,低氧状态下(300µmol/L CoCl2),HTR-8/SVneo细胞中VEGF和MMP-9的mRNA和蛋白表达水平同向上调,影响HTR-8/SVneo细胞的迁移、侵袭和血管生成能力[13]。本研究结果表明,HIF-1α蛋白表达随低氧浓度增加呈上升趋势,表明本研究在HTR8/SVneo细胞中诱导了低氧反应,而VEGF在CoCl2中、高浓度组较空白组表达上调,与研究报道的低氧提高滋养细胞的VEGF表达水平结果一致[14]。新生血管形成和血管通透性增加是细胞对低氧状态的一种代偿性反应。CoCl2低浓度组VEGF不升反降,推测可能100µmol/L的CoCl2浓度尚未到达刺激滋养细胞中VEGF升高的阈值,而200µmol/L的CoCl2浓度达到了启动VEGF对低氧应答调控的阈值。
MMPs是一个锌依赖家族,通过参与降解细胞外基质而影响细胞侵袭能力,其表现出的蛋白水解活性与滋养细胞侵入子宫有关,MMP-9的减少是干扰妊娠早期螺旋动脉正常重构的原因之一[15]。有研究发现,HTR-8/SVneo细胞暴露于低氧(2%O2)条件下的迁移和侵袭性较常氧(20%O2)条件下增加,MMP-1、MMP-9表达显著增加[16]。TIMPs是一组小分泌糖蛋白,以1∶1的比例抑制MMPs的激活。TIMP-1作为MMP-9的特异性抑制剂,可降低滋养细胞中MMP-9的表达水平[17]。对感染人巨细胞病毒的早孕绒毛细胞的研究发现,病毒可降低原代早孕滋养细胞MMP-9的表达,上调TIMP-1的表达,使MMP-9/TIMP-1比值下降,继而削弱滋养细胞侵袭能力[18]。与妊娠相关的滋养细胞侵入属于生理性的精准调控,故MMP-9表达增强时,TIMP-1亦会受到调节适当上调,以保持MMP-9/TIMP-1的动态平衡。有研究推论,这种动态平衡是胚胎着床后发挥类似肿瘤细胞的侵袭行为,但又有节制地仅浸润至子宫肌层1/3以维持正常妊娠,而不发生滋养细胞疾病等侵袭性疾病的重要原因[19]。本研究结果表明,随着CoCl2浓度的增加,MMP-9的表达上升,且呈浓度依赖性;TIMP-1的表达与空白组比较均下降,但随CoCl2浓度增加而逐渐上升。这个结果看似矛盾,但TIMP-1的上升可能是对于MMP-9的上升做出的适应性反应,以维持两者比值的动态平衡。低氧状态下MMP-9/TIMP-1的比值随着CoCl2浓度增加而上升,呈浓度依赖性,该比值的上升与促进滋养细胞侵袭力有关[20]。
综上,本研究结果表明,化学模拟的低氧状态可增强HTR-8/SVneo细胞的增殖,可通过HIF-1α的介导使VEGF的表达与MMP-9/TIMP-1比值上调。低氧状态下滋养细胞的生物学行为与早期妊娠的生理状态更加贴近,可为后续探索妊娠相关疾病的机制奠定实验基础。
