白藜芦醇抑制人牙龈成纤维细胞炎症和氧化应激的机制研究
2022-01-04李丽华王玉娇李俊雄李思玉唐婉容邱亚
李丽华,王玉娇,李俊雄,李思玉,唐婉容,邱亚
慢性牙周炎(chlronic periodontitis,CP)是一种破坏性的口腔疾病,是目前成人牙齿脱落的主要原因[1]。CP以与牙龈下斑块中的致病菌如牙龈卟啉单胞菌(P.gingivalis)相关的慢性炎症为特征,最终导致软组织破坏、牙槽骨吸收和牙齿脱落。牙龈卟啉单胞菌可通过脂多糖(LPS)和炎性细胞因子刺激宿主免疫反应的发生[2]。人牙龈成纤维细胞(human gingival fibroblasts,HGF)在牙周组织的形成、再生、功能实施和修复中起重要作用[3]。HGF的活性受免疫因子调节,同时其自身也可以产生细胞因子,最终参与局部炎症[4-5]。另一方面,当活性氧(ROS)的累积超过机体的补偿能力时,机体就会发生氧化应激(OS)反应。OS反应引发多种抗氧化剂和破坏性酶的异常表达,最终导致牙周膜的破坏[6]。因此,减轻炎症和OS反应是治疗CP的重要途径。白藜芦醇(反式-3,5,4′-三羟基茋,RSV)是一种天然的多酚植物抗毒素[7-8]。RSV可以通过负调节Toll样受体4(TLR4)信号传导而改善糖尿病小鼠的实验性牙周炎[9]。在体外RSV对LPS刺激的HGF的调节作用尚不清楚。本文评估了RSV在LPS刺激的HGF细胞中的抗炎和抗氧化作用,并通过TLR4/MyD88/NF-κB信号通路活性的变化探讨其作用机制。
1 材料与方法
1.1试剂 RSV(美国Sigma公司);DMEM培养基(武汉普诺赛公司);胎牛血清(FBS,素尔生物科技有限公司);RIPA裂解缓冲液(南京海克尔生物科技有限公司);BCA试剂盒(上海易色医疗科技有限公司);TLR4、MyD88、p65、p-p65、βactin和LaminB1小鼠源一抗和山羊抗小鼠二抗抗体(美国Abcam公司);牛血清白蛋白(BSA,北京全式金生物技术有限公司);ECL化学发光底物试剂盒(广州赛国生物科技有限责任公司);丙二醛(MDA,A003-1-2)、超氧化物歧化酶(SOD,A001-3-2)、谷胱甘肽过氧化物酶(GSH-Px,A005-1-2)、白细胞介素(IL)-1β(H002)、IL-6(H007-1-2)、IL-8(H008)及肿瘤坏死因子(TNF)-α(H052-1)含量测定酶联免疫吸附试验(ELISA)试剂盒(南京建成生物工程研究所)。
1.2仪器 蛋白电泳设备(美国Bio-Rad公司),凝胶成像系统、细胞培养箱、酶标仪、台式低温离心机(美国Thermo Fisher公司),光学显微镜(日本OLYMPUS公司)。
1.3细胞培养及处理 选择因正畸治疗需拔牙且牙龈健康的志愿者(知情同意,并通过伦理审查),于拔牙时收集牙龈组织;按组织块培养法[10],使用含20%FBS的DMEM培养基培养,在37℃、5%CO2和95%湿度条件下培养HGFs。细胞传代至3~5代时用于后续实验,分为实验1和实验2。采用完全随机对照试验设计方案。实验1:将细胞分为对照组、LPS组、RSV 20组、RSV 40组、RSV 80组、LPS+RSV 20组、LPS+RSV 40组和LPS+RSV 80组。对照组细胞不做处理;LPS组细胞在融合至80%时,将P.gingivalisLPS(1 mg/L)加入无血清的DMEM培养基中培养24 h;RSV 20、40和80组细胞分别使用20、40和80µmol/L RSV处理24 h;LPS+RSV 20、LPS+RSV 40和LPS+RSV 80组细胞分别采用1 mg/LP.gingivalisLPS和20、40、80µmol/L RSV共处理24 h。实验2:将细胞分为对照组、LPS组、LPS+RSV 40组、LPS+RSV 40+E5564组和LPS+E5564组。对照组、LPS组和LPS+RSV 40组细胞处理方法同实验1;LPS+RSV 40+E5564组细胞用1 mg/LP.gingivalisLPS、40µmol/L RSV和10 nmol/L TLR4抑制剂(E5564)共处理24 h;LPS+E5564组细胞用1 mg/LP.gingivalisLPS和10 nmol/L E5564共处理24 h。
1.4HGF增殖能力检测 使用CCK-8试剂盒检测各组HGF增殖能力。取生长至90%的各组细胞,PBS洗涤后用0.25%胰酶消化制成单细胞悬液,调节细胞悬液浓度为7×104/mL,然后以100µL/孔接种于96孔板,每组设6个平行孔,接种的细胞置于37℃、5%CO2条件下孵育48 h。培养结束后,去除每个孔中原有培养基,用无血清新鲜培养基将CCK-8溶液按照10∶1的比例进行稀释并混匀,每孔加入100µL,然后置于培养箱中继续孵育1 h。利用酶标仪检测各组450 nm处光密度(OD)值。
1.5Western blot分析蛋白表达水平 对数生长期的细胞接种到6孔细胞培养板(2.5×105个/mL),每孔2 mL,37℃、5%CO2过夜培养。分组处理后用RIPA裂解液处理各组细胞,提取总蛋白。用BCA试剂盒检测总蛋白浓度,10%SDS-PAGE分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。用5%脱脂牛奶室温封闭蛋白2 h,随后按照适当比例加入一抗(TLR4,MyD88,p65和p-p65;均1∶1 000)于4℃封闭过夜,第2天加入对应二抗(1∶2 000)室温封闭1 h,最后滴入ECL进行曝光,曝光显色后的蛋白使用Bio-Rad全功能成像系统采集图像,Image-ProPlus分析光密度,以β-actin为细胞总蛋白内参,LaminB1为细胞核蛋白内参,计算各组蛋白质的相对表达量。
1.6ELISA分析 使用ELISA试剂盒测定细胞培养上清液中IL-1β、IL-6、IL-8、TNF-α、SOD、MDA和GSH-Px的含量。并使用酶标仪测量450 nm和570 nm处的OD值。
1.7统计学方法 采用SPSS 20.0软件进行数据分析。各实验数据以均值±标准差(±s)表示。多组间比较使用单因素方差分析(one-way ANOVA),组间多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度RSV对LPS诱导的HGF增殖能力的影响 20、40和80µmol/L RSV处理HGF对细胞活力没 有明 显的 毒性 作 用(F=0.803,P>0.05),见图1。
2.2 不同浓度RSV处理对HGF炎症和氧化应激反应的影响 LPS刺激导致IL-1β、IL-6、IL-8和TNF-α水平的增加,40和80µmol/L RSV显著抑制了LPS诱导的HGF细胞中IL-1β、IL-6、IL-8和TNF-α的产生(P<0.05),见表1。此外,LPS刺激显著升高了MDA的含量,降低SOD和GSH-Px的含量(P<0.05)。与LPS组相比,40和80µmol/L RSV处理可显著降低MDA水平,升高SOD活性,80µmol/L RSV处理可显著升高GSH-Px活性(P<0.05),见表2。
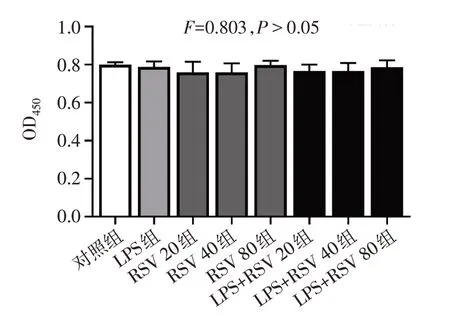
Fig.1 The effect of resveratrol on the viability of HGFs图1 RSV对HGF增殖能力的影响
Tab.1 Effects of RSV on inflammatory factor expression in HGFs表1 各组对HGF细胞炎性因子表达的影响(n=3,ng/L,±s)

Tab.1 Effects of RSV on inflammatory factor expression in HGFs表1 各组对HGF细胞炎性因子表达的影响(n=3,ng/L,±s)
**P<0.01;a与对照组比较,b与LPS组比较,P<0.05;表2、3同
组别对照组LPS组LPS+RSV 20组LPS+RSV 40组LPS+RSV 80组F IL-1β 10.548±0.490 15.001±0.600a 14.614±0.577 12.800±0.566b 11.868±0.278b 28.955**IL-6 2.315±0.252 3.514±0.210a 3.230±0.194 2.983±0.214b 2.590±0.202b 15.023**IL-8 9.188±0.910 14.779±0.915a 13.500±0.541 12.851±0.764b 12.174±0.570b 22.753**TNF-α 4.839±0.247 6.188±0.128a 5.760±0.202b 5.409±0.222b 5.142±0.082b 23.825**
Tab.2 Effects of different concentrations of RSV on oxidative stress in HGF cells表2各组对MDA、SOD和GSH-Px活性的影响(±s)
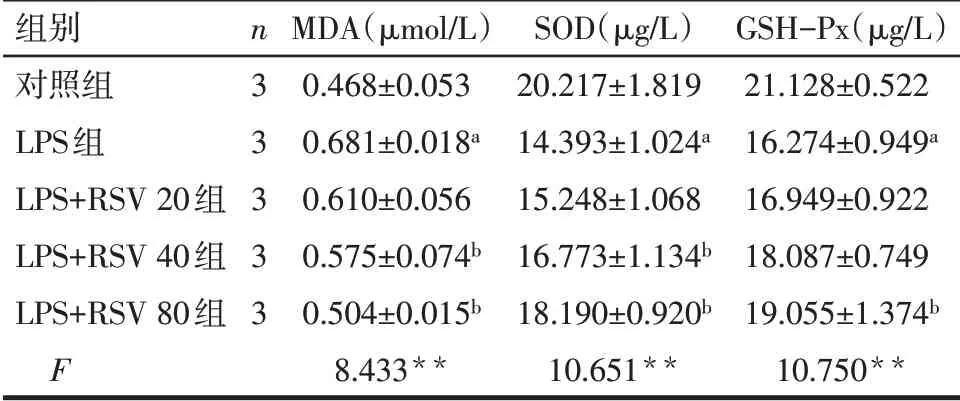
Tab.2 Effects of different concentrations of RSV on oxidative stress in HGF cells表2各组对MDA、SOD和GSH-Px活性的影响(±s)
组别对照组LPS组LPS+RSV 20组LPS+RSV 40组LPS+RSV 80组F n3 3 3 3 3 MDA(µmol/L)0.468±0.053 0.681±0.018a 0.610±0.056 0.575±0.074b 0.504±0.015b 8.433**SOD(µg/L)20.217±1.819 14.393±1.024a 15.248±1.068 16.773±1.134b 18.190±0.920b 10.651**GSH-Px(µg/L)21.128±0.522 16.274±0.949a 16.949±0.922 18.087±0.749 19.055±1.374b 10.750**
2.3 RSV对LPS刺激的HGF中TLR4/MyD88/NF-κB信号途径的调控作用 LPS显著升高了HGF细胞中TLR4、MyD88和p-p65的总蛋白表达水平,且促进了p-p65的核转位(P<0.05)。不同浓度RSV处理明显降低了TLR4、MyD88和p-p65的总蛋白表达水平,并降低了p-p65在细胞核中的表达(P<0.05),见图2、表3。
2.4 RSV对LPS刺激的HGF中炎症和OS反应的影响 TLR4/MyD88/NF-κB通路抑制剂E5564可降低LPS刺激的HGF中TLR4、MyD88和p-p65的总蛋白表达水平,以及p-p65的核内表达水平(P<0.05),见图3、表4。E5564进一步降低了LPS和RSV共处理的HGF细胞中TLR4、MyD88和p-p65的总蛋白表达水平,以及p-p65的核内表达水平(P<0.05),见图3、表4。ELISA结果显示,E5564可以降低LPS刺激的HGF细胞分泌的IL-1β、IL-6、TNF-α和MDA水平,并升高SOD水平(P<0.05),见表5、6。E5564可加强40µmol/L RSV下调的IL-1β、IL-6、IL-8和TNF-α含量的能力(P<0.05),见表5。与LPS+RSV 40组相比,LPS+RSV 40+E5564组提高了GSH-Px的活性(P<0.05),但SOD和MDA表达水平差异无统计学意义(P>0.05),见表6。
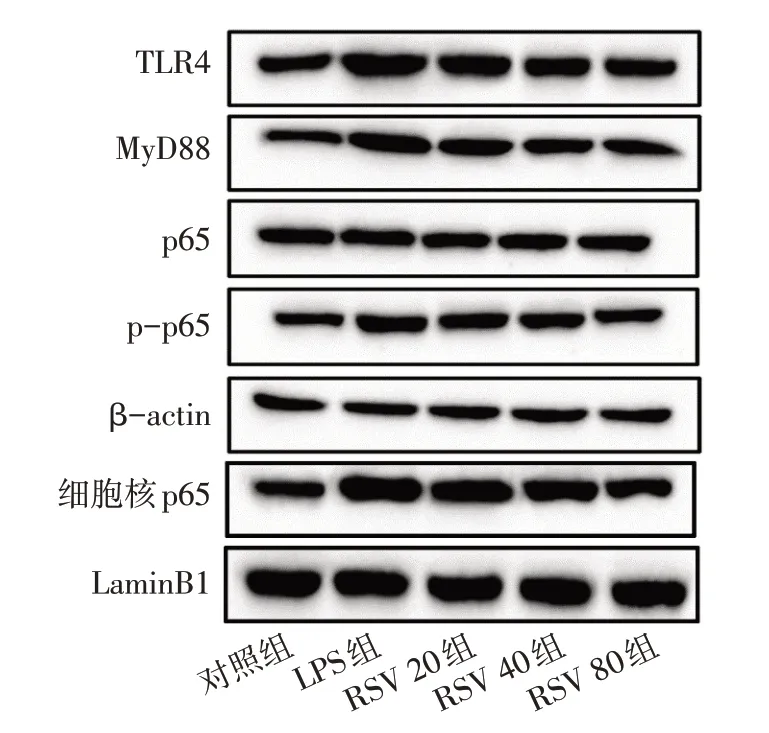
Fig.2 Western blot detection of resveratrol on the regulation of TLR4/MyD88/NF-κB signaling pathway图2 Western blot检测RSV对TLR4/MyD88/NF-κB信号途径的调控作用结果
Tab.3 The regulation of RSV on TLR4/MyD88/NF-κB signaling表3 各组对TLR4/MyD88/NF-κB信号途径的调控作用(±s)

Tab.3 The regulation of RSV on TLR4/MyD88/NF-κB signaling表3 各组对TLR4/MyD88/NF-κB信号途径的调控作用(±s)
组别对照组LPS组LPS+RSV 20组LPS+RSV 40组LPS+RSV 80组F p65 1.000±0.010 0.992±0.093 0.978±0.038 0.958±0.057 0.998±0.008 0.331 p-p65 1.000±0.489 1.645±0.053a 1.459±0.028b 1.253±0.027b 1.159±0.028b 128.241**细胞核p65 1.000±0.003 2.170±0.043a 1.788±0.007b 1.617±0.025b 1.137±0.037b 871.883**组别对照组LPS组LPS+RSV 20组LPS+RSV 40组LPS+RSV 80组F n3 3 3 3 3 TLR4 1.000±0.032 1.855±0.150a 1.501±0.035b 1.243±0.004b 1.183±0.018b 68.637**MyD88 1.000±0.015 1.827±0.154a 1.584±0.035b 1.256±0.014b 1.170±0.024b 63.549**
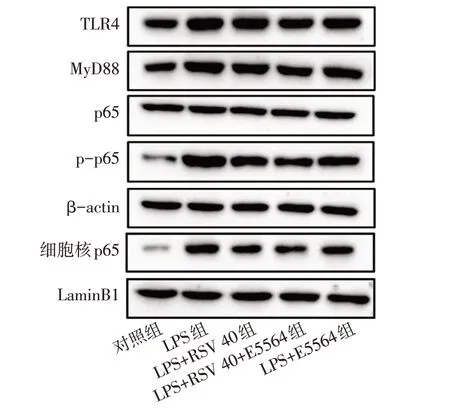
Fig.3 The inhibitory effect of E5564 on TLR4/MyD88/NF-κB pathway detected by Western blot assay图3 Western blot检测E5564对TLR4/MyD88/NF-κB通路的抑制作用结果
Tab.4 Inhibition of RSVon TLR4/MyD88/NF-κBpathway表4 各组对TLR4/MyD88/NF-κB通路的抑制作用(±s)
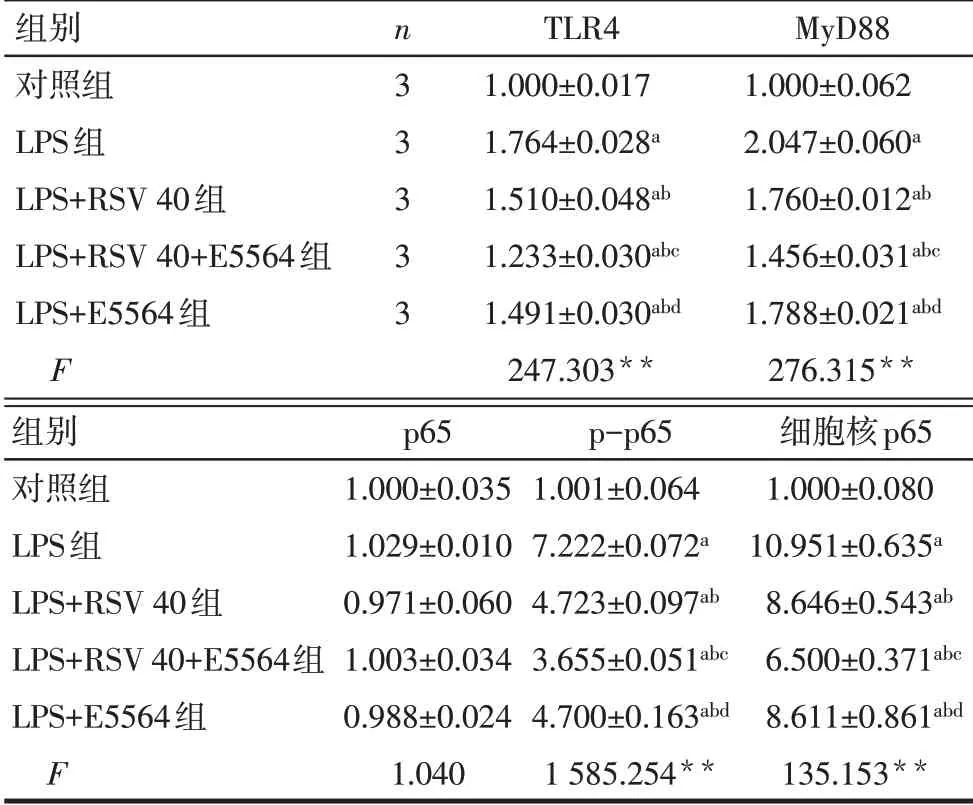
Tab.4 Inhibition of RSVon TLR4/MyD88/NF-κBpathway表4 各组对TLR4/MyD88/NF-κB通路的抑制作用(±s)
**P<0.01;a与对照组比较,b与LPS组比较,c与LPS+RSV 40组比较,d与LPS+RSV 40+E5564组比较,P<0.05;表5、6同
组别对照组LPS组LPS+RSV 40组LPS+RSV 40+E5564组LPS+E5564组F n3 3 3 3 3 TLR4 1.000±0.017 1.764±0.028a 1.510±0.048ab 1.233±0.030abc 1.491±0.030abd 247.303**MyD88 1.000±0.062 2.047±0.060a 1.760±0.012ab 1.456±0.031abc 1.788±0.021abd 276.315**组别对照组LPS组LPS+RSV 40组LPS+RSV 40+E5564组LPS+E5564组F p65 1.000±0.035 1.029±0.010 0.971±0.060 1.003±0.034 0.988±0.024 1.040 p-p65 1.001±0.064 7.222±0.072a 4.723±0.097ab 3.655±0.051abc 4.700±0.163abd 1 585.254**细胞核p65 1.000±0.080 10.951±0.635a 8.646±0.543ab 6.500±0.371abc 8.611±0.861abd 135.153**
3 讨论
传统的牙周炎治疗主要途径为除垢,刮除附着的斑块细菌,并补充抗生素以抑制口腔细菌的形成。天然药物的有效成分因其低毒并能高效抑制细菌耐药性和感染而在CP的治疗中具有广阔的研究前景。
RSV是一种含有黄芪结构的非类黄酮多酚化合物,为非甾体类天然抗氧化剂,其可从葡萄皮、浆果和花生中提取[11]。RSV具有多种生物学活性和药理作用,其抗炎和抗氧化作用已得到广泛研究。RSV预处理通过激活SIRT1因子,提高了老年牙周膜干细胞干性,提示RSV可能用于牙周缺损的修复[12]。研究表明,RSV能显著抑制金黄色葡萄球菌、表皮葡萄球菌、耻垢分枝杆菌和牙龈假单胞菌的生长和毒力因子表达[13]。另外,RSV可通过抑制白细胞中的NF-κB活化,进而降低牙龈卟啉单胞菌LPS诱导的血管炎症[14],并能联合水飞蓟素增强HGF的活力,减少LPS诱导的IL-6和IL-8表达[15]。同时RSV能抑制实验性牙周炎大鼠的牙槽骨吸收和IL-17的表达[16]。本研究结果显示,RSV处理可抑制LPS诱导HGF中炎性因子IL-1β、IL-6、IL-8和TNF-α的分泌。
Tab.5 TLR4/MyD88/NF-κB pathway mediated the regulatory effects of resveratrol on inflammation of LPS-stimulated HGFs表5 不同组别对HGF细胞炎性因子的调节作用(ng/L,±s)

Tab.5 TLR4/MyD88/NF-κB pathway mediated the regulatory effects of resveratrol on inflammation of LPS-stimulated HGFs表5 不同组别对HGF细胞炎性因子的调节作用(ng/L,±s)
组别对照组LPS组LPS+RSV 40组LPS+RSV 40+E5564组LPS+E5564组F n3 3 3 3 3 IL-1β 10.698±0.449 15.253±0.568a 12.819±0.399ab 11.782±0.751abc 13.283±0.441abd 30.422**IL-6 2.251±0.342 3.509±0.072a 3.029±0.182ab 2.630±0.189bc 2.949±0.178ab 14.835**组别对照组LPS组LPS+RSV 40组LPS+RSV 40+E5564组LPS+E5564组F IL-8 9.267±0.780 13.568±0.791a 12.573±0.700a 11.041±0.753abc 13.079±0.579ad 17.562**TNF-α 4.660±0.273 6.100±0.367a 5.494±0.156ab 4.921±0.183bc 5.508±0.292abd 13.490**
Tab.6 TLR4/MyD88/NF-κB pathway mediated the regulatory effects of resveratrol on oxidative stress of LPS-stimulated HGFs表6 不同组别对LPS刺激的HGF氧化应激的调节作用(n=3,±s)

Tab.6 TLR4/MyD88/NF-κB pathway mediated the regulatory effects of resveratrol on oxidative stress of LPS-stimulated HGFs表6 不同组别对LPS刺激的HGF氧化应激的调节作用(n=3,±s)
组别对照组LPS组LPS+RSV 40组LPS+RSV 40+E5564组LPS+E5564组F MDA(µmol/L)0.478±0.043 0.699±0.035a 0.606±0.043a 0.521±0.086b 0.583±0.047ab 7.445**SOD(µg/L)19.779±0.847 13.836±0.173a 16.404±0.669ab 17.487±1.174ab 16.280±0.995ab 19.529**GSH-Px(µg/L)21.894±0.685 16.985±0.690a 17.849±0.894a 19.437±0.654abc 18.012±0.820ad 19.501**
氧化应激是造成细胞损伤的关键因素,过多的氧自由基通常会在细胞膜中引起脂质过氧化和蛋白质氧化损伤,从而破坏细胞膜完整性并诱导细胞炎症或凋亡。研究显示,氧化应激与HGF的增殖、凋亡和迁移以及牙龈伤口愈合关系密切[17-18]。特别是当HGF暴露于细菌细胞壁成分和细胞因子时,细胞释放O2并激活TNF-α,进而上调锰超氧化物歧化酶(MnSOD)的表达,MnSOD的产生对HGF细胞具有保护作用[19]。本研究发现,LPS刺激HGF细胞后,细胞分泌的MDA水平升高,SOD水平和GSH-Px活性降低,RSV可显著减轻LPS诱导的HGF中氧化应激的发生,表现为SOD和GSH-Px含量升高和MDA含量降低。
TLR4蛋白是LPS信号的感应元件,在促进炎症和炎性细胞因子释放中起着重要作用。MyD88蛋白是研究最为广泛的一种TLR4配体,MyD88的激活导致NF-κB的上调,最终促使炎性细胞因子的释放[20]。本研究发现,RSV抑制了TLR4/MyD88/NFκB信号通路的活化。脂蛋白可作为激动剂来促进炎症的消退。最新研究发现,牙周膜细胞中的TLR4/MyD88/NF-κB途径介导了脂蛋白抑制的炎症反应,说明TLR4/MyD88/NF-κB途径在牙周疾病的发展进程中起着关键作用[21]。本研究发现,RSV可通过减弱TLR4/MyD88/NF-κB信号通路的活性来抑制LPS诱导的HGF的炎症和氧化应激损伤。
综上所述,RSV可以抑制LPS刺激的HGF炎症和氧化应激的发生,其重要的作用机制之一是抑制了TLR4/MyD88/NF-κB信号通路的活性。
