3-O-C12-HSL通过抑制lncRNA CD48-AS和CD48的表达而阻碍Mo-DCs成熟
2022-01-04罗燕芬庄奇真张轩陈茶刘杨颜星星肖倩李有强
罗燕芬,庄奇真,张轩,陈茶,刘杨,颜星星,肖倩,李有强
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是临床上难治性肺部感染常见的致病菌[1]。其可通过自身分泌的群体感应分子(quorum-sensing molecules,QS)调节宿主的免疫功能,进而发生免疫逃逸[2]。本课题组前期研究发现,QS信号分子N-3-氧代十二烷酰-L-同型丝氨酸内酯(N-3-oxododecanoyl-L-homoserine lactone,3-O-C12-HSL)可阻碍单核细胞来源的树突状细胞(monocytes derived-dendritic cells,Mo-DCs)的成熟,影响CD4+T细胞极性分化[3-4]。在3-O-C12-HSL阻碍Mo-DCs成熟过程中,长链非编码RNA(long noncoding RNA,lncRNA)的表达谱有明显变化[5],且3-O-C12-HSL可通过过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors,PPARγ)拮 抗Mo-DCs表达lncRNA RP11-367F23.2[6-7]。但lncRNA在3-O-C12-HSL阻碍Mo-DCs成熟过程中发挥的作用及相关机制尚不明确。本研究在前期研究的基础上,筛选出差异表达的lncRNA,并对其在3-O-C12-HSL阻碍Mo-DCs成熟过程中的功能进行初步探讨。
1 材料与方法
1.1材料 RPMI 1640培养基、胎牛血清、磷酸盐缓冲液(PBS)、Trizol均购自Life公司;二甲基亚砜(DMSO)购自Invitrogen公司;人外周血淋巴细胞分离液购自Axis shield公司;人白细胞介素(IL)-4和人粒单核细胞集落刺激因子(hGM-CSF)购自Peprotech公司;脂多糖(lipopolysaccharide,LPS)和3-O-C12-HSL购自Sigma公司;抗人CD14磁珠购自BD公司;PrimeScriptTM反转录试剂盒(去除gNDA)、SYBR Premix Ex TaqⅡ、Oligo(dT)18 Primer均购自TAKARA公司;NE-PERTM细胞核和细胞质提取试剂盒、RNAse CocktailTM酶混合物购自Thermo Fisher公司。
1.2方法
1.2.1人Mo-DCs的分离、诱导与培养 参照前期研究实验体系[3],留取健康人外周血60 mL,与等量PBS混匀后,加入到120 mL的人外周血淋巴细胞分离液中,密度梯度离心法获得单个核细胞。加入抗人CD14免疫磁珠,孵育后使用BD公司的磁力架分选CD14+单核细胞,流式细胞术鉴定后加入RPMI 1640完全培养基(含10%胎牛血清、终浓度500 U/mL的IL-4、500 U/mL的hGM-CSF)。3 d后半量换液,5 d后收获不成熟Mo-DCs,检测Mo-DCs表面CD1a阳性率为(60±6)%[3]。
1.2.2lncRNA芯片检测 参照前期研究实验体系[5],将未成熟的Mo-DCs细胞分为阴性对照组、LPS阳性对照组和实验组进行lncRNA芯片检测。LPS阳性对照组加入终浓度为100µg/L的LPS,实验组加入终浓度为100µg/L的LPS和终浓度为40µmol/L的3-O-C12-HSL,阴性对照组加入与实验组3-O-C12-HSL相等体积的PBS(含0.1%DMSO)。处理24 h后,收集Mo-DCs,提取样品总RNA并反转录为cDNA,采用Arraystar公司的lncRNA芯片,利用Arraystar RNA Flash Labeling试剂盒对双链互补DNA进行标记,Agilent SureHyb进行排列杂交。采用Agilent DNA Microarray Scanner扫描芯片并使用Agilent Feature Extraction软件进行数据分析,采用欧式距离法进行聚类分析。
1.2.3lncRNA验证实验分组与处理 lncRNA验证实验中,将未成熟的Mo-DCs细胞分为5组,其中3-O-C12-HSL浓度参照前期研究实验体系[4]。(1)阴性对照组:加入含0.1%DMSO的PBS。(2)LPS阳性对照组:加入终浓度为100µg/L的LPS。(3)LPS+C5实验组:加入终浓度为100µg/L的LPS和5µmol/L的3-O-C12-HSL。(4)LPS+C10实验组:加入终浓度为100µg/L的LPS和10µmol/L的3-O-C12-HSL。(5)LPS+C25实验组:加入终浓度为100µg/L的LPS和终浓度为25µmol/L的3-O-C12-HSL。
1.2.4荧光定量PCR(qPCR)检测 提取细胞RNA,按照试剂盒说明书去除基因组DNA,将RNA反转录为cDNA后进行qPCR。qPCR反应体系:SYBR Premix Ex Taq 5µL,上下游引物各0.5µL,cDNA模板1µL,ddH2O 3µL。反应条件:50℃120 s;95℃30 s;95℃3 s,60℃30 s,40个循环;95℃15 s,60℃60 s。所用引物序列见表1。
1.2.5lncRNA生物信息学分析 采用UCSC网站(http://genome.ucsc.edu/)查找lncRNA CD48-AS和CD48 mRNA序列后,采用GeneDoc软件分析lncRNA CD48-AS与CD48反义互补区。另采用多种途径对lncRNA CD48-AS的蛋白编码功能进行预测:通过CPC网站(http://cpc.cbi.pku.edu.cn)预测lncRNA CD48-AS的蛋白编码能力[8];通过UCSC数据库[9](https://genome.ucsc.edu/)获得lncRNA CD48-AS的比较基因组(phylo CSF)值;若<0,则提示其为非编码区;通过PubMed ORF finder(http://www.ncbi.nlm.nih.gov/orffinder/)获 取lncRNA CD48-AS的开放阅读框(ORF),对其正义链采用基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)分析以检测是否有同源性蛋白质。

Tab.1 The primer sequences for qPCR表1 qPCR引物序列
1.2.6候选lncRNA CD48-AS的poly(A)尾的验证 收集经LPS处理后的人Mo-DCs,提取细胞RNA,去除基因组DNA后,将反转录体系中的RT Primer Mix更换为Oligo(dT)18Primer反转录为cDNA后,进行PCR反应。
1.2.7RNA酶保护实验(RPA)利用改良RPA实验原理,即RNase A和RNase T1可消化单链RNA,而不消化双链RNA,异丙醇提取消化后产物,产物即为双链RNA。本实验提取经LPS活化成熟的Mo-DCs的RNA,采用焦碳酸二乙酯(Diethyl Pyrocarbonate,DEPC)处理水重悬,加入RNase cocktail酶混合物(RNase A和RNase T1混合物)消化RNA,RNase cocktail酶混合物和RNA体积比为1∶4。37℃消化30 min,加入蛋白酶K去除RNase,异丙醇提取消化后产物,即为双链RNA。针对lncRNA CD48-AS与CD48 mRNA的非互补区和互补区设计相应引物。其中,仅针对lncRNA CD48-AS设计primer A,针对lncRNA CD48-AS与CD48 mRNA互补区设计primer B,仅针对CD48 mRNA设计primer C。primer A和primer C序列见表1,primer B引物序列上游5′-GCATGCTTCTGGTCAGCCTA-3′,下游5′-GAGCTCTTTTAACTCAAGCGAAAC-3′,产物长度104 bp。采用上述3对引物扩增后对目的片段进行半定量,并采用2%凝胶对qPCR产物进行电泳。PCR步骤同1.2.4。
1.2.8lncRNA CD48-AS在人Mo-DCs的胞内定位实验 收集经LPS处理活化的人Mo-DCs,严格按照NE-PERTM细胞核和细胞质提取试剂盒说明书分别提取胞核与胞质内RNA。将RNA分别反转录为cDNA,对lncRNA CD48-AS进行qPCR定量测定。反转录及qPCR反应体系和反应条件同1.2.4。
1.3统计学方法 采用SPSS 23.0软件进行数据分析。计量资料采用均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA芯片结果 3-O-C12-HSL处理Mo-DCs后lncRNA表达谱出现了特异性改变,筛选lncRNA表达谱中差异表达5倍以上的自然反义lncRNA进行聚类分析,发现自然反义lncRNA能够有效地分层聚类,见图1。

Fig.1 Hierarchical clustering graph of more than 5 times differently expressed natural antisense lncRNA图1 5倍以上表达差异的自然反义lncRNA的分层聚类图
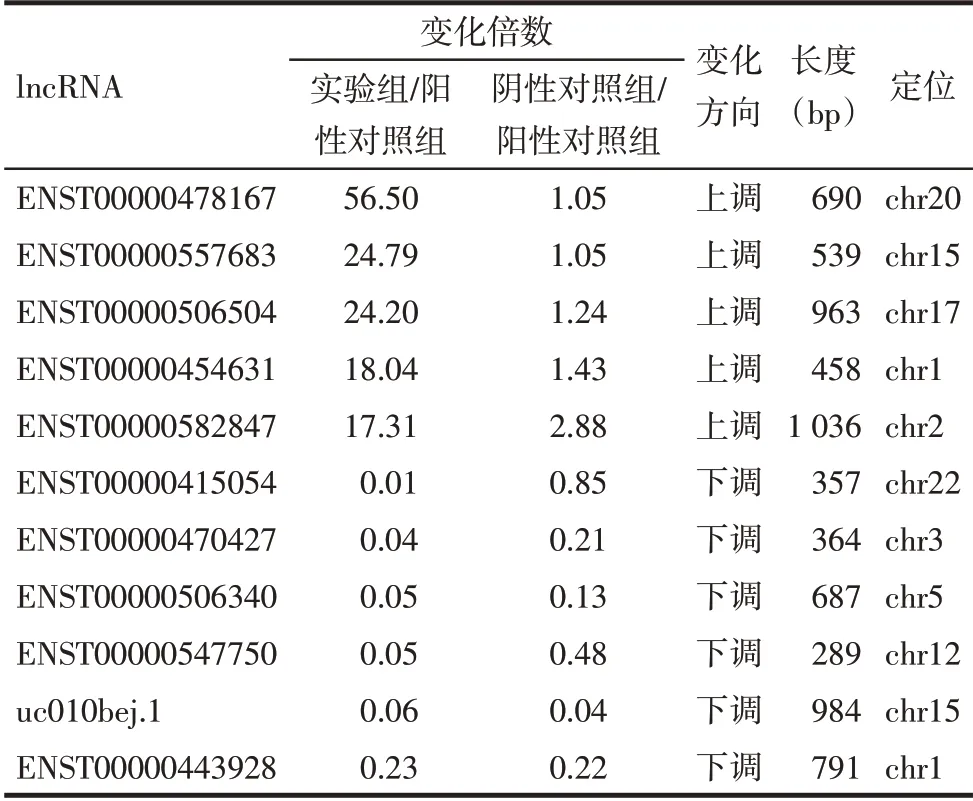
2.2 lncRNA的筛选及鉴定结果 从上述差异表达的自然反义lncRNA中筛选出11条有意义的lncRNA,其中10条为表达差异较明显的lncRNA,另1条为本研究中的候选lncRNA ENST00000443928,结果见表2。与阳性对照组相比,实验组中上调和下调表达较明显的2条lncRNA分别为ENST00000478167(GeneSymol:RP11-157P1.5,本研究命名为lncRNA 167,上调56.50倍)和ENST00000415054(GeneSymol:RP1-85F18.6,本 研究命名为lncRNA 054,下调88.75倍)。而ENST00000443928(GeneSymol:RP11-404F10.2,依据lncRNA命名规则,命名为lncRNA CD48-AS)在实验组中表达下调,预测CD48 mRNA为其自然反义RNA,因CD48在免疫系统发挥重要作用,故将其作为候选lncRNA进行验证。
验证结果显示,与LPS阳性对照组相比,lncDC、lncRNA CD48-AS在不同实验组中表达均有所下调,差异有统计学意义;而lncRNA 167在LPS+C5和LPS+C25实验组中较阴性对照组和LPS阳性对照组均上调,且阴性对照组与LPS阳性对照组间差异无统计学意义(图2),与该体系的构建期望不符。lncRNA 054因表达量太低,本研究中未展示。
Tab.2 The 11 differentially expressed lncRNA表2 差异表达的11条lncRNA
2.3 lncRNA CD48-AS生物信息学分析 基于qPCR验证结果,本研究选择lncRNA CD48-AS作为候选lncRNA进行后续研究。UCSC网站显示其位于1号染色体,为CD48的反义lncRNA,与CD48 mRNA的互补片段为114 bp(图3A)。cDNA长度为11 056 bp,含有4个外显子(长度分别为643、145、113、469 bp)和3个内含子。CPC网站预测结果显示,lncRNA CD48-AS的编码能力评分为-1.19分,其编码蛋白的可能性极小。通过UCSC数据库获得lncRNA CD48-AS的phylo CSF值<0(图3B),提示其为非编码区。通过PubMed ORF finder得知,lncRNA CD48-AS的ORF均小于200 bp,其编码蛋白质的可能性较小,对其正义链BLAST结果显示这些短肽均无同源性蛋白质(图3C),进一步说明该RNA不编码蛋白质。综上多种途径验证,lncRNA CD48-AS不编码蛋白质,为非编码RNA。
2.4 lncRNA CD48-AS的poly(A)尾验证 目前lncRNA CD48-AS序列全长尚未完全确定。为此,qPCR验证后发现,RT primer Mix和Oligo(dT)18Primer 2种不同的引物均可扩增出lncRNA CD48-AS,且表达量差异无统计学意义(P>0.05),见图4,说明lncRNA CD48-AS末端存在与Oligo(dT)引物结合的poly(A)尾。
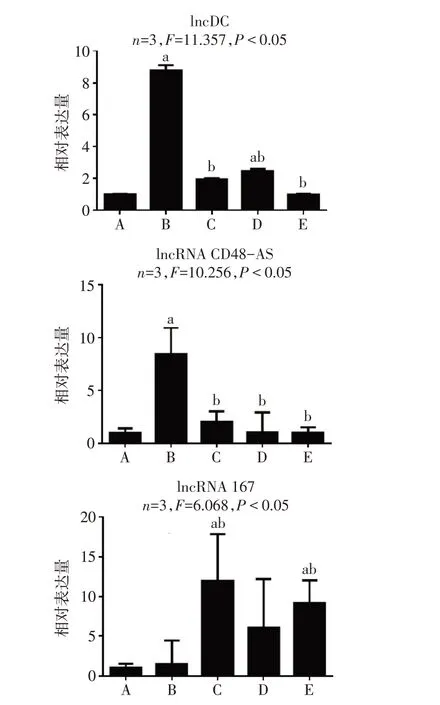
Fig.2 Expression levels of lncRNAs in different treatment groups图2 不同的lncRNA在不同处理组中的表达量
2.5 反义靶分子CD48的检测 因lncRNA CD48-AS序列与CD48的mRNA序列存在114 bp的互补配对,CD48 mRNA可能为lncRNA CD48-AS的反义互补靶分子。通过检测实验体系中CD48的mRNA表达水平后发现,与LPS阳性对照组相比,CD48 mRNA在不同实验组中表达量有所下调,差异有统计学意义,显示出与lncRNA CD48-AS相同的变化趋势,见图5。
2.6 lncRNA CD48-AS与CD48 mRNA形成二聚体 改良RPA实验结果显示,针对互补区的引物(primer B)可扩增出目的片段,而非互补区引物(primer A和primer C)未扩增出目的片段,提示lncRNA CD48-AS与CD48形成了RNA二聚体而不被RNA酶消化,见图6。

Fig.3 Bioinformatics analysis of lncRNA CD48-AS图3 lncRN A CD48-AS的生物信息学分析
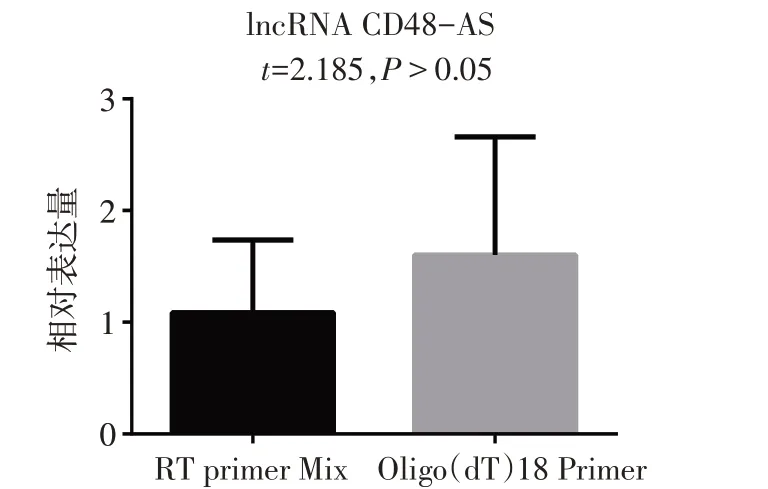
Fig.4 The results of lncRNA CD48-AS amplification with different primers图4 不同引物扩增lncRNA CD48-AS结果
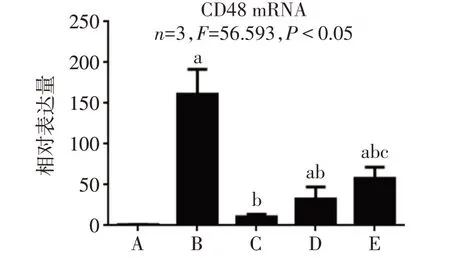
Fig.5 Expression levels of CD48 in different treatment groups图5 CD48在不同处理组中的表达量
2.7 lncRNA CD48-AS在人Mo-DCs的细胞定位 qPCR结果显示,lncRNA CD48-AS在细胞核与细胞质中均有表达,但主要表达在细胞核中,见图7。

Fig.7 The expression of lncRNA CD48-AS in nucleus and cytoplasm图7 细胞核和细胞质中lncRNA CD48-AS的表达量
3 讨论
lncRNA是分子链长度超过200个核苷酸的非编码RNA(non-coding RNA,ncRNA),本身不编码蛋白质,而是以RNA的形式在不同的层面上调控基因的表达,包括转录、翻译和表观遗传等多方面的调控[10-11]。调控的方式包括染色体修饰、转录激活或干扰等[12]。
前期研究显示,3-O-C12-HSL阻碍Mo-DCs成熟过程中,lncRNA表达谱有显著性的差异表达,具有5倍以上表达差异的lncRNA有153条,其中上调表达22条,下调表达131条[5]。本研究在前期研究的基础上,筛选出在3-O-C12-HSL阻碍Mo-DCs成熟过程中差异表达的lncRNA CD48-AS,lncRNA CD48-AS的反义互补靶分子CD48 mRNA的差异表达趋势与lncRNA CD48-AS一致,这种差异可能是由于lncRNA CD48-AS与CD48 mRNA形成二聚体,减少了RNA酶对CD48 mRNA的降解,增强了CD48 mRNA的稳定性,使得CD48表达上调。
Mo-DCs的成熟状态和功能与众多基因的表达水平和细胞增殖分化密切相关[13-14],而lncRNA可在转录及转录后水平调控基因表达,从而调节细胞的增殖与分化,还可调控DC的成熟与功能[15-16]。根据lncRNA与编码蛋白基因位置的关系,将其划分为5类:内含子lncRNA、基因间lncRNA(lincRNA)、双向lncRNA、反义lncRNA和假基因lncRNA。反义lncRNA的靶基因相对明确,具有较好的保守性和稳定性[17],且在多种疾病中发挥重要的调节作用[18]。本研究前期以lncRNA芯片为基础筛选出差异较大的3条反义lncRNA进行qPCR验证,同时采用lncDC作为体系培养的阳性对照[16]。本研究结果显示,与LPS组相比,lncRNA CD48-AS在3-O-C12-HSL实验组中的表达下调,与lncDC的变化趋势一致,提示lncRNA CD48-AS在3-O-C12-HSL阻碍Mo-DCs成熟过程中可能发挥作用。
为阐述lncRNA CD48-AS发挥作用的机制,本研究采用多种生物信息学软件证实了lncRNA CD48-AS为反义lncRNA,其与CD48 mRNA有114 bp的互补区;lncRNA CD48-AS无蛋白编码功能,且具有poly(A)尾。CD48是淋巴细胞活化分子家族的成员,参与免疫细胞的黏附与活化,主要表达于造血细胞,但在多种其他活化细胞中均有高表达。CD48通过结合细胞表面的CD2、细菌的FimH分子或通过细胞的内部效应而起到活化抗原提呈细胞(APCs)和粒细胞的作用。CD48还可通过其在APCs上的表达促进T细胞活化,起到黏附和共刺激的作用[19]。反义RNA可在复制、转录和翻译水平影响mRNA的表达。本实验模型中,CD48的差异表达趋势与lncRNA CD48-AS差异表达趋势一致,即与LPS组相比,CD48在3-O-C12-HSL组的表达明显下调。有研究报道,lncRNA可与反义RNA形成RNA二聚体,增加mRNA稳定性,使其表达增加[17]。本实验进一步采用改良RPA实验,设计了3对针对不同区域的引物,仅使用lncRNA CD48-AS与CD48互补区引物时可扩增出目的片段,使用非互补区的引物时均无扩增片段,进一步证实了lncRNA CD48-AS与CD48 mRNA形成的二聚体增加了CD48 mRNA的稳定性。
lncRNAs表达在不同细胞及在细胞内的不同定位决定着其功能及发挥作用的机制。在细胞质中,lncRNA可与靶RNAs直接作用,控制RNA的表达和mRNA的翻译;还可与信号蛋白相互作用,调节信号通路特异性基因的表达;而细胞核lncRNA则在表观遗传调控和转录过程[20]中发挥重要作用。本研究发现,lncRNA CD48-AS在细胞核及细胞质中均有表达,但主要表达在细胞核中,提示其可能还通过表观遗传或转录过程调控其他基因的表达,从而在3-OC12-HSL阻碍Mo-DCs成熟过程中发挥作用。
综上所述,本研究通过筛选并验证lncRNA CD48-AS在实验体系中的表达,发现3-O-C12-HSL抑制了Mo-DCs成熟过程中lncRNA CD48-AS的表达,并且可能通过抑制lncRNA CD48-AS的表达使CD48的表达下调,从而抑制Mo-DCs的成熟,丰富了lncRNAs在3-O-C12-HSL通过Mo-DCs介导免疫逃逸中的分子机制。然而,lncRNA CD48-AS的具体功能、作用机制以及表达调控机制还待进一步的研究与验证。
