重组人干扰素α-2b联合异丙托溴铵、糖皮质激素治疗病毒性喘息型支气管肺炎患儿的疗效及肺功能分析
2021-12-31胡玉华赵晓燕
胡玉华,赵晓燕
(南乐县人民医院 儿科,河南 濮阳 457400)
喘息性支气管肺炎是一种特殊的呼吸系统疾病,临床常表现为发热、咳嗽、气喘、肺部啰音明显等症状,可由多种病原体感染引起,而小儿病毒性支气管肺炎多是呼吸道合胞病毒等感染引起,其发病率高、易反复发作,持续性喘息症状会加重支气管感染,且由于儿童支气管未发育完全,易产生多种并发症,有研究统计大约30%患儿会发展成小儿哮喘,严重威胁患儿生命安全[1-4]。临床上常用异丙托溴铵和糖皮质激素治疗,可快速缓解患儿临床症状,但部分患儿会出现复发情况[5-6]。重组人干扰素α-2b 可作用于病毒感染过程,联合用药有望加强疗效,治愈疾病[7-8]。本研究目的是探讨重组人干扰素α-2b联合异丙托溴铵、糖皮质激素治疗病毒性喘息型支气管肺炎患儿的效果,分析肺功能改善程度。
1 资料和方法
1.1 一般资料
选取2020年7月至2021年7月南乐县人民医院病毒性喘息型支气管肺炎患儿98 例,根据治疗方案分为两组,对照组、观察组各49 例。其中对照组女21 例,男28 例,年龄1 个月~9 岁,平均(3.12±1.34) 岁;病程1 ~7 d,平均(4.02±1.21) d。观察组女23 例,男26 例,年龄1 个月~10 岁,平均(3.46±1.41) 岁;病程2 ~8 d,平均(4.54±1.25) d。本研究经本院伦理委员会审批,两组基线资料具有可比性(P<0.05)。
1.2 选取标准
纳入标准:临床症状、实验室检查、影像学检查符合喘息性支气管肺炎诊断标准[9];年龄1 个月~12 岁;血常规检查显示为病毒感染;患儿家属知晓治疗方案;签订知情同意书。
排除标准:合并支气管异物者;合并细菌感染者;合并支气管狭窄者;合并心力、呼吸衰竭者;合并心、肝、肾功能不全者;严重免疫系统功能障碍者;对本研究药物过敏者;合并其他恶性肿瘤者。
1.3 方法
两组均给予退热、止咳化痰、面罩吸氧等常规治疗。
对照组给予异丙托溴铵溶液( 四川普锐特药业有限公司,批准文号H20203591)+ 地奈德混悬液( 正大天晴药业集团股份有限公司,批准文号H20203063) 治疗,异丙托溴铵雾化吸入,4 mL/ 次,2 次/d;布地奈德雾化吸入,2 mL/ 次,2 次/d,连续治疗7 d。
观察组在对照组基础上,加用重组人干扰素α-2 b(天津未名生物医药有限公司,批准文号S10970076) 雾化吸入,10 μg/ 次,1 次/d。
两组均连续治疗7 d。
1.4 观察指标
(1)治疗有效率。根据患儿临床症状制定疗效标准。痊愈:临床症状完全消失,肺功能各项指标均恢复正常水平;显效:临床症状明显改善,肺功能各项指标接近正常水平;有效:临床症状有缓解,肺功能各项指标改善明显;无效:临床症状无变化,肺功能各项指标无改善。治疗有效率=( 总例数- 无效)/ 总例数×100%。
(2)临床症状改善时间。治疗后观察两组临床症状,记录患儿咳嗽、肺部啰音、喘息、退热消失时间。
(3) 肺功能指标。治疗前后在患儿镇静状态下,用肺功能测定仪( 由德国JAEGER 公司提供,型号:MasterScreen) 重复测定2 ~3 次,最佳两次检测误差小于5%,取最佳数值,记录患儿第1 秒用力呼气容积(FEV1)、用力肺活量(FVC)、第1 秒用力呼气容积/用力肺活量(FEV1/FVC)。
(4) 血清炎性因子。治疗前后抽取患儿空腹静脉血5mL,分离提取血清,冷藏保存。采用酶联免疫法检测炎性因子白三烯E4(LTE4)、嗜酸性粒细胞离子蛋白(ECP)。
(5)免疫功能。用流式细胞仪(由贝克曼库尔特提供,型号:CytoFLEX) 检测T 淋巴细胞CD4+、CD8+水平。
1.5 统计学方法
采用SPSS 22.0 统计学软件处理数据,计量资料以±s表示、t检验,计数资料用n(%) 表示、χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组治疗有效率比较
两组治疗有效率对比,观察组93.75% 高于对照组70.83%,差异有统计学意义(P<0.05)。见表1。

表1 两组治疗有效率比较[n(%)]Table 1 Comparison of total effective rates between two groupsn [n(%)]
2.2 治疗后两组临床症状改善时间比较
治疗后观察组咳嗽、肺部啰音、喘息、退热消失时间均短于对照组,差异有统计学意义(P<0.05)。见表2。
表2 治疗后两组临床症状改善时间比较(± s ,d)Table 2 Comparison of improvement time of clinical symptoms between the two groups after treatment(± s ,d)
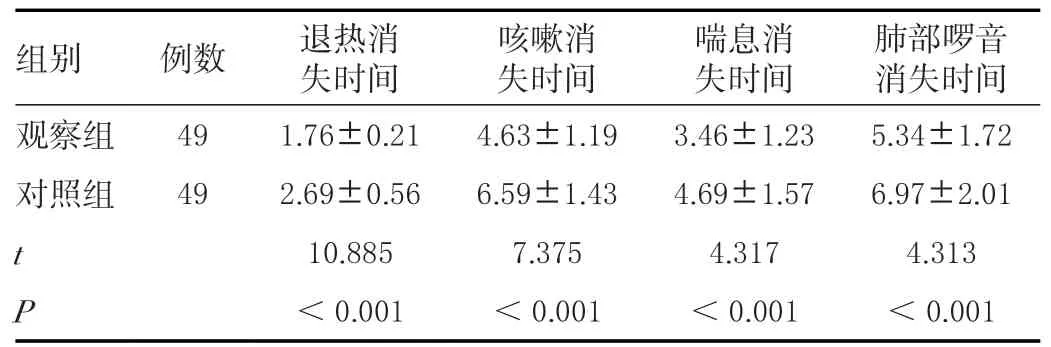
表2 治疗后两组临床症状改善时间比较(± s ,d)Table 2 Comparison of improvement time of clinical symptoms between the two groups after treatment(± s ,d)
组别 例数 退热消失时间咳嗽消失时间喘息消失时间肺部啰音消失时间观察组 49 1.76±0.21 4.63±1.19 3.46±1.23 5.34±1.72对照组 49 2.69±0.56 6.59±1.43 4.69±1.57 6.97±2.01 t 10.885 7.375 4.317 4.313 P<0.001 <0.001 <0.001 <0.001
2.3 治疗前后两组肺功能指标比较
治疗前两组FEV1、FVC、FEV1/FVC 相比,差异无统计学意义(P>0.05);治疗后与对照组FEV1、FVC、FEV1/FVC 相比,观察组较高,差异有统计学意义(P<0.05)。见表3。
表3 治疗前后两组肺功能指标比较(± s )Table 3 Comparison of pulmonary function indexes between the two groups before and after treatment(± s )

表3 治疗前后两组肺功能指标比较(± s )Table 3 Comparison of pulmonary function indexes between the two groups before and after treatment(± s )
组别 例数 FVC/L FEV1/L FEV1/FVC治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组 49 1.14±0.21 1.83±0.29 0.74±0.11 1.47±0.25 0.65±0.15 0.80±0.05对照组 49 1.12±0.16 1.39±0.31 0.76±0.13 1.03±0.28 0.68±0.12 0.74±0.04 t 0.530 7.256 0.822 8.205 1.093 6.559 P 0.597 <0.001 0.413 <0.001 0.277 <0.001
2.4 治疗前后两组血清炎性因子比较
治疗前两组LTE4、ECP 水平对比,差异无统计学意义(P>0.05);治疗后观察组LTE4、ECP 水平低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 治疗前后两组血清炎性因子比较(± s ,μg/L)Table 4 Comparison of serum inflammatory factors between the two groups before and after treatment(± s ,μg/L)
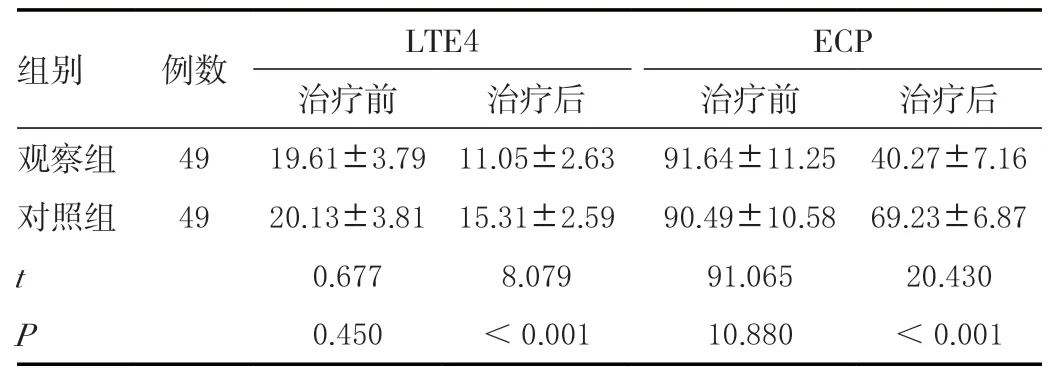
表4 治疗前后两组血清炎性因子比较(± s ,μg/L)Table 4 Comparison of serum inflammatory factors between the two groups before and after treatment(± s ,μg/L)
组别 例数 LTE4 ECP治疗前 治疗后 治疗前 治疗后观察组 49 19.61±3.79 11.05±2.63 91.64±11.25 40.27±7.16对照组 49 20.13±3.81 15.31±2.59 90.49±10.58 69.23±6.87 t 0.677 8.079 91.065 20.430 P 0.450 <0.001 10.880 <0.001
2.5 治疗前后两组细胞免疫功能比较
治疗前两组CD4+、CD8+水平对比,差异无统计学意义(P>0.05);治疗后观察组CD4+高于对照组,CD8+低于对照组,差异有统计学意义(P<0.05)。见表5。
表5 治疗前后两组细胞免疫功能比较(± s ,%)Table 5 Comparison of cellular immune function between the two groups before and after treatment(± s ,%)
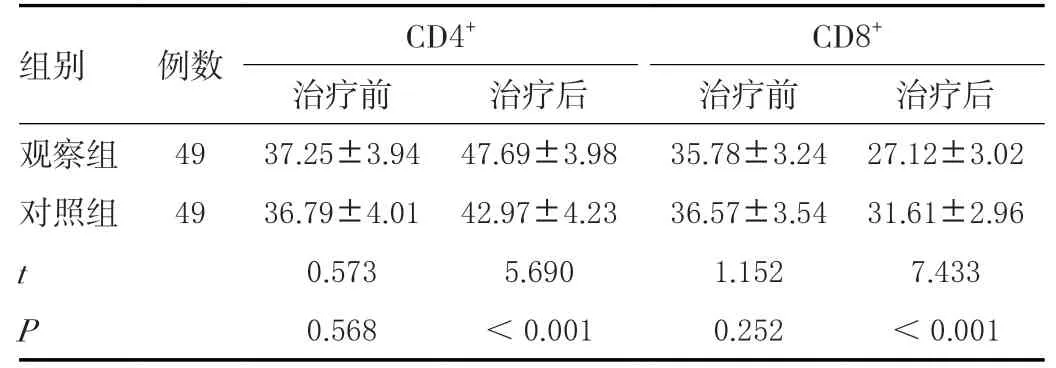
表5 治疗前后两组细胞免疫功能比较(± s ,%)Table 5 Comparison of cellular immune function between the two groups before and after treatment(± s ,%)
组别 例数 CD4+ CD8+治疗前 治疗后 治疗前 治疗后观察组 49 37.25±3.94 47.69±3.98 35.78±3.24 27.12±3.02对照组 49 36.79±4.01 42.97±4.23 36.57±3.54 31.61±2.96 t 0.573 5.690 1.152 7.433 P 0.568 <0.001 0.252 <0.001
3 讨 论
病毒性喘息型支气管肺炎属于上呼吸道感染疾病,多发于春冬季节,其发病急,进展快,一旦延误治疗,会造成多种并发症,因此及时就诊,采用有效方式进行治疗至关重要。
目前临床治疗主要是通过减轻气道水肿、改善气道阻塞来缓解患儿喘息症状。雾化吸入药物可充分接触气道,直击病变部位,见效较快[10-12]。布地奈德是常见糖皮质激素药物,抗炎作用强,雾化吸入后可直接作用于支气管病变部位,抑制细胞中磷脂酶A2 合成,从而减少炎性介质释放,同时收缩黏膜血管,降低其通透性,进一步抑制炎症反应,改善因过度炎症导致的气管堵塞,从而改善肺部通气功能[13-17]。异丙托溴铵作为强效抗胆碱药物,主要作用于支气管平滑肌,抑制乙酰胆碱和其表面受体结合,从而起到扩张平滑肌,缓解气管痉挛作用,还能抑制黏液腺体分泌痰液阻塞气管,可有效缓解气喘症状[18-20]。但无抗病毒的作用,对于病毒性感染的支气管肺炎,效果有限[21]。重组人干扰素α-2b 具有高效抗病毒作用,高特异性可与细胞表面受体结合,抑制病毒蛋白合成,阻碍病毒增殖,起到高效抗病毒作用,同时促进T 淋巴细胞、巨噬细胞等活化,发挥机体自身免疫调节作用[22-23]。
本研究结果中,观察组治疗有效率93.75%高于对照组70.83%,咳嗽、肺部啰音、喘息、退热消失时间均短于对照组,差异具有统计学意义(P<0.05),提示联合重组人干扰素α-2b 治疗,可较快促进患儿体温恢复,减轻咳嗽、喘息等临床症状。本研究中还着重分析了两组肺功能指标和免疫功能指标的改善情况,治疗后观察组FEV1、FVC、FEV1/FVC、以及CD4+水平均高于对照组,CD8+水平低于对照组,差异具有统计学意义(P<0.05),说明重组人干扰素α-2b 联合用药,可促进免疫能力提高,发挥机体自我调节功能,从而改善患儿肺部气体交换 功能。
LTE4 是半胱氨酰白三烯,机体受病毒感染后,会刺激LTE4 表达增多,抑制支气管平滑肌舒张,加重气管痉挛症状,同时LTE4 升高会激活嗜酸性粒细胞产生毒性蛋白ECP,加重炎症反应,因此LTE4、ECP 水平可反映气管炎症情况[24-25]。本研究显示,治疗后两组ECP、LTE4 水平均下降,且观察组LTE4、ECP 水平低于对照组,差异有统计学意义(P<0.05),提示联合重组人干扰素α-2b 有助于减轻气管炎症反应,其原因在于该药物可促进细胞分泌抗病毒蛋白,同时对细胞释放炎性因子有一定的抑制作用。
综上可知,在异丙托溴铵、糖皮质激素基础上,联合重组人干扰素α-2b 治疗病毒性喘息型支气管肺炎患儿的效果显著,可有效促进患儿肺功能恢复,缓解临床病症。
