猪δ冠状病毒胶体金试纸条检测方法的建立
2021-12-30孔冬妮于义娟王碧群石宝兰郑良益李婷婷谢红玲
张 敏,孔冬妮,李 建,于义娟,黄 涛,王碧群,石宝兰,朱 薇,郑良益,李婷婷,谢红玲*
(1.国药集团动物保健股份有限公司,武汉430075;2.中国兽医药品监察所,北京100081)
猪δ 冠状病毒(Porcine deltacoronavirus, PDCoV)是一种引起猪腹泻的重要传染病原,对养猪业造成了巨大经济损失,是当前猪病防控的重大难题。PDCoV于2012年首次被报道,由Woo 等通过流行病学调查在动物粪便中成功检测到[1]。目前在我国猪病料中也检出PDCoV,由该病流行趋势推测近年在我国爆发的可能性是存在的[2]。PDCoV感染后猪出现厌食、呕吐、严重腹泻和脱水等临床症状,与猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)及猪急性腹泻综合征冠状病毒(Swine acute diarrhea syndrome coronavirus, SADS-CoV)等感染十分类似,给临床诊断带来极大困难,因此急需研究开发高效、准确、快速的抗原诊断方法[3-4]。胶体金免疫层析技术具有简单、快速、灵敏、可现场操作等优点,目前已经被广泛应用。本研究旨在研制PDCoV的免疫胶体金试纸条,实现临床PDCoV的快速准确检测,为猪腹泻病防控奠定坚实基础。
PDCoV为单股正链RNA病毒,含9个开放阅读框(open reading frame,ORF),基因共编码4个结构蛋白,分别为棘突蛋白S (spike)、囊膜蛋白E (envelope)、膜蛋白M (membrane)和核衣壳蛋白N (nucleocapsid)[5]。其中N蛋白是一种磷酸化的多功能结构蛋白,保守性强,在感染早期的病猪血清中可检测到高水平的N蛋白抗体[6-7],因此可将N蛋白作为PDCoV感染早期血清学诊断的靶标蛋白。本实验构建表达和纯化了有生物活性的PDCoV N蛋白,以其作为免疫原免疫小鼠,制备其单克隆抗体(Monoclonal antibodyies, McAbs),同时应用胶体金免疫层析技术,成功建立PDCoV免疫胶体金试纸条快速检测方法,助力PDCoV的临床诊断及流行病学调查。
1 材料与方法
1.2 PDCoV N蛋白表达载体的构建与蛋白表达纯化
1.2.1 引物设计 根据GenBank 中登录的PDCoV1601株病毒序列设计RT-PCR 引物,预期扩增片段为1029 bp。引物序列为:PDCoV-NF:5'-TTTTCTCGAGATGGCCGCACCAGTAGTCCCTA ̄CTACTG-3' (XhoI);PDCoV-NR:5'-AAAA ̄AAGCTTCTACGCTGCTGATTCCTGCTTTATCT ̄CAA-3' (Hind III)。
1.2.2 PDCoV中N基因的扩增及重组表达质粒的构建 参照RNA 提取试剂盒说明书提取总RNA并以其为模板,按上述引物扩增PDCoV的N基因。RT-PCR 的反应参数是:94 ℃预热3 min,94 ℃变性30 s,56 ℃退火温度30 s,72 ℃延伸2 min(从第二步94 ℃变性到第四步72 ℃延伸进行35个循环),72 ℃延伸10 min。回收纯化的PCR 产物经XhoI 和Hind III 酶切后克隆至pCold 1 载体中,构建重组表达质粒pCold 1-N。
1.2.3 重组PDCoV N蛋白的表达、纯化及鉴定 将pCold 1-N转化至受体菌DH5a,待OD600nm达到0.4~0.5时,IPTG 诱导表达,将BL21诱导前的培养物、离心上清、超声破碎后的菌体和上清进行SDS-PAGE电泳。表达的上清再过Ni柱进行纯化,分别收集流穿液和各洗脱峰。并将各样品进行SDS-PAGE电泳。同时将纯化前后的样品进行SDS-PAGE电泳、转膜,加入合适稀释倍数的阳性猪血清作一抗,用羊抗猪IgG-HRP为二抗,进行Western Blot鉴定。
1.3 单克隆抗体的研制
1.3.1 动物免疫 将一定量的PDCoV N蛋白与等体积的弗氏完全佐剂混合并完全乳化后,小鼠腹股沟两侧靠近淋巴结区和颈部皮下多点免疫,每只50μg/0.5mL;21 d后2免,免疫剂量为首次免疫的一半,佐剂用弗氏不完全佐剂;间隔21 d后3免,免疫剂量和佐剂同2免;10 d之后采用腹腔注射进行加强免疫,剂量同首免,3 d后融合。
This room is twice as large as that one. 这个房间是那个房间的两倍大。
1.3.2 细胞融合 按照常规方法无菌采取小鼠的脾细胞,与骨髓瘤细胞按10∶1比例混合,用PEG1450进行融合,将融合之后的细胞加入铺好饲养细胞的96孔板中。
1.3.3 杂交瘤细胞株筛选 利用间接ELISA法和间接免疫荧光法对所培养的杂交瘤上清进行检测,有限稀释法对检测阳性的杂交瘤细胞进行至少三次以上的克隆直至阳性率为100%为止。
1.4 单克隆抗体的鉴定
1.4.1 腹水的生产及其纯化 选择12周龄以上的雌性BALB/c小鼠,腹腔注射单克隆杂交瘤细胞,7 d之后收取小鼠腹水,采用辛酸-硫酸铵法纯化腹水。
1.4.2 单克隆抗体的亚类测定 按照洛阳赛尔维公司单抗亚类试剂盒说明书进行单克隆抗体亚类的测定。
1.4.3 单克隆抗体特异性鉴定 将PDCoV、TGEV、PEDV分别接种长满单层的PK1细胞、Vero细胞、ST细胞的96孔板中,置37 ℃、5% CO2培养箱中培养72 h后用冷丙酮固定;以PDCoV N蛋白单克隆抗体作为一抗,FITC标记的抗鼠IgG作为二抗进行间接免疫荧光检测,于荧光显微镜下观察试验结果。
1.5 免疫胶体金试纸条的制备及检测
1.5.1 猪δ冠状病毒胶体金快速检测试纸条的制备用柠檬酸三钠还原法制备25 nm 的金颗粒溶液,标记量为30 μg/mL胶体金溶液的单克隆抗体E8,搅拌30 min,再加入终浓度20%的PEG 20000稳定未结合的胶体金颗粒,8700 r/min离心30 min,弃上清,再用金标缓冲溶液定容至2 mL。标记好的胶体金溶液均匀涂布于金标垫上,37 ℃烘干2 h备用。再将羊抗小鼠IgG二抗和单克隆抗体A10分别以1 mg/mL浓度包被硝酸纤维素膜作为质控线和检测线,37 ℃烘干2 h备用。将准备好的硝酸纤维素膜、样品垫、金标垫和吸水纸按顺序粘贴到背衬板上,切条机切割成4 mm条,组装成检测试纸条。
1.5.2 猪δ冠状病毒胶体金快速检测试纸条检测
1.5.2.1 试纸条敏感性检测 将105TCID50/mL的PDCoV病毒液用0.01 mol/L的PBS进行1∶10、1∶100、1∶1000、1∶10000系列稀释,加样量为0.1 mL/孔,分别用本试纸条进行检测,评判试纸条检测敏感性。
1.5.2.2 试纸条特异性检测 取PEDV、TGEV、猪瘟病毒、猪圆环病毒、PDCoV阴性对照样品,分别用本试纸条进行检测,评判试纸条特异性。
2 结果与分析
2.1 PDCoV重组N蛋白表达及鉴定
2.1.1 PDCoV N基因的PCR扩增 PCR扩增出PDCoV N蛋白基因片段,电泳检测结果(图1)显示,目的基因PDCoV N蛋白基因片段长度为1029 bp,与预期结果相符。

1-12:PDCoV N gene;M:Trans2K Plus Ⅱ DNA Marker图1 PDCoV N基因PCR扩增图Fig 1 The PCR results of PDCoV N gene
2.1.2 PDCoV N蛋白表达、纯化及鉴定 SDS-PAGE电泳结果(图2、图3)显示,表达纯化后的N蛋白分子量大小约为41 kD,与预期重组N蛋白分子量一致。同时重悬的菌体碎片和上清的条带颜色深度相似,判定表达的N蛋白为分泌型表达。Western Blotting结果进一步表明,重组质粒样品孔出现一条与目的蛋白大小相同的条带,表明该重组N蛋白具有反应原性(图4)。
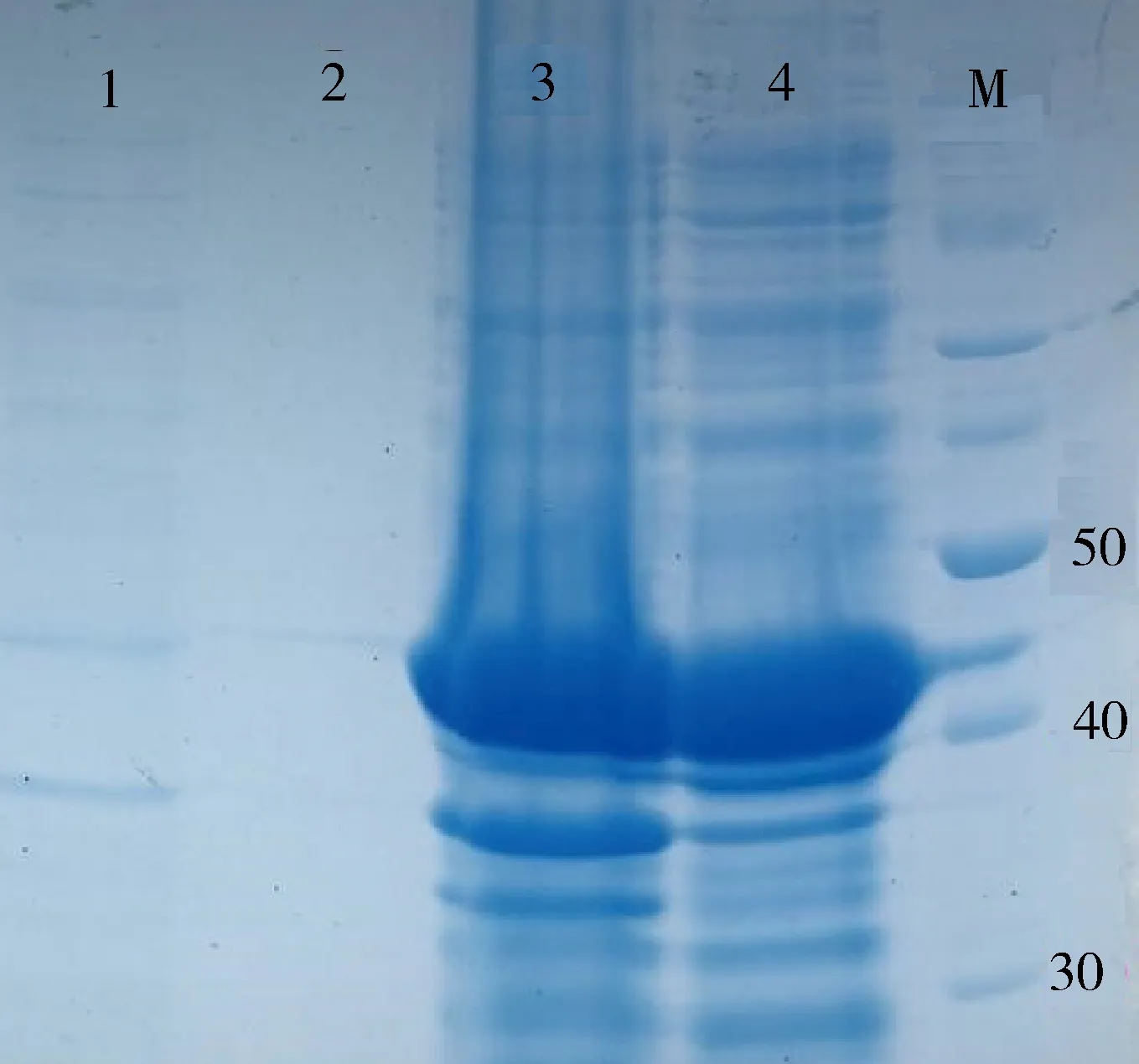
1:诱导表达前菌体;2:诱导表达前上清;3:诱导表达后破碎菌体重悬;4:诱导表达后上清;M:PageRuler 非预染蛋白Marker1:Bacteria protein before induction;2:Supernatant before induction;3:Supernatant of the bacteria lysate after induction;4:Supernatant after induction;M:PageRuler unstained protein ladder图2 PDCoV N蛋白表达各成分鉴定图Fig 2 Identification of PDCoV N protein

1:PDCoV N蛋白纯化前;2:流穿杂蛋白样;3-6:各洗脱时间段收获PDCoV N蛋白样;M:PageRuler 非预染蛋白Marker1:Unpurified PDCoV N protein;2:Impure protein;3-6:Purified PDCoV N protein;M:PageRuler unstained protein ladder图3 PDCoV N蛋白过柱纯化鉴定图Fig 3 Identification and purification of PDCoV N protein

1:纯化前样;2:纯化后样;M:PageRuler 预染蛋白Marker1:Unpurified PDCoV N protein;2:Purified PDCoV N protein;M:PageRuler prestained protein ladder图4 PDCoV N蛋白纯化Western Blot鉴定图Fig 4 Western Blot identification of purified PDCoV N protein
2.2 单克隆抗体研制及鉴定 共筛选2株分泌PDCoV N蛋白抗体单克隆杂交瘤细胞株,分别命名为E8和A10。
2.2.1 单克隆抗体亚类测定 E8亚类是IgG2a,A10亚类是IgG1。
2.2.2 腹水的纯化 将纯化的抗体进行SDS-PAGE分析,结果如图5,单克隆抗体重链大小为50 kD左右,轻链大小为25 kD左右。

1:E8单抗;2:A10单抗;M:PageRuler 非预染蛋白Marker1:Monoclonal antibody E8;2:Monoclonal antibody A10;M:PageRuler unstained protein ladder图5 PDCoV N蛋白单抗纯化SDS-PAGE鉴定图Fig 5 SDS-PAGE identification of purified McAbs against PDCoV N protein
2.2.3 单克隆抗体特异性鉴定 E8、A10单克隆抗体均能与感染PDCoV的PK1细胞反应,可见明显绿色荧光,与阴性细胞无荧光。且单克隆抗体与感染TGEV、PEDV的细胞均不发生特异性反应,无荧光信号,说明E8、A10单克隆抗体只与PDCoV发生反应,与TGEV、PEDV均不发生反应,单克隆抗体特异性良好(图6、图7)。

A:感染PDCoV细胞孔;B:感染TGEV细胞孔;C:感染PEDV细胞孔;D:正常细胞对照A:Infected PDCoV;B:Infected TGEV;C:Infected PEDV;D:Negative control图6 单克隆抗体E8特异性间接免疫荧光检测结果(40×)Fig 6 Immunofluorescence assay(IFA) analyze the binding of antibody E8 and antigen(40×)

A:感染PDCoV细胞孔;B:感染TGEV细胞孔;C:感染PEDV细胞孔;D:正常细胞对照A:Infected PDCoV;B:Infected TGEV;C:Infected PEDV;D:Negative control图7 单克隆抗体A10特异性间接免疫荧光检测结果(40×)Fig 7 Immunofluorescence assay(IFA) analyze the binding of antibody A10 and antigen(40×)
2.3 免疫胶体金试纸条检测方法的敏感性及特异性
2.3.1 试纸条检测敏感性 105TCID50/mL的PDCoV病毒液分别进行1∶10、1∶100、1∶1000、1∶10000稀释,其中1∶10、1∶100、1∶1000稀释度检测结果均为阳性,1∶10000稀释检测结果为阴性,本试纸条检测PDCoV的最低限为100 TCID50,试纸条敏感性检测结果见图8。

1:1∶10稀释;2:1∶100稀释;3:1∶1000稀释;4:1∶10000稀释1:the dilution of 1∶10;2:the dilution of 1∶100;3:the dilution of 1∶1000;4:the dilution of 1∶10000图8 试纸条敏感性检测结果Fig 8 Sensitivity test of dipstick
2.3.2 试纸条检测特异性 分别用本试纸条对猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪瘟病毒、猪圆环病毒、PDCoV阴性对照样品进行检测,结果均为阴性,表明该试纸条不与猪其他病毒反应,特异性好,试纸条特异性检测结果见图9。

1:猪流行性腹泻病毒;2:猪传染性胃肠炎病毒;3:猪瘟病毒;4:猪圆环病毒;5:阴性对照1:PEDV;2:TGEV;3:Swine fever virus;4:Porcine circovirus virus;5:Negative control图9 试纸条特异性检测结果Fig 9 Specificity test of dipstick
3 讨 论
本研究成功构建了PDCoV N蛋白表达载体,获得了纯化的PDCoV N蛋白,以PDCoV N蛋白作为免疫抗原,通过常规的免疫方法制备单克隆抗体,虽然耗时长,但能在一定程度上增强免疫效果,制备出稳定性及特异性优良的单克隆抗体[8]。PDCoV N蛋白氨基酸组成保守性高,达到97.1%~100%[9-11],本实验制备针对PDCoV N蛋白的抗体对于病毒的早期诊断是切实有效的。本研究成功筛选到单克隆杂交瘤细胞株E8和A10,细胞连续传代,长势良好,抗体分泌能力稳定。间接免疫荧光试验证实单抗鉴别PDCoV、PEDV、TGEV 病毒感染细胞的特异性良好,为我们进一步的构建免疫胶体金检测方法提供了坚实基础[12-14]。
本研究制备的PDCoV胶体金检测试纸条敏感性及特异性良好,检测方法准确、可靠、有效,后续需用于临床粪便样品的检测评估,收集更为全面的临床数据,进一步完善胶体金试纸条检测方法。PDCoV临床症状复杂多变,免疫胶体金试纸条检测方法的建立从根本上解决检测时间长,过程繁琐等问题,具备快速确诊、低成本、高敏感性等多种优势[10-11,15]。本试验成功建立了PDCoV免疫胶体金试纸条检测方法,为临床猪血清PDCoV快速检测以及流行病学调查提供方便快捷检测方法奠定了基础。
