五倍子提取物有效成分含量分析与体外抑菌活性比较
2021-12-30李云超魏思敏田启明李金贵
李云超,魏思敏,田启明,赵 昕,李金贵*
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏省高校动物重要疫病与人畜共患病防控协同中心,江苏扬州 225009)
植物是许多现代药物发现和开发的重要来源。约25%的现代药物来源于植物,但仅有5~15%的植物被研究过其药用价值[1]。目前,天然植物、中草药或药用植物、功能性食品得到了广泛的研究,在糖尿病、免疫调节、抗炎和抗菌活性等方面获得了一些很有价值的治疗药物[2-4]。
在药用植物中,五倍子(Gallachinensis,GC)作为一种传统中药材已有上千年的使用历史,对腹泻、痢疾、败血症、炎症、龋病等多种疾病有防治作用,还有抗癌、抗生育、抗氧化等功效[5]。GC的水提取物(aqueous extract of GC, GCE)含有大量的单体和聚合多酚,如没食子酸单宁(Gallotannin, GT)、没食子酸(gallic acid, GA)和没食子酸甲酯(Methyl gallate, MG)以及一些碳水化合物、蛋白质和其他成分[6]。目前已经从GCE中鉴定了几种化合物的分子结构(图1)[7,8]。GT是一种水解单宁,被认为是GC的主要成分,其含量往往占五倍子干重的50%以上。GA又称五倍子酸,化学名为3,4,5-三羟基苯甲酸,是结构最简单的天然多酚类化合物;MG为GA的衍生物。三者均已被证明具有抗氧化、抗炎、抗微生物等生物学活性[9,10]。结构-活性关系研究表明,GT抗氧化活性随着没食子酰基数量的增加而增强,其中含6~7个没食子酰基的GT对伤寒沙门菌和蜡样芽孢杆菌的抗菌活性最好[11],且含量相对较高而被认为是GCE抗菌活性的关键物质。然而,少有研究对GT、GA和MG在GCE中的含量和抗菌作用进行比较。为此,本研究采用大孔树脂对GCE中GT进行分离,同时收集脱GT后的剩余物(GTrE),然后采用高效液相色谱法(HPLC)测定两者中GA和MG的含量,并比较各组分对临床分离耐药菌的抑制作用。
a. 五倍子单宁;b. 五倍子酸或没食子酸;c. 没食子酸甲酯图1 五倍子中已知分子结构的几种化合物
2 材料和方法
2.1 菌株 大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)临床分离株,由扬州大学动物医院畜禽门诊部王彦红博士赠予。标准菌株ATCC25922和ATCC29213为本实验室保存株。
2.2 试验药品 五倍子(Gallachinensis, GC),购自中国同仁堂药店(中国扬州)。试验用抗生素氨苄西林(AMP)、头孢噻肟(CTX)、头孢喹肟(CEF)、多西环素(DOX)、卡那霉素(KAN)、阿米卡星(AMK)、链霉素(STR),环丙沙星(CIP)、恩诺沙星(ENR)、新霉素(NEO)和黏杆菌素(COL)等购自上海吉智生化科技有限公司(中国上海),分别以无菌蒸馏水或培养基中制备成新鲜储备溶液。LB培养基购自Thermo ScientificTM。GT、GA和MG对照品购自北京索拉比奥科技有限公司。HPLC级和分析级溶剂购自上海阿拉丁生化科技有限公司。
2.3 五倍子提取物的制备 将GC粉碎成100目的粉末,称取5.0 g加入50 mL去离子水中煎煮2 h; 将水煎液通过Whatman 1号滤纸以去除颗粒物,滤液经旋转蒸发器减压浓缩,溶于无菌水中并调整浓度为0.5 g/mL,4 ℃保存备用[12]。
2.4 大孔树脂吸附法提取没食子酸单宁(GT)和脱单宁剩余物 将2.3节方法获取的水提物GCE装载在大孔树脂(XDA-6)柱上。XDA-6树脂分离GT的最佳工艺参数如下:1)吸附条件:吸附温度28 ℃、柱径高比1∶8,进料量2.0 bv,流速1.0 bv/h;2)解吸:洗脱溶剂为水溶液/乙醇(15∶85 v/v),洗脱液体积2.0 bv,流速1.0 bv/h[13]。将分离出来的GT和脱GT剩余溶液结晶物(GTrE)分别收集、干燥、称重后发现5 g GC粉末提取物中分离获得的GT和GTrE分别为2.915 g和1.14 g。然后称取适量并配制成相应浓度的溶液与GA和MG等一起用于抗菌活性评价。
2.5 高效液相色谱法检测GCE、GT和GTrE中GA和MG含量 所有标准品和试验样品均在日本岛津HPLC系统上检测,色谱柱为Inertsil ODS-3 C18(4.6 mm × 250 mm,5 μm),以甲醇(A)和0.5 % H3PO4水溶液(B)为流动相。HPLC程序见表1所示;上样体积为20 μL、柱温为35 ℃。对于GA,设定流速为1 mL/min,流动相A/B比例为15/85;对于MG,流速为0.5 mL/min,流动相A/B比例为40/60,两者的检测波长均为275 nm。
2.6 药敏试验和药物联合作用的棋盘试验 使用微量肉汤稀释法测定受试抗生素、GCE及其化学组分对上述两种临床分离菌株的MIC[14]。根据CLSI判定标准解释MIC结果,以标准菌株ATCC25922和ATCC29213作为试验质控菌。
根据所测得的GT和GTrE对每种菌株的MIC值,采用棋盘稀释法测定GT和GTrE的联合的分级抑菌浓度(fractional inhibitory concentration, FIC):即将GT和GTrE分别用钙离子调节的无菌MH 肉汤倍比稀释为2 MIC、1 MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC和1/32 MIC,各取50 μL分别排列在96孔板的行与列上,然后每孔加入100 μL处于对数生长期的测试菌液,使菌液浓度为5×105CFU/mL,同时以无菌MH 肉汤作为阴性对照,不含药物的稀释菌液作为阳性对照,然后在37 ℃下培养16~20 h读取结果,以无细菌生长的最低药物浓度为MIC。GT和GTrE之间的相互作用通过计算分数抑制浓度指数(FICI)来确定。结果判定标准如下:FICI≤ 0.5为协同作用;0.5
2.7 统计分析 试验数据以平均值±标准误(Mean±SE)表示,并采用PRISM(6.0版)软件进行差异显著分析,P<0.05时表示差异显著。
3 结果与分析
3.1 临床分离菌的耐药性测试结果 11种受试抗生素对E.coli和S.aureus临床分离株的MIC测试结果见表1。根据CLSI判定标准,这些菌株对11种抗生素表现出不同的耐药性。在受试菌株中,4株临床分离E.coli均对6种以上的抗生素表现出明显的耐药性;3株S.aureus则对受试的四种抗生素(STR、KAN、CIP、ENR)表现出耐药性。这说明分离菌株均为多药耐药菌株。

表1 不同抗生素对大肠杆菌和金黄色葡萄球菌临床分离株的MIC测定Tab 1 MICs of different antibiotics for clinical E. coli and S. aureus isolates.
3.2 GCE及其组分对E.coli和S.aureus的抑制作用比较 试验比较了大孔树脂分离的GCE、GTrE和商品化GT、GA和MG对两种临床分离菌的抑菌作用,MIC测试结果见表3。GCE对E.coli和S.aureus菌株的MIC分别为8和0.25 mg/mL,即E.coli不同菌株的MIC是对S.aureusMIC的32倍,说明GCE对S.aureus的抑制作用较强,有一定的选择性。商品化的GT与我们大孔树脂分离的GT对两种耐药菌的抑制作用类似,且与GCE类似,都对S.aureus有较强的抑制作用。纯品GA对E.coli的MIC与GCE接近,但对S.aureus的MIC则是GCE的20倍或40倍;MG也表现出类似的趋势,故GA和MG对S.aureus的抑制作用明显低于GCE、GT。GTrE对两种耐药菌的抑制作用略强于GCE。
以上数据均显示,GCE、GTrE、GT对S.aureus的抑制作用更强,而纯品GA和MG对E.coli和S.aureus的MIC相似,GA和MG对S.aureus的抑制作用均明显弱于GCE、GTrE、GT(表2)。
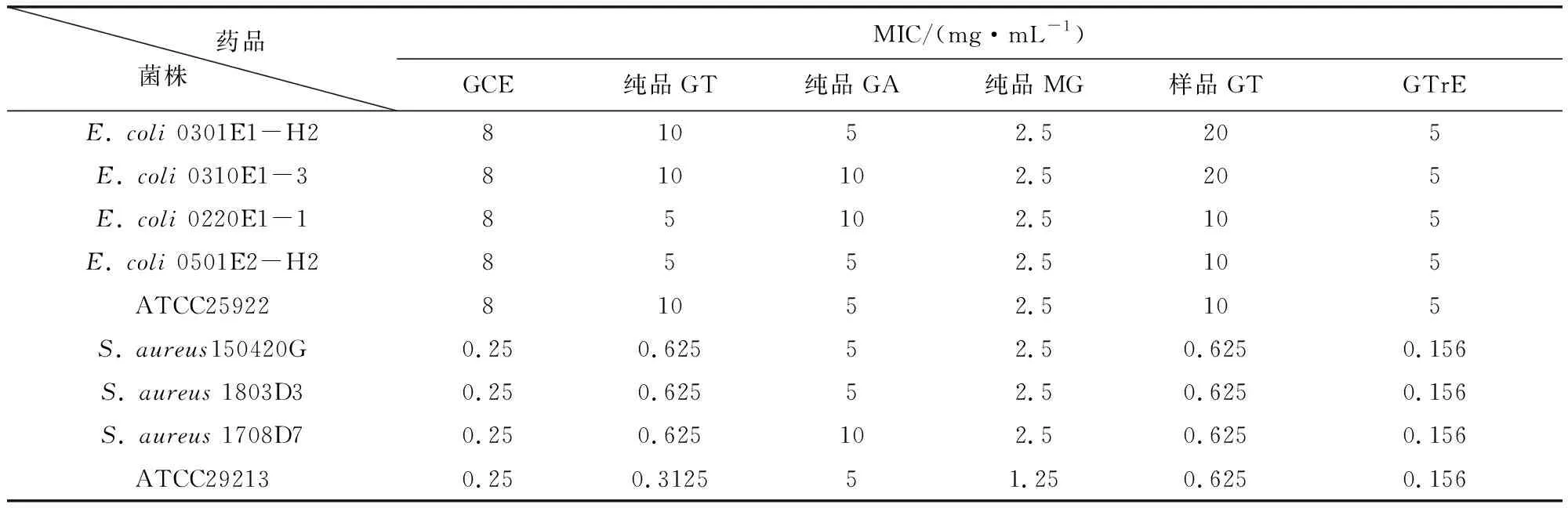
表2 GCE及其组分对大肠杆菌和金葡菌临床分离株的MICsTab 2 MICs of GCE and its components for clinical E. coli and S. aureus isolates.
3.3 大孔树脂分离GT与GTrE对两种临床分离菌的联合作用 上述试验已证明GT和GTrE对两种受试菌均具有明显的抑菌作用,但两者的联合效应还不清楚。本试验经过FICI测定发现,除了对E.coli中的两个分离株(E.coli0301E1-H2和E.coli0220E1-1)表现为无相互作用外,两者联合应用对其余菌株的抑制均显示出相加作用(表3)。
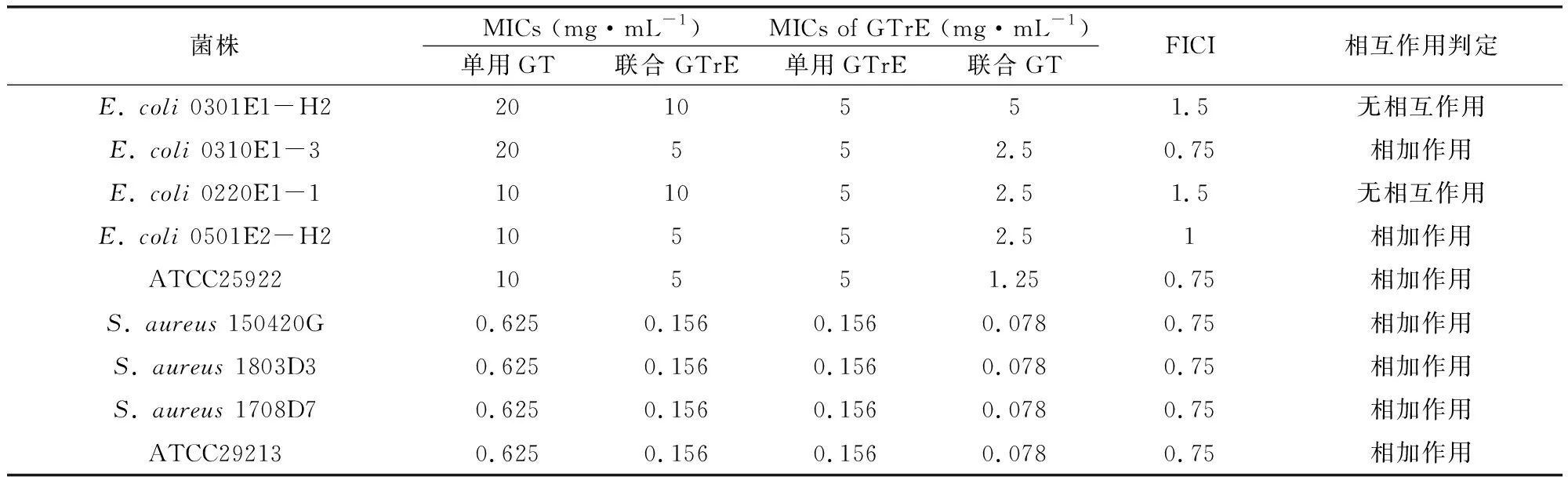
表3 分离GT和GTrE对临床分离株的分级抑菌浓度指数Tab 3 FICI of separated GT in combination with GTrE for clinical E. coli and S. aureus isolates.
3.4 GCE中GA和MG的HPLC定量测定 以浓度为X轴,峰面积为Y轴,绘制了GA和MG的标准曲线(图2),得到回归方程。两者标准曲线的相关系数均大于0.999,说明线性关系良好。
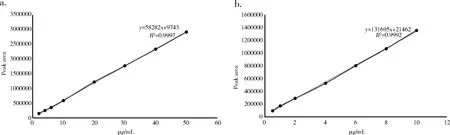
图2 GA(a)和MG(b)的标准曲线及回归方程Fig 2 Standard curve of GA (a) and MG (b), and their regression equation
GA和MG的线性范围分别为2~50 μg/mL和0.5~10 μg/mL(表4)。根据图2的回归方程和样品的峰面积计算不同提取物干燥样品中GA和MG的含量百分比(表4)。结合前面表2的结果可以发现GCE对不同分离株E.coli的MICs为8 mg/mL,然而,GA在GCE中的含量仅为3.1665%,这意味着GCE中GA的实际浓度为0.25 mg/mL;但纯品GA对E.coli的MICs为5~10 mg/mL,这是GCE中GA实际浓度的20倍以上。与之相似的是,纯品MG对受试菌株的MIC虽然略低于GA,但其在GCE中的含量更低,仅为0.0899%,实际浓度则为0.0072 mg/mL,纯品MG对E.coli的MIC为2.5 mg/mL,是GCE中MG实际浓度的340多倍。结合表2中的数据,纯品GA和MG对S.aureus的MIC均明显高于GCE、GT和GTrE。这提示GA和MG应该不是五倍子提取物抗菌活性的主要成分。
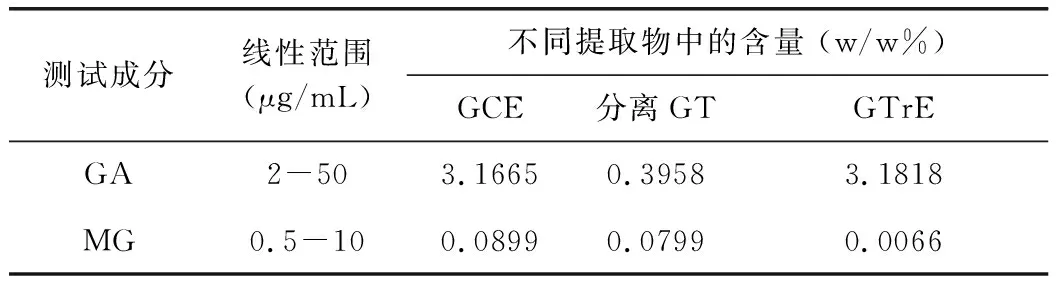
表4 GCE、分离GT和GTrE中GA和MG含量的测定Tab 4 Contents of GA and MG in GCE and its different extract.
4 讨论与结论
目前,多药耐药菌的传播速度比新药创制的速度快,引起了较为严重的公共卫生危机,从天然植物或中药中筛选具有抗菌活性的提取物及其组合来替代现有抗菌药已经成为一种现实且有益的探索。近年来的研究表明,五倍子(GC)或其提取物具有很强的抗病毒、抗癌、保肝、止泻和抗氧化活性[5],在抗菌方面证明对大肠杆菌和变形链球菌生物被膜的形成具有显著的抑制作用[16]。
尽管已有很多GC提取物抗菌活性的报道,但其活性成分的关联性还没有完全确定。对GC中有效成分结构与抗菌效应关系的初步研究表明,GC粗提物及其它成分具有显著的防龋效果,由于粗提物含有多种化合物,其生物活性是多种化合物协同作用和/或拮抗作用的结果,故目前仍不清楚其确切的抗菌机制[8]。研究发现GCE和GTrE对两种临床分离耐药菌均具有明显的抗菌活性,两者对临床分离菌株(E.coli和S.aureus)的MIC相似,但它们对E.coli的MIC是S.aureus的32倍,说明GC提取物对S.aureus抑制作用的选择性更强,因而有望用于防治S.aureus引起的感染。本研究使用大孔树脂获得的GT,干燥后称重发现可达到GC干重的58.3%,与商品GT对比研究发现,两者对E.coli和S.aureus具有相似的抑菌作用;脱单宁后剩余部分的干燥品,即GTrE,含量达到GC干重的22.8%,且其对两种受试菌的抑制作用略好于GT。故推测GT和GTrE很可能是GC发挥抗菌作用的有效成分。
此外,研究还测定了GCE中GA和MG的含量,并检测了其抑菌活性,发现它们对E.coli的MIC与GCE或GT接近,但对S.aureus的作用明显弱于GCE,分析两者在GCE、GTrE中的含量发现,两者在GCE和GTrE中含量有类似的规律,GA在GCE中的含量为3.16%左右,与报道的2~4%范围一致[17];而MG仅为0.0899%,比报道的含量略高[18],故总体上看,两者含量都比较低,在GCE中的浓度且远远低于其纯品的MICs(表4)。故可以推测GA和MG应该不是GC提取物中的主要抑菌活性成分。
综上所述,GCE与其中含量较高的GT对临床分离耐药大肠杆菌和金葡菌均有显著的抑制作用,但对金葡菌的抑制作用更强,有望成为控制该菌感染的候选药物;GA和MG虽具有抗菌活性,但在GCE中的含量很低,故可能不是主要的抗菌成分。除GT外,GC中还有未经鉴定的化合物或其组合具有类似强度的抑菌作用,还需要进一步研究。
