基于亚铁氧化率的铁硫混合腐蚀菌细胞固定化研究
2021-12-30赵丹刘坤晏磊
赵丹,刘坤,晏磊
(黑龙江八一农垦大学生命科学与技术学院,大庆 163319)
随着科技的不断进步,微型机械在生物医学、航空航天、国防航海等领域应用广泛,是构成微型机器人、微型工具、微型飞机等微型机械的基本单元[1]。机械加工可以用来在工件上添加、去除或塑造材料的形状。根据所使用的能量种类,用于去除材料的加工过程可以分为物理、化学和生物[2]。传统机械加工在加工微小零件时,容易产生变形、发热等问题,不能精确地控制其精度。生物加工是一种可控的微生物过程,通过金属去除或溶解在工件上选择性地形成微结构[3]。微生物活动不会产生太多热量或残余应力,利用微生物代谢过程中一些复杂的生化反应来去除待加工基体上的多余材料,将微生物作为微小的“刀具”加工出精细结构保证了精度,高质量,并避免扭曲或损坏工件[4]。氧化亚铁硫杆菌是一种化能自养菌,以还原态的硫及亚铁为能源,专性好氧,嗜酸性,广泛生活在金属硫化矿和煤矿的酸性矿坑水中。研究表明氧化亚铁硫杆菌可以对紫铜表面的微细图形进行选择加工,得到具有清晰齿轮轮廓结构的图形[4]。中国科学院和北京航空航天大学合作,制作出了微小齿轮和微小沟槽[5]。
然而微生物生长繁殖至衰亡期时,细菌的活性逐渐降低,还需要再次对其进行氧化培养,且菌液的批次更替造成大量微生物损失,降低了加工效率。固定化微生物在工业应用中具有效率高,耗能低,可多次利用的优点[6]。因此研究了通过固定化方法来增大细胞密度,使反应加速,实现连续化操作,以提高生物刻蚀速度。研究表明氧化亚铁硫杆菌(A.ferrooxidans)和氧化硫硫杆菌(A.thiooxidans)2种菌株混合组成的混合腐蚀菌,可在含Fe2+和硫代硫酸钠的双底物培养基中正常生长[7],且已验证铁硫混合腐蚀菌系在传代过程中组成和功能都较为稳定[8]。
常用的细胞固定化方法有包埋法、交联法、吸附法、自絮凝法、载体结合法[9]。其中吸附法微生物与载体结合能力弱,易受环境影响;自絮凝法生成机械强度差,大小不均匀;载体结合法反应条件剧烈,环境控制严苛[10]。包埋法在微生物固定化有条件温和,操作简单稳定性好的优点[11]。常用的载体材料有海藻酸钠、聚乙烯醇、聚丙烯酰胺、明胶、卡拉胶等[12]。海藻酸钠微球在多次利用后机械强度下降,有溶解现象[13];聚丙烯酰胺对生物有毒性;明胶生成微球有粘连现象[14],亚铁氧化率无法达到工业要求。混合腐蚀菌系双底物培养基为强酸性、高离子浓度,海藻酸钠、卡拉胶、明胶微球维持稳定性困难。聚乙烯醇有较好的机械强度和无毒性是一种良好的微生物包埋材料。在聚乙烯醇中加入少量海藻酸钠能抑制微球在交联剂中的粘连[15],运用硝酸钙代替传统的氯化钙作交联剂能提高氧化亚铁硫杆菌的生物活性[16]。优化和改进细胞固定化条件能够更好的发挥微生物的能力,响应面法是一种较好的实验优化的方法,因其具有实验次数少,实验精度高的特点而在生物实验中广泛应用[17]。实验前期探究了温度(20~40℃)、培养时间(0~72 h)、培养液pH(1.50~2.50)、装液量(10%~60%)、接种量(0~20%)、交联时间(45~75 min)、交联转速(80~160 rpm)、Ca(NO3)2浓度(1%~5%)等单因素条件的改变对亚铁氧化的影响,结果显示未优化之前固定化细胞的亚铁氧化率在51%~60%之间。在得到的单因素实验数据基础上,选出对亚铁氧化率影响最显著的三个因素,采用响应面Design-Expert v8.0.6软件中的Box-Behnken设计响应曲面模型,考察不同固定因素如交联时间、交联转速、钙离子浓度三个因素对亚铁氧化率的影响,优化出混合腐蚀菌的最佳固定化条件,以便改善生物刻蚀加工微小构件的质量。
1 材料和方法
1.1 材料
1.1.1 菌种
试验菌种为氧化亚铁硫杆菌(A.ferrooxidans ATCC 23270)和氧化硫硫杆菌(A.thiooxidans ATCC 19377)组成的混合腐蚀菌系。
1.1.2 仪器
电子天平(BT223S型,上海越平科学仪器有限公司);pH计(PHB-4型,上海仪电科学仪器股份有限公司);高压蒸汽灭菌锅(MLS-3781L型,松下健康医疗器械株式会社);空气浴摇床(HZQ-C型,哈尔滨市东联电子技术开发有限公司);高速冷冻离心机(2K15型,德国Sigma);扫描电子显微镜(JSM-7500F型,日本电子株式会社)。
1.1.3 试剂
聚乙烯醇(聚合度1 750+50)、FeSO4·7H2O、(NH4)2SO4购自辽宁泉瑞试剂有限公司;海藻酸钠、MgSO4·7H2O、Ca(NO3)2购自天津市大茂化学试剂厂;K2HPO4、K2Cr2O7采购自天津市永大化学试剂有限公司;KCl为天津市百世化工有限公司;Na2S2O3·5H2O购自天津市河东区红岩试剂厂;二苯胺磺酸钠购自天津市科密欧化学试剂有限公司,以上试剂均为分析纯。
1.1.4 培养基
0K培养基:3 g(NH4)2SO4,0.5 g K2HPO4,0.5 g Mg-SO4·7H2O,0.1 g KCl,0.01 g Ca(NO3)2,蒸馏水1 L,用硫酸调节至所需pH[18]。
双底物培养基:0K培养基中加入FeSO4·7H2O和Na2S2O3·5H2O,浓度分别达44.3 g·L-1和5 g·L-1。
1.2 方法
1.2.1 菌体的培养及收集
将混合腐蚀菌系以10%的接种量接种到双底物液体培养基中,30℃,100 rpm摇床培养,培养菌体生长至对数期,取滤液用直径50 mm 0.22 μm微孔滤膜过滤,弃掉滤液,将滤纸上的菌体用pH为2的H2SO4冲洗,菌体悬浮液2 000 rpm,5 min离心,收集上清液,弃去底部的铁矾沉淀物。将上清液在12 000 rpm转速下离心10 min,弃去上清液,用pH为2的H2SO4溶液悬浮沉淀,在12 000 rpm转速下离心10 min,弃去上清,用pH为2的H2SO4溶液悬浮沉淀,重复离心至菌体中的铁矾沉淀物完全去除,最后用pH为2的H2SO4溶液重新悬浮,制成菌悬液备用[19]。
1.2.2 混合菌系的细胞固定化
按质量比10∶1的比例,称取聚乙烯醇(PVA)和海藻酸钠(SA),混合后倒入适量蒸馏水中,PVA和SA含量为9.0%(W/V)和0.9%(W/V),95℃水浴加热2 h。使之完全溶解,密封后高压蒸汽灭菌。在常温条件下静止存放约24 h,加入已备好的混合菌系菌悬液,轻缓搅拌,尽量避免气泡产生,使之混合均匀。将此混合液倒入100格冷冻盒中,每个小格体积为1 cm3,存放于-20℃温度下12 h,取出放入4℃环境下解冻,去除多余水分,制成1 cm3的小块。按指定浓度Ca(NO3)2溶液、交联时间、交联转速交联,交联结束后保存于4℃备用。
1.2.3 细胞固定化条件的优化
利用Design expert.V8.0.6软件中Box-Behnken设计响应曲面模型,考察交联时间、交联转速、钙离子浓度三个因素,进行细胞固定化条件的优化,分别记为变量X1、X2、X3,每个因素取三个水平,以亚铁氧化率为响应值,记为Y。设计实验方案,响应面试验因素水平表见表1。

表1 响应面试验因素水平表Table 1 Response surface test factor level table
将按照实验设计条件制作好的固定化细胞微块,放入装有50 mL双底物培养基的锥形瓶中,在30℃,120 rpm摇床中培养72 h取样,取样1 mL。
1.2.4 分析方法
用重铬酸钾滴定法测定培养基中亚铁离子的浓度[20]。取200 μl样品,加入1 mL比例为1∶1的硫磷混酸,加入2滴0.2%二苯胺磺酸钠,用0.005 mol·L-1的重铬酸钾标准溶液滴定,由无色变为紫色为滴定终点,计算亚铁离子的氧化率。
1.2.5 固定化细胞扫描电镜样品制备方法
取固定化颗粒断面,放入2.5%戊二醛中固定过夜。然后0.1 mol·L-1磷酸缓冲液(pH 7.4)中用超声波清洗器振荡半分钟后,反复冲洗3次,每次15 min。再放入1%锇酸中暗处固定1 h。用0.1 mol·L-1磷酸缓冲液(pH 7.4)冲洗3次,每次15 min。用70%、80%、90%、100%乙醇逐级脱水,每次6 min,加入包埋剂固化置于烘箱中40℃和70℃各24 h,离子镀膜。采用JSM-7500F型扫描电镜(成像电压为5 kV,放大倍数10 000倍,工作距离为5.8 mm)表征固定化细胞表面形态结构,分析微生物的生长环境,以及交联过程的包埋块结构的变化。
2 结果与分析
2.1 固定化细胞微块制备
通过实验制作得到外形规范的固定化细胞微块,交联后机械强度、弹性较好,无粘连情况,能够在酸性培养基中培养72 h稳定存在。生长24 h后固定化细胞微块由乳白色变为黄色,培养基呈微微黄褐色,说明氧化亚铁硫杆菌在固定化细胞微块中生长情况较好。
2.2 响应面分析方案及结果
2.2.1 模型方程的建立及方差分析
通过实验得到各种固定化条件下的亚铁氧化率,结果见表2。利用Design expert软件对数据进行分析,得到回归方程为Y=76.16+3.05 A-0.80 B+2.00 C-2.75 AB+3.75 AC-2.30 BC-15.73 A2-10.53 B2-13.88 C2,表3显示了每个回归系数的显著性结果。结果显示此回归模型极其显著(P<0.000 1)。其中A、A2、B2、C2对Y值的影响极显著(P<0.000 1)。其他因素如C、AB、AC、BC也对Y值影响显著(P<0.05)。各因素对亚铁氧化率的影响因素大小是A>C>B,即钙离子浓度影响力最大,其次是交联转速,交联时间影响力最小。交互项AC、AB、BC显著,表明钙离子浓度与交联时间、钙离子浓度与交联转速、交联转速与交联时间都存在显著交互作用。方差分析结果显示模型的F值为266.05,说明模型是有效的。R2=99.71,R2adj=99.33表示模型的拟合度较好,CV值<10%,说明实验的可信度和精确度较好。Adeq Precision值大于4是可取的,说明实验模型可用于实验设计,各影响因素对亚铁氧化率的影响为非线性关系,适用于氧化亚铁硫杆菌固定化细胞对亚铁氧化率的预测。
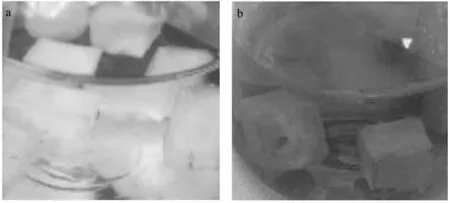
图1 不同培养时间固定化细胞微块生长情况(a,培养时间0 h;b,培养时间24 h)Fig.1 Growth of immobilized cells under different culture time(a,culture time 0 h;b,culture time 24 h)

表2 响应面分析实验设计及结果Table 2 Response surface analysis experimental design and response values

表3 亚铁氧化率回归模型方差分析Table 3 Variance analysis table of ferrous oxidation regression model

续表3亚铁氧化率回归模型方差分析Continue table 3 Variance analysis table of ferrous oxidation regression model
2.2.2 响应面分析
通过多元回归分析,得到图2三组响应面图形与等高线图。其中a、b分别代表交联转速不变下,交联时间和钙离子浓度的响应面图形和等高线图;c、d分别代表交联时间不变下,交联转速和钙离子浓度的响应面图形和等高线图;e、f分别代表钙离子浓度不变下,交联时间和交联转速的响应面图形和等高线图。等高线趋于椭圆形,表明两两之间相互作用显著,等高线趋于圆形则表明相互作用不显著。由响应面图a、c、e中可以看出,单方面增加钙离子浓度、交联时间和交联转速,亚铁氧化率都是先增加后减少。由等高线图b、d、f可以看出,三个因素两两之间相互作用显著。交联转速极大值出现在112~128 rpm,交联时间极大值出现在57~63 min;钙离子浓度极大值出现在2.5%~3.5%。通过分析得到细胞固定化最佳条件为钙离子浓度3%、搅拌转速120 rpm、交联时间为60 min,得到最大亚铁氧化率为77.3%。

图2 交联时间、钙离子浓度、交联转速对亚铁氧化率影响的三维图(a,c,e)和等高线图(b,d,f)Fig.2 Three-dimensional map(a,c,e)and contour map(b,d,f)of the effects of cross-linking time,the concentration of calcium ion,and cross-linking speed on the oxidation rate of ferrous iron

模型的充分性检查,确保它提供了响应和因子之间关系的最大近似,最小二乘法的残差是判断模型充分性的重要工具,由图3显示了残差和预测响应值,模型残余块是随机分布的,没有任何趋势。结果表明,随着二次模型的不断变化和充分性,对最大响应的预测是正确的。

图3 模型预测值与残差的残差图Fig.3 Residual plot of predicted value and residual
2.3 固定化细胞的SEM表征
固定化细胞的高效率和稳定性与其微观结构有很大的关系。图4分别为接菌种和未接菌种固定化细胞微块在交联0、25、75 min扫描电镜图片。图中可看出未接菌的固定化细胞微块表面光滑,接菌的固定化细胞小块存在小坑并形成了大小孔隙结构,随着交联时间的增加,孔隙生成的越多,生成的孔隙结构越好,该结构有利于混合菌系的代谢及其营养物质的运输扩散。

图4 培养前固定化细胞微块电镜表征图(a,c,e代表未接菌种固定化细胞微块交联0、25、75 min;b,d,f代表混合菌系固定化细胞微块交联0、25、75 min)Fig.4 Scanning electron microscope of immobilized cells before culture(a,c,e,cross-linking of immobilized cells of uninoculated bacteria at 0,25,75 min;b,d,f,cross-linking of immobilized cells of mixed corrosion bacteria at 0,25,75 min)
固定化细胞微块置于双底物培养基中培养活化后进行SEM表征,图5为活化后SEM表征图。结果显示,经培养活化后,固定化载体的微观空洞结构进一步改善,空隙更多,形成许多立体三维小孔,这些小孔为混合菌系的定殖、生长、代谢提供了良好的环境。这些空隙结构既被载体隔离,同时又通过沟壑结果进行连接,非常利于营养物质、氧、热的传送和运输。
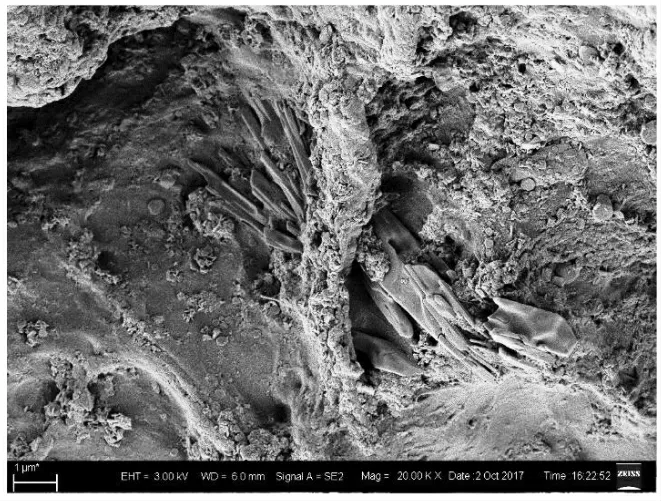
图5 活化培养后固定化细胞微块电镜表征图Fig.5 Scanning electron microscope of immobilized cells after activated culture

2.4 验证实验
为确定模型所得结果的准确性,在模型最优细胞固定化条件下进行三次重复实验,亚铁氧化率分别为76.45%、76.52%、76.42%,得到平均亚铁氧化率为76.43%±0.09%,统计学分析表明与预测亚铁氧化率76.45%无显著差异(P>0.05),表明实验模型精确度较高。
3 讨论
氧化亚铁硫杆菌具有将亚铁离子氧化成为铁离子的功能,由于拥有这等性质,氧化亚铁硫杆菌在生物脱硫、生物浸矿和处理电子垃圾方面广泛应用[18]。聚乙烯醇具有很多优点,机械强度好,传质性能好,耐生物分解性也好,固定也比较容易,而且成本较低。对细胞无毒、价廉易得,是目前国内外研究最为广泛的一种包埋固定化载体材料,且能够在酸性条件下存在。PVA-SA体系在生物细胞固定化有较好的机械强度,能保持较好的生物活性,是一种较为理想的细胞固定化材料[21]。PVA分子含有较多羟基,这些羟基随着时间的变化会自己凝聚在一起。因此在PVA-SA溶解后放置24 h以提高微块的性能。细胞固定化的条件对亚铁氧化率有多方面的影响,其中PVA浓度、SA浓度、钙离子浓度,交联搅拌转速为主要调控因素,已有研究表明氧化亚铁硫杆菌在9%PVA的浓度时固定化具有较好的生物活性[16]。过高的SA浓度会导致PVA、SA混合不充分,溶液粘度值增大。SA浓度过低则包埋微块不易成型[22]。实验在前期研究基础上选用PVA和SA含量分别为9.0%(W/V)和0.9%(W/V),采用响应面分析法以亚铁氧化率为响应值,考察钙离子浓度、交联转速和交联时间三个因素对氧化亚铁硫杆菌细胞功能的影响。结果表明,随着钙离子浓度、交联时间的增加,亚铁离子的氧化率是先增加后降低,说明适量增加钙离子和增加交联时间能更有利于菌体的生长,生成更适合混合菌系的生长环境。但钙离子浓度过高、交联时间过长,会导致生成的包埋体系吸收过多的钙离子,生成过量的海藻酸钙,增加钙离子在培养基中的脱落时间。不利于尽快生成较好的孔隙结构,不利于营养物质的传输,影响菌体的生长。实验最终得到钙离子浓度为3%;交联时间60 min;交联转速120 rpm的最佳细胞固定化条件。虽然研究对铁硫腐蚀菌的固定化条件进行了优化,得到了最佳的优化条件,固定化效率是否能真正达到理想化,是否适合经济适用还有待探究。
SEM分析显示随着交联时间的增加,固定化细胞微块孔隙结构越好,活化后生成较好的孔隙结构,是因为海藻酸钠在交联时与硝酸钙反应生成海藻酸钙凝胶,冷冻的过程中通过PVA分子间的自凝聚作用形成PVA凝胶[23]。双底物培养基的pH值为2,在酸性环境下海藻酸钙凝胶溶解,PVA凝胶因具有耐酸性而留下来,所以活化后固定化细胞微块有更好的微观孔隙结构,有较好的通透性,有利于菌体的生长。
4 结论
通过响应面实验得到腐蚀混合菌系的最佳细胞固定化条件为钙离子浓度3%、交联转速120 rpm、交联时间为60 min,得到最大亚铁氧化率为77.3%。SEM表征得到固定化细胞小块在活化后生成较好的孔隙交错的结构,形成许多三维立体小孔,有利于菌体的生长繁殖。
