利用高通量测序技术对水稻秸秆中、低温降解菌系的比较分析
2020-12-23班允赫李新宇王秀娟苏振成张惠文
班允赫, 李 旭, 李新宇, 王秀娟, 苏振成 , 张惠文
(中国科学院 沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁 沈阳 110164)
作为一种丰富的可再生木质纤维素生物质资源,全球每年产生约5.1×109吨的农业残留物[1-2],是目前仅次于煤炭、石油以及天然气的第四大能源[3]。但只有其中一小部分被用于堆肥、饲料或生物燃料生产,大部分被遗弃在田间或焚烧[4],造成极大的资源浪费和严重的环境污染。据不完全统计,我国每年农作物秸秆产量占世界总产量的28.1%[5],但秸秆利用方式单一、利用效率低、大面积烧荒等会带来突出的环境问题[6]。为此,2015年国家农业部明确了“一控、两减、三基本”政策目标,秸秆还田就此成为秸秆资源化利用的主要方式之一[7]。秸秆在自然环境下较难降解[8],所含木质纤维素生物转化过程受温度、湿度和土壤含水量等多种因素影响,特别是其化学成分(纤维素、半纤维素和木质素)在非共价键和共价键交联作用下紧密结合[9],因此木质纤维素水解是秸秆资源利用最重要的技术和经济限制。木质纤维素降解菌是农业生态系统中重要组成部分,是土壤有机质和养分循环的主要驱动力。在纤维素生物质资源化利用中,获得高效纤维素降解菌种尤为重要。在自然界中,木质纤维素的完全降解是真菌、细菌及相应微生物群落共同作用的结果。真菌在木质纤维素降解过程中起着主导作用,在陆地生态系统中的大多数真菌分布在壶菌门(Ascomycota)和担子菌门(Basidiomycota)中,其中许多真菌,如曲霉属(Aspergillus)、毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)、腐霉属(Pythium)、青霉菌属(Penicillium)和木霉菌属(Trichoderma)均是传统的木质纤维素降解酶的生产者,具有好氧降解纤维素的能力。在纤维素降解真菌中,白腐真菌和褐腐真菌被认为是木质纤维素材料最普遍和最有效的分解者。然而,木质纤维素的顽固性以及真菌产酶量不足仍然限制了真菌在木质纤维素降解过程中的应用。特别是在水田系统中,因为绝大多数真菌为好氧微生物,在厌氧或兼性厌氧条件下,真菌不能进行正常的生命代谢活动,因此真菌在稻田土壤环境中的应用受到了较大限制。除真菌外,细菌因其多功能性和功能多样性而被大力研发,并作为在未来应用领域中良好的战略资源。与真菌相比,细菌能利用的碳源种类较为复杂,在木质纤维素分解过程中能更快的增殖和代谢,酶产量更高。同时,细菌还具有对温度、pH值和盐度等环境因素较强的耐受能力,可以代谢产生在中性或碱性范围内具有木质纤维素降解活性的酶。细菌代谢产生的木质纤维素降解酶的复杂性更高,这种复合酶系更适合复杂、连续的木质纤维素降解生物转化过程。此外,与真菌相比,利用分子技术构建细菌产酶的表达系统的方法更多样、技术难度更小。从自然生境中富集驯化,是一种获得纤维素降解菌种资源的重要方式。在自然条件下,秸秆的有效生物转化很大程度上取决于多种微生物群落协同作用,而非单一菌株[10]。纯培养的纤维素降解菌易受环境或生物因素影响,在实际应用中效果并不理想。为此秸秆降解菌系的概念被提出,并逐渐成为研究热点之一[11-13]。秸秆降解菌系中包含环境中多种微生物,具有抗胁迫能力强、协同作用好等优点。但是,正由于所含微生物种类丰富,在降解菌系的富集驯化过程中,细菌多样性易受微生物源、可用底物、pH、氧化还原电位以及温度等因素影响[14-15],从而引起降解菌系群落多样性发生改变[16-18]。例如,温度是秸秆降解的重要影响因素,决定了微生物演替中的各种生物过程[19],在低温胁迫下,嗜中温纤维素降解微生物的代谢受到强烈影响,而嗜冷纤维素降解微生物能够较好生长,发挥降解作用。目前,国内外主要集中在中、高温秸秆降解菌的研究和开发,而对纤维素低温降解的研究相对较少[20]。但是,北方地区特别是黑、吉、辽三省是我国水稻、玉米等粮食作物的重要产区之一,每年有大量作物秸秆遗留田间。由于秋冬季气温低,时间长,导致作物秸秆降解十分缓慢,甚至不能完全降解,对土壤、次年整地和播种都会产生不利影响。目前,秸秆降解菌的研究主要集中在中高温或者常温条件下,这些菌株不适合在北方地区条件下应用,且由于低温纤维素降解菌不易筛得,因此有关的研究鲜有报道[21-23]。因此,研发低温条件下高效快速分解作物秸秆菌剂是推进北方地区秸秆还田的重要措施。此外,由于秸秆降解菌系结构复杂,很难通过传统培养方法分析复杂的微生物菌系,其中关键微生物往往会被遗漏掉[24]。将高通量测序技术应用于木质纤维素降解菌系的检测,使得复杂微生物菌系组成得到了表征[25-27]。本研究采用高通量测序技术,分析了5对(10个)不同来源秸秆降解菌系在中、低温条件下富集驯化后的细菌群落结构特征,探讨温度变化对秸秆降解菌系群落结构的影响,为构建高效稳定的秸秆降解菌系提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 2016年11月,在东北三省采集水稻秸秆样本52个;2017年1月,在长江中下游地区采集水稻秸秆样本48个。将每个秸秆样本置于无菌塑料袋中密封后,在低温、避光条件下送至实验室。
1.1.2 培养基 筛选培养基:K2HPO41.0 g,NaNO31.0 g,FeSO4·7H2O 0.01 g,丙酮酸钠0.3 g,蛋白胨0.5 g,(NH4)2SO41.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,酵母浸出粉0.5 g,可溶性淀粉0.5 g,D-山梨醇0.5 g,蒸馏水1 000 mL,添加SL10微量元素液和钙溶液终浓度均为0.1%。SL10微量元素液:ZnSO4·7H2O 1.5 g,CoCl2·6H2O 0.15 g,Na2MoO4·2H2O 0.1 g,MnSO4·H2O 1.5 g,CuSO4·5H2O 0.15 g,H3BO30.3 g,NiCl2·6H2O 0.06 g,KI 0.06 g,蒸馏水1 000 mL。钙溶液:3% CaCl2溶液。在250 mL三角瓶中加入100 mL筛选培养基,再加入2条1 cm×5 cm的新华滤纸作为指示物,灭菌后备用。
1.2 方法
1.2.1 降解菌系的富集及驯化 无菌条件下,将秸秆样本剪成5 cm小段,浸没于灭菌筛选培养基中,25 ℃静置培养若干天,待滤纸条完全崩解后,将5%菌悬液(体积分数)转移至新的培养基中,在相同条件下培养。继代15次后,得到5个均能在15 d内完全降解滤纸条的菌系。在继代培养的同时,将这5个降解菌系进行低温驯化,即在每次传代后,培养温度降低1 ℃,经过15次继代培养后,得到5个低温降解菌系,在10 ℃条件下能于20 d内将滤纸条完全崩解。所得的降解菌系对应秸秆样品信息,如表1所示。
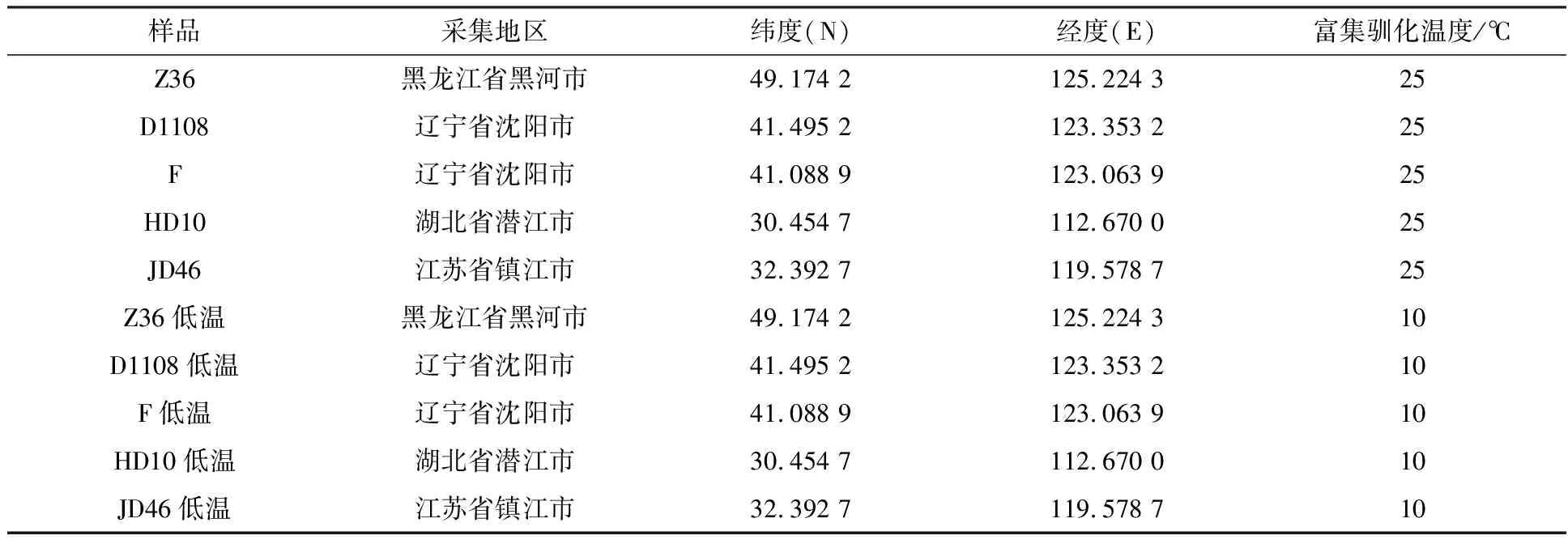
表1 样品采集及富集驯化信息表
1.2.2 DNA提取、PCR扩增及Miseq测序 采用Fast DNATMSpin Kit for Soil土壤DNA提取试剂盒(Cat.No.116560-200; Mpbio Company, USA)提取降解菌系全基因组DNA,方法如下:取2 mL降解菌系发酵液至无菌离心管中,在4 ℃,12 000 r/min条件下离心5 min,弃去上清液,所得沉淀用于降解菌系全基因组的提取。分别利用1%琼脂糖凝胶电泳(agarose gel electrophorsis, AGE)和NanoDrop 2000微量分光光度计(Thermo Scientific, USA)检验提取所得降解菌系全基因组DNA的质量、浓度和纯度。所得DNA样品-20 ℃保存备用。以上述DNA为模板,用引物[28]515F Modified(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R Modified(5′-GGACTACNVGGGTWT-CTAAT-3′),采用聚合酶链式反应(polymerase chain reaction)对降解菌系16S rRNA的V3~V4区进行特异性扩增。反应体系如下:在20 μL反应体系中,加入10 ng DNA模板,2.5 mmol/L dNTP,前、后引物各0.4 μL,4 μL PCR缓冲液以及0.4 μL FastPfu 聚合酶。DNA扩增条件[29]:94 ℃预变性3 min,94 ℃变性45 s,50 ℃退火60 s,72 ℃延伸90 s,共35个循环,最后72 ℃延伸10 min,4 ℃保温。分别利用1%琼脂糖凝胶电泳(agarose gel electrophorsis, AGE)和NanoDrop 2000微量分光光度计(Thermo Scientific, USA)检验PCR产物的质量、浓度和纯度后,将样品送至上海美吉生物医药科技有限公司(Majorbio Bio-Pharm Technology Co., Ltd, Shanghai, China),利用Illumina Miseq(Illumina Miseq PE250, USA)对扩增子进行高通量测序。
1.2.3 高通量测序及生物信息学分析 使用Usearch软件平台(vsesion 7.0 http://drive5.com/usearch/)对优化序列提取非重复序列,降低分析中间过程冗余计算量,去除没有重复的单序列,按照97%相似性对非重复序列(不含单序列)进行OTU(Operational taxonomic unit)聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。采用RDP classifier(version2.2 http://sourceforge.net/projects/rdp-classifier/)贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。将序列与Silva基因数据库(Release128 http://www.arb-silva.de)进行比对,设置置信阈值0.7,对每个样品的16S rRNA基因序列进行分类分析。
1.2.4 生态学及统计学分析 利用Mothur (version v.1.30.1 http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)软件计算样品的α多样性指数,其中包括群落丰富度指数(ACE、 Chao1、 Sobs)和群落多样性指数(Shannon, Simpson)。利用各样本在不同测序深度时的微生物α多样性指数构建稀释曲线(Rarefaction curve),反映各样本在不同测序数量时的微生物多样性。利用Venn图统计中、低温秸秆降解菌系样本中所共有和独有物种及其数目,并分析其组成相似性及重叠情况。通过群落Bar图分析各个样本在不同分类学水平上的微生物种类、相对丰度,并对样本在各分类水平上群落组成的相似和差异程度进行量化分析。
1.2.5 降解菌系对秸秆降解效率测定 供试秸秆于2018年10月采集于中国科学院沈阳应用生态研究所辽宁沈阳农业生态系统国家野外科学观测站,水稻品种为美锋9号。水稻收获后,采集其地上部分,粉碎成2~3 cm长的小段。供试水稻秸秆基本化学组成见表2。准确称取3.00 g供试秸秆,置于装有筛选培养基的250 mL三角瓶中,每个三角瓶装样量为100 mL。用封口膜密封后,121 ℃高温灭菌20 min,冷却备用。将降解菌系菌悬液以5%(体积分数)接种至三角瓶中,中、低温降解菌系分别于25 ℃和10 ℃条件下培养,分别在4和8周测其降解率,每个处理设置3次重复。
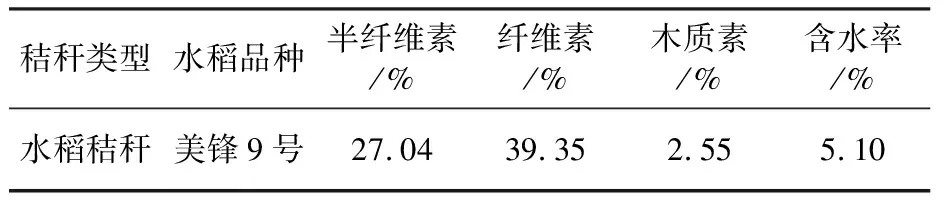
表2 水稻秸秆基本化学组成
2 结果与分析
2.1 中、低温秸秆降解菌系的α多样性分析
对10个中、低温秸秆降解菌系样本16S rDNA的V3~V4区进行高通量测序,经质量控制并去除嵌合体后,获得601 489条高质量序列,平均长度为273 bp。测序群落覆盖指数达0.999以上(表3),说明结果可以反映所测样本细菌群落组成的真实情况。
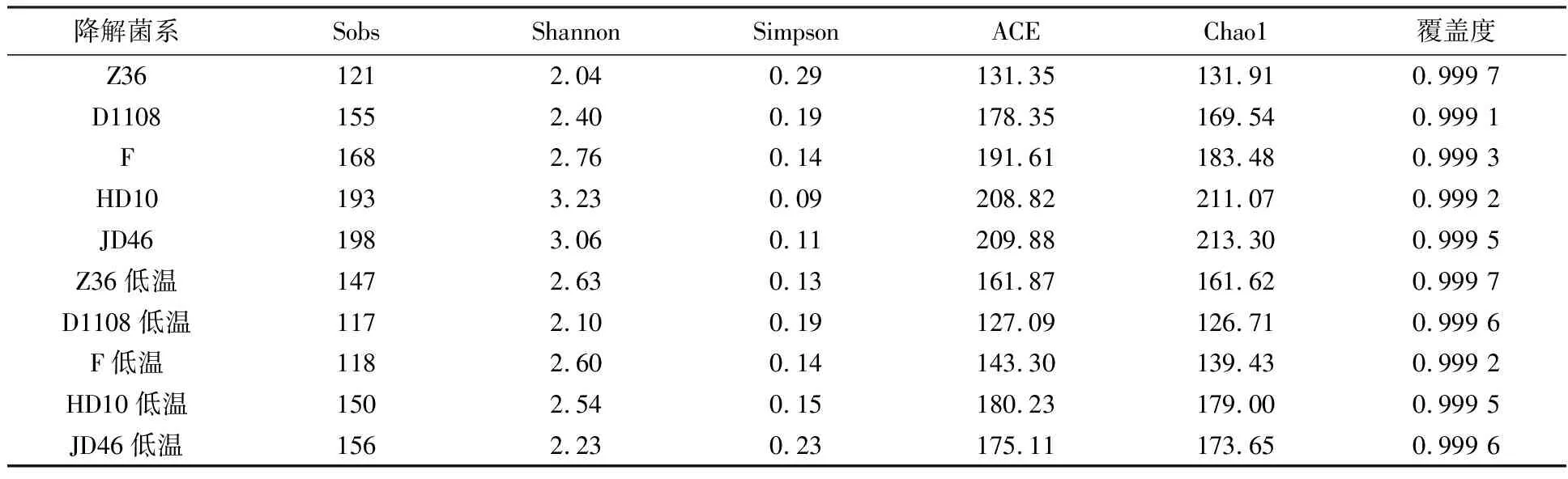
表3 中、低温秸秆降解菌系的α多样性指数表
根据所有样本最小序列抽平,以97%的序列相似性对OTU进行聚类分析,基于OTU数和相对丰度计算不同秸秆降解菌系Shannon指数在2.04~3.23之间(表3)。其中,中温菌系HD10最高,中温菌系Z36最低,各菌系OTU稀释性曲线均趋平(图1)。
α多样性指数是用于表征某个指定区域或特殊生境中的物种多样性,通常用Shannon指数和Simpson指数来评价微生物物种的多样性。Shannon指数值越高,物种多样性越丰富,Simpson指数值越高,物种多样性越少。通过计算α多样性指数,发现中温秸秆降解菌系多样性指数显著高于低温秸秆降解菌系(P<0.05,下同),但对菌系Z36而言,低温菌系多样性高于中温菌系。
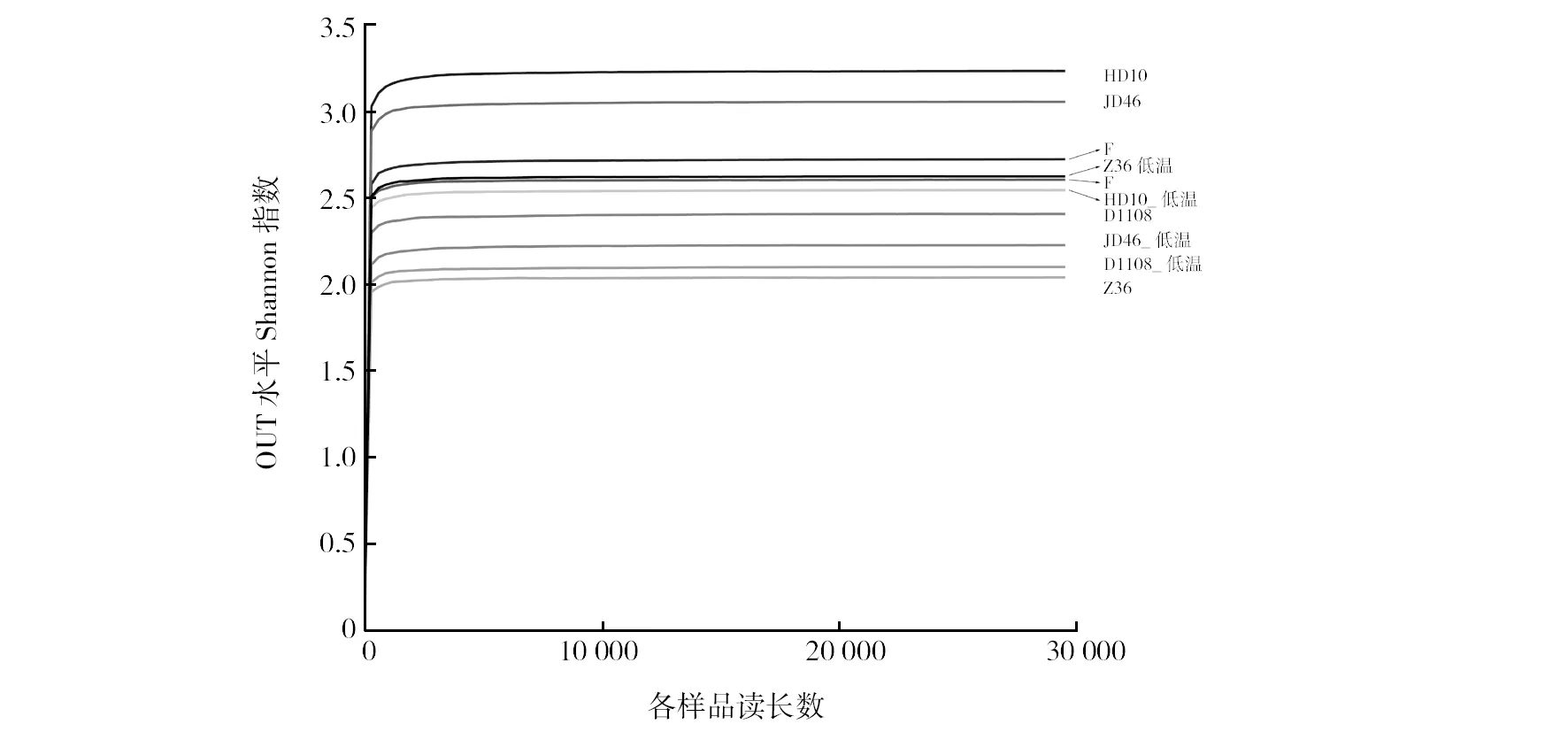
图1 中、低温秸秆降解菌系OTU水平Shannon指数稀释曲线Fig.1 Rarefaction curves of OTU level of medium-and low-temperature straw-decomposing microbial consortia measured by Shannon index
2.2 中、低温秸秆降解菌系群落组成分析
对测得的基因序列进行分类,发现5对秸秆降解菌系中所含细菌共可分为18个门、28个纲、55个目、97个科、188个属、238个种、333个OTU。其中,中温菌系有18个门、27个纲、51个目、92个科、172个属、220个种、302个OTU;低温菌系有16个门、25个纲、50个目、87个科、169个属、208个种、280个OTU。
如图2a所示,中温菌系特有属为19个,低温菌系特有属为16个,其共有属为153个。共有属(图2b)中弓形杆菌属(Arcobacter)相对丰度为34.18%,屠场杆菌属(Macellibacteroides)、拟杆菌属(Bacteroides)、假单胞菌属(Pseudomonas)和丛毛单胞属(Comamonas)相对丰度分别为9.22%、9.04%、5.26%和4.58%。中温菌系特有属(图2c)中Izimaplasmatales属的相对丰度为25.23%、类香菌属(Myroides)相对丰度为20.39%,Phycisphaerae属、瘤胃球菌属(Ruminococcus)和Proteocatella属的相对丰度分别为9.21%、7.40%和7.25%。低温菌系特有属(图2d)中梭菌属(Clostridium)的相对丰度为12.24%,丰佑菌属(Opitutus)、脱硫芽胞弯曲菌属(Desulfosporosinus)、肠杆菌属(Enterobacteriaceae)和Marinilabiliaceae的相对丰度分别为9.33%、7.58%、7.58%和5.25%。
5对秸秆降解菌系中5个优势菌门(图3a)为Epsilonbacteraeota、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Fimicutes)和纤维杆菌门(Fibrobacteres)。其中Epsilonbacteraeota的丰度最高,占每个样本16S rRNA序列总数的24.69%~52.35%。其次是拟杆菌门,占每个样本16S rRNA序列总数的21.97%~40.89%。在属水平上,10个秸秆降解菌系包括188个属(图3b)。其中,中温菌系172个属,低温菌系169个属。中、低温降解菌系最高的5个优势菌属按丰度降序排列,见表4。
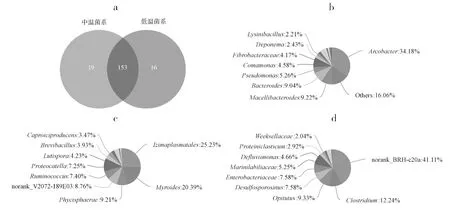
图2 中、低温秸秆降解菌系物种Venn图(a)及其共有属(b)、特有属(c)、(d)相对丰度Fig.2 Unique and shared present in two group microbial consortia. (a) Venn diagram showing the unique and shared genus from medium-and low-temperature straw-degrading microbial consortia. (b) Shared genus and their abundance distribution of the medium-and low-temperature microbial consortia. Medium-and low-temperature only genus and their abundance in (c) and (d), respectively
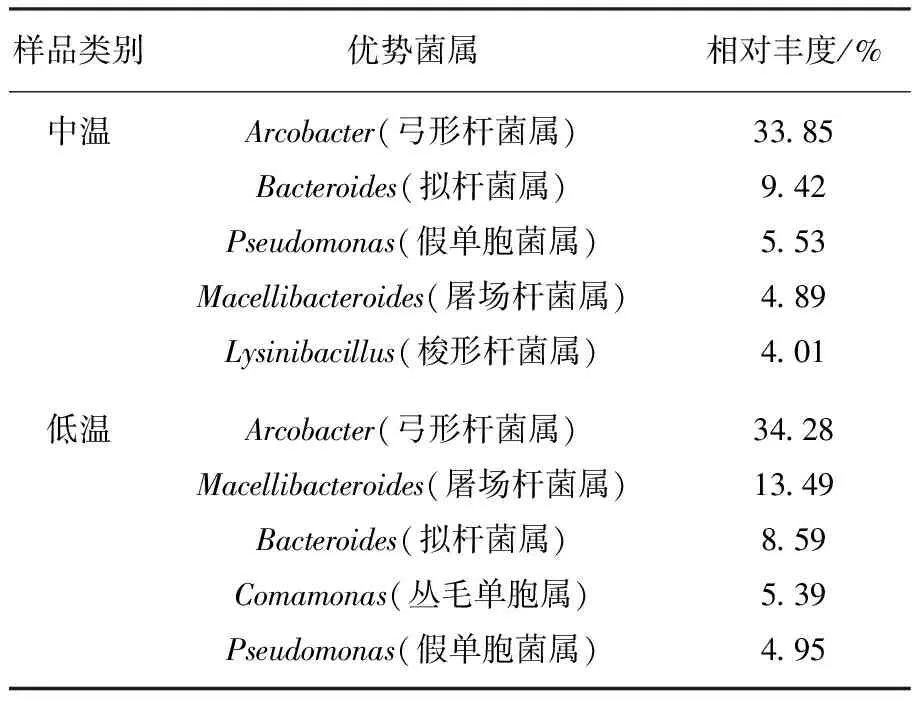
表4 中、低温秸秆降解菌系优势菌属及相对丰度
中温降解菌系中5个优势菌属分别为弓形杆菌属、拟杆菌属、屠场杆菌属、假单胞菌属和梭形杆菌属(Lysinibacillus);低温降解菌系中5个优势菌属分别为弓形杆菌属、屠场杆菌属、拟杆菌属、丛毛单胞属和假单胞菌属。在属水平上,已知有纤维素降解功能的纤维杆菌属(Fibrobacter)分别只占中、低温秸秆降解菌系相对丰度的1.56%和2.40%。
中、低温秸秆降解菌系优势菌门的相对丰度没有显著差异(图4a),但在属水平上,低温菌系中屠场杆菌属的相对丰度显著高于中温菌系(图4b)。另一方面,虽然经中、低温富集驯化后,5对秸秆降解菌系在整体水平上只有屠场杆菌属的相对丰度有显著性差异,但对样本中相对丰度排序前20的菌属进行分析发现,其相对丰度差异均呈显著或极显著(图5,P<0.01,下同)。结果说明,在个体水平上,温度是影响菌系组成极为重要的因素。
2.3 中、低温降解菌系对秸秆降解效率比较
在分析群落组成的同时,测定了中、低温降解菌系对水稻秸秆的降解效率,结果如图6所示。
与对照组相比,中、低温降解菌系均能在试验第1和第2个月显著提高秸秆的降解率。第1个月(图6a),除菌系Z36外,各中温菌系对秸秆的降解效率均显著高于低温菌系。中温菌系F对秸秆的降解效率达到34.29%,为所有菌系最高,且显著高于菌系D1108和菌系Z36。各低温菌系对秸秆的降解率为20.33%~23.20%,差异不显著。第2个月(图6b),中温菌系F对秸秆的降解效率为64.24%,显著高于菌系HD10。各低温菌系对秸秆的降解率为37.95%~43.67%,无显著差异。
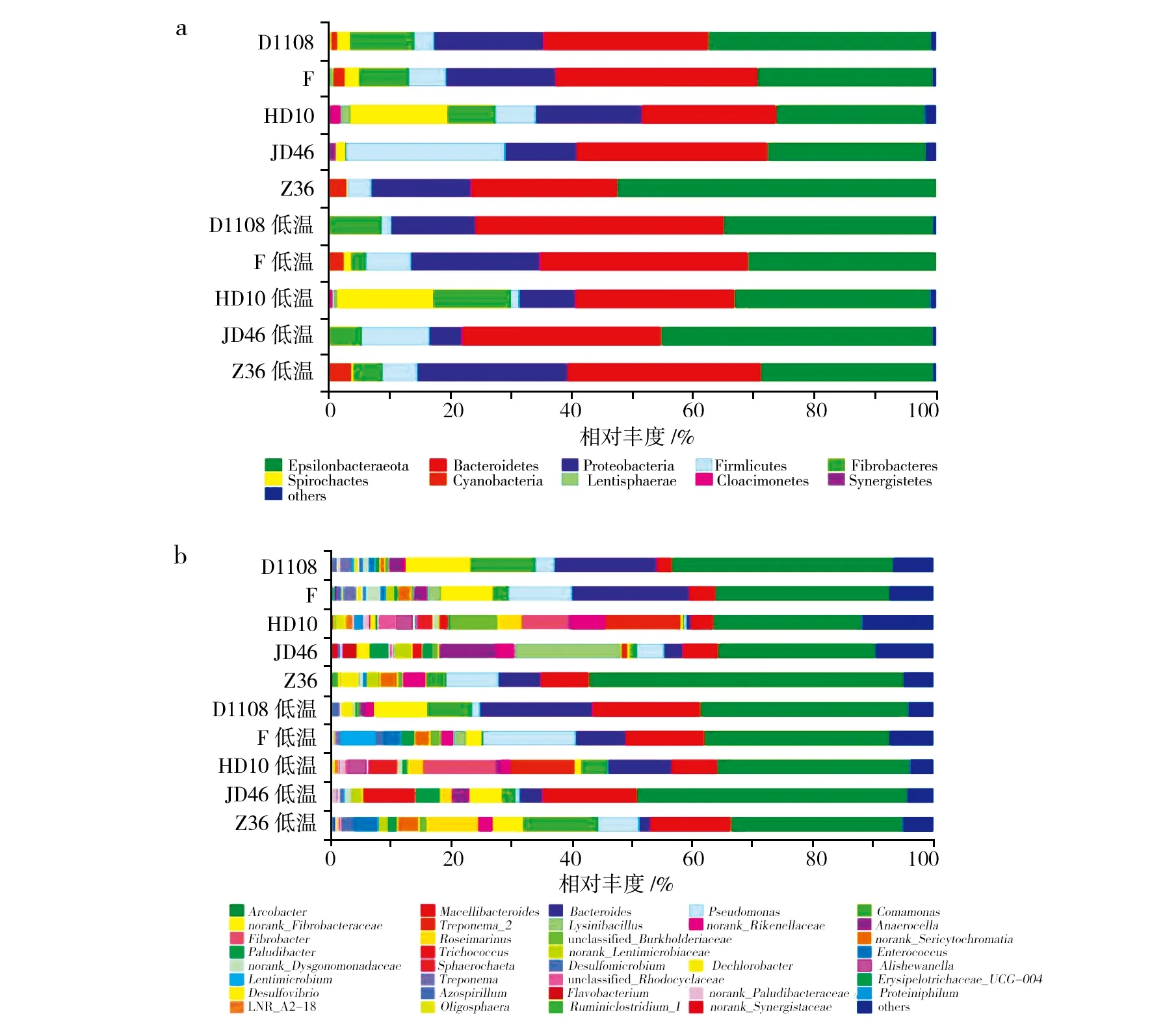
图3 中、低温秸秆降解菌系在门(a)、属(b)水平相对丰度Fig.3 The relative abundance of medium-and low-temperature straw-decomposing microbial consortia in phylum(a) and genus(b) 相对丰度不足1%的门或属合并为“其他”Less than 1% abundance of the phylum or genus was merged into others
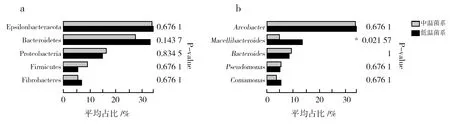
图4 中、低温秸秆降解菌系微生物群落相对丰度在优势菌门(a)、属(b)的统计学比较Fig.4 Statistical comparison of the relative abundance of medium-and low-temperature straw-decomposing microbial consortia in the dominant phylum(a) and genus(b) *相关系数在P<0.05时显著 *P<0.05 was considered statistically significant
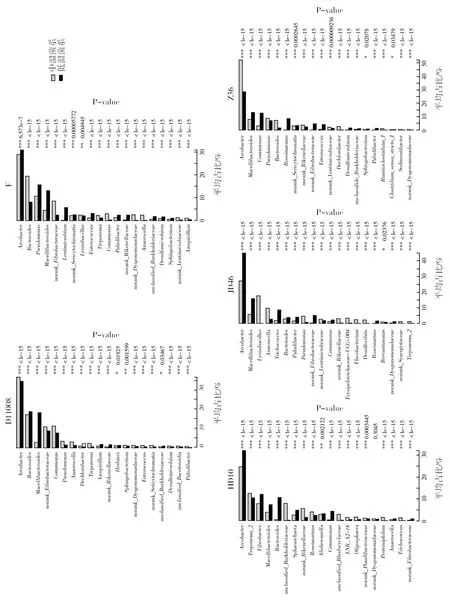
图5 中、低温秸秆降解菌系微生物群落相对丰度在属水平上的统计学比较Fig.5 Statistical comparison of the relative abundance of medium-and low-temperature straw-decomposing microbial consortia in genus level *相关系数在P<0.05时显著;**相关系数在P<0.01时显著;***相关系数在P<0.001时显著,下图同*The correlations are significant at P<0.05, **The correlations are significant at P<0.01,***The correlations are significant at P<0.001,same the figure
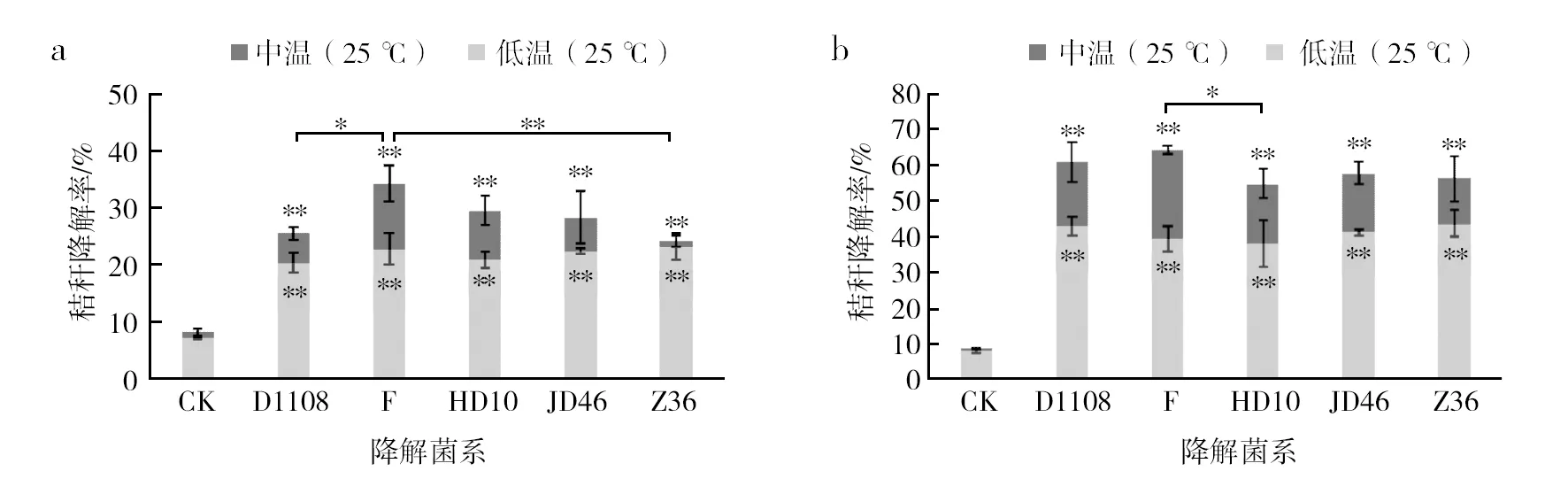
图6 中、低温秸秆降解菌系在第1(a)、第2(b)个月对秸秆降解效率的比较Fig.6 Comparison of the straw degradation rates of medium-and low-temperature straw-decomposing mircobial (consortia in the first(a) and the second(b) month)
3 讨 论
目前,针对秸秆降解菌所进行的研究多是共生性菌系,其功能与群落组成密切相关[30]。菌系培养温度往往会影响菌群的结构、活性及菌群中某些微生物的数量[31-32]。因此,温度是影响微生物菌系群落多样性的重要因素[32-35]。本研究对比了中、低温降解菌系群落多样性、群落结构和相对丰度,其结果表明温度对降解菌系组成有显著影响,当温度变化时,微生物群落结构也会产生较大变化。
通过计算α多样性指数,发现中温秸秆降解菌系多样性指数显著高于低温秸秆降解菌系,但菌系Z36例外,其低温菌系群落多样性高于中温菌系。这可能与其采样地点相关,菌系Z36采自黑龙江省黑河市讷河,纬度高、冬季气温低、冻土期较长,菌系Z36中耐冷、嗜冷微生物种类较多,在低温条件下表现出较高的群落多样性。
经国内外多年研究发现,已知具有纤维素分解功能细菌主要分布在厚壁菌门、变形菌门和拟杆菌门[36]。在厚壁菌门中,备受关注的纤维素降解菌分布在梭菌纲(Clostridia)和芽胞杆菌纲(Bacilli)。梭菌属中大量菌种(株)具有分解木质纤维素能力,通常是建立复合菌系的关键菌[37],其中C.thermocellum是最早分离,且纤维素分解能力较强的一类梭菌[38]。芽胞杆菌属(Bacillus)和类芽胞杆菌属(Paenibacillus)是芽胞杆菌纲中具有大量纤维素降解菌的两个属,已广泛应用于工业产酶,其具有较高的热稳定性和广泛的pH适应性[39]。在变形菌门中,假单胞菌属在自然界中普遍存在,该菌属中的P.mendocina具有较强纤维素分解能力[40]。在拟杆菌门中,噬细胞菌属(Cytophaga)是土壤中普遍存在的一种好氧属,哈氏噬纤维菌(C.hutchinsonii)能利用滤纸作为唯一碳源生长,具有降解结晶纤维素的能力[41]。此外,噬几丁质菌属(Chitinophaga)也是拟杆菌门中的重要菌属,C.pinensis具有降解植物甘露聚糖的能力[42]。在本研究富集驯化所得降解菌系中,除了已知具有纤维素降解功能的纤维杆菌属外,也包含上述部分菌属,但是否为文献中已报道的菌种(株),未可知。
在秸秆降解菌系的研究过程中,建立复合菌系所用菌株一般为具有纤维素降解能力的功能菌,以及具有辅助代谢功能的辅助菌。某些辅助菌,如丛毛单胞菌属,假单胞菌属中的部分菌种(株),虽然不具有纤维素降解能力,但能以降解菌分解纤维素所得产物及其次级代谢产物为底物进行代谢,降低降解菌的反馈调节,加快代谢产物消耗,从而起到“减毒”和“增效”的作用,这些辅助菌在秸秆降解菌系的构建中十分关键。
一种高效稳定的降解菌系在降解秸秆过程中,其关键菌种(株)的数量比例是呈规律性变化的[43],菌种(株)之间复杂的协同关系使菌系结构保持相对的稳定[44],但在限制性培养过程中,菌群结构却一直处于动态变化。在此过程中,可以通过改变菌系的培养条件,使其菌群结构向需要的方向发生改变,这也是一种获得纤维素降解菌系的重要方法。已有的研究报告中显示,低温秸秆降解菌系大多是通过采集长期处于高海拔、低温地区的环境样本,经低温筛选所得。但是,该种方法所用的样本因环境条件限制而不易采集,且低温富集周期普遍较长,所以采用该种方法获得低温秸秆降解菌系较为困难。相反,若先筛选获得中温秸秆降解菌系,而后在继代培养的同时,逐步降低培养温度,使其在保持纤维素降解能力的同时,逐渐适应低温环境。如此,经温度梯度驯化来获得低温降解菌系,也不失为一种行之有效的方法。
