借助信息技术对用氯化钙鉴别碳酸钠与碳酸氢钠再探索
2021-12-29游宏王杨薇子昌洪娟


能否用CaCl溶液鉴别NaCO和NaHCO溶液一度存在争议。实验证实,在常量范围内可以用CaCl溶液鉴别等浓度的NaCO和NaHCO溶液。鉴别NaCO和NaHCO固体或溶液有若干方法:观察固体外观;利用相同条件下NaCO和NaHCO固体在水中的溶解能力不同来鉴别;根据相同条件下NaCO和NaHCO溶液的碱性强弱判断;观察相同条件下NaCO和NaHCO与等浓度稀盐酸反应时的实验现象等。在常量浓度范围(大于1%)内能否用CaCl溶液鉴别NaCO与NaHCO溶液众说纷纭[1]。认为不能鉴别的理由是两者反应均有沉淀,这一观点在一段时间内曾成为主导[2][3]。之后的研究表明,可以通过向NaCO与NaHCO溶液中滴加CaCl产生的现象差异加以鉴别[4][5][6]。在此研究基础上,为了在常量范围内更直观、更简洁地用CaCl溶液鉴别NaCO和NaHCO溶液,笔者对这两个反应进行了实验探究,进一步对浓度进行了优化选择,并用于中学课堂教学。
借助手持技术等信息化技术可证实并确定此实验教学的简明有效路径:对于较低浓度的溶液,通过对比观察沉淀量可以鉴别;对于较高浓度的溶液还可通过对比观察有无气泡来定性鉴别。笔者设计了实验方案,准备了如下实验仪器与试剂:试管、容量瓶(100 mL、500 mL、1 000 mL)、1000 μL移液枪、移液管、胶头滴管、温度计、分析天平、威尼尔CO传感器、烧杯、蒸馏水、NaCO(AR)、NaHCO(AR)、CaCl(AR)。
一、实验方法及步骤
(一)配制溶液
用分析天平、移液管及容量瓶准确配制4种不同浓度(0.10 mol/L、0.20 mol/L、0.50 mol/L、1.00 mol/L)的CaCl、NaCO及NaHCO溶液。
(二)实验
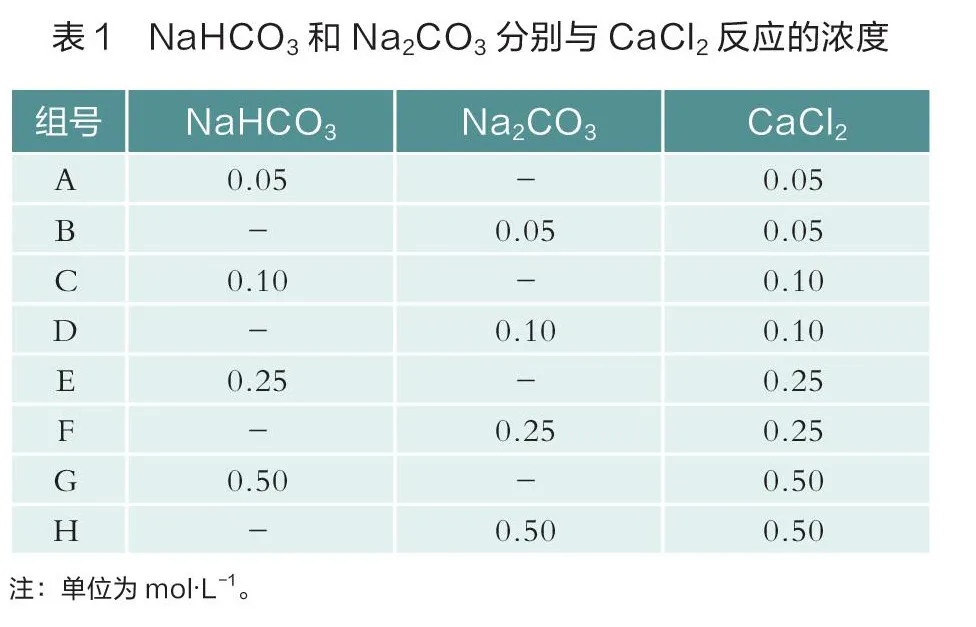
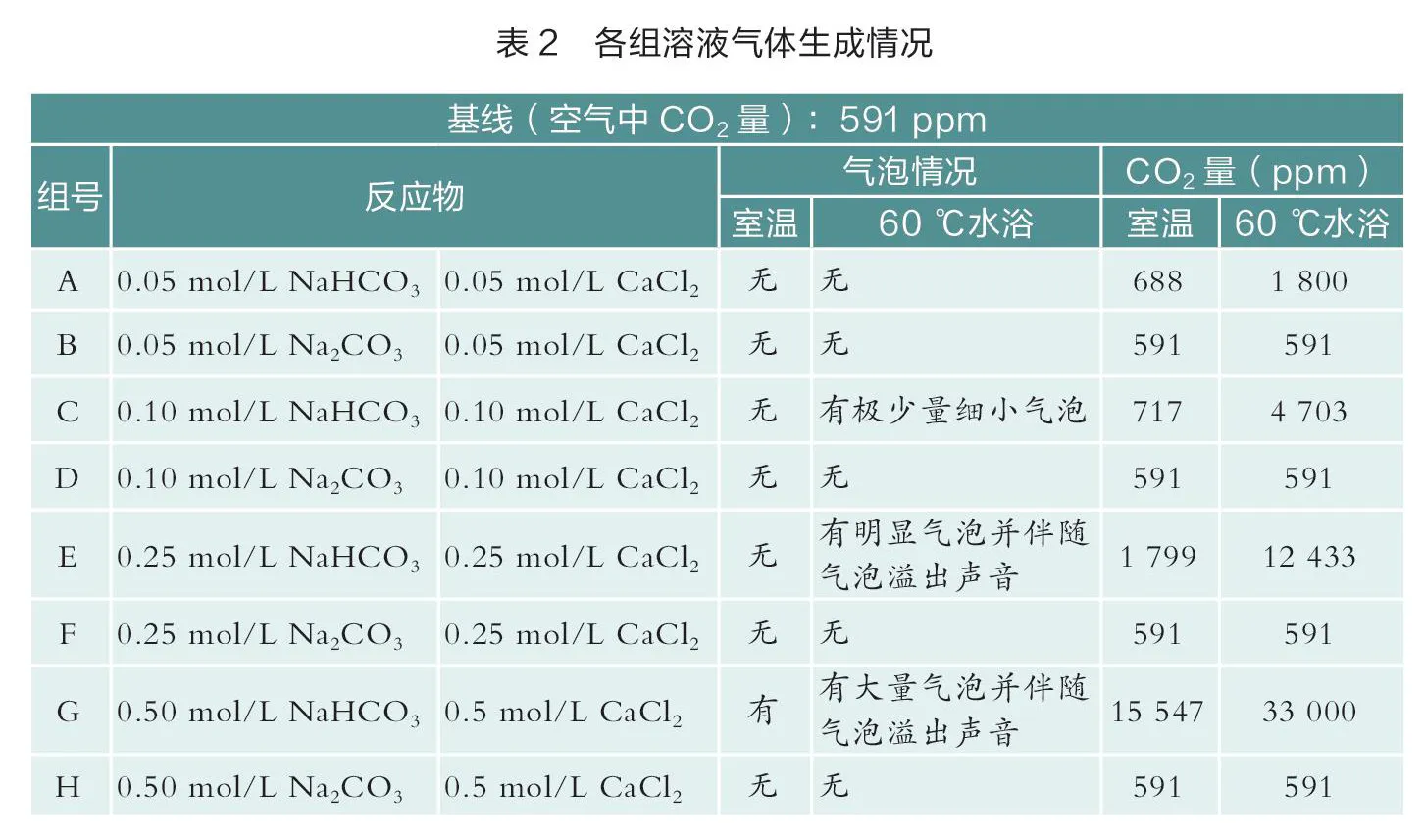
用移液枪移取上述4种浓度的NaCO和NaHCO溶液1 mL放入试管中,并分别取相应浓度的CaCl溶液1 mL加入其中,混合后实际浓度见表1,充分反应2 min后,观察沉淀量大小及有无气泡生成,随后立即用碳传感器测量试管中生成CO的量。
二、实验现象及结果
(一)沉淀
充分反应后,出现沉淀(如图1),用肉眼能粗略观察到,沉淀量A
(二)气体
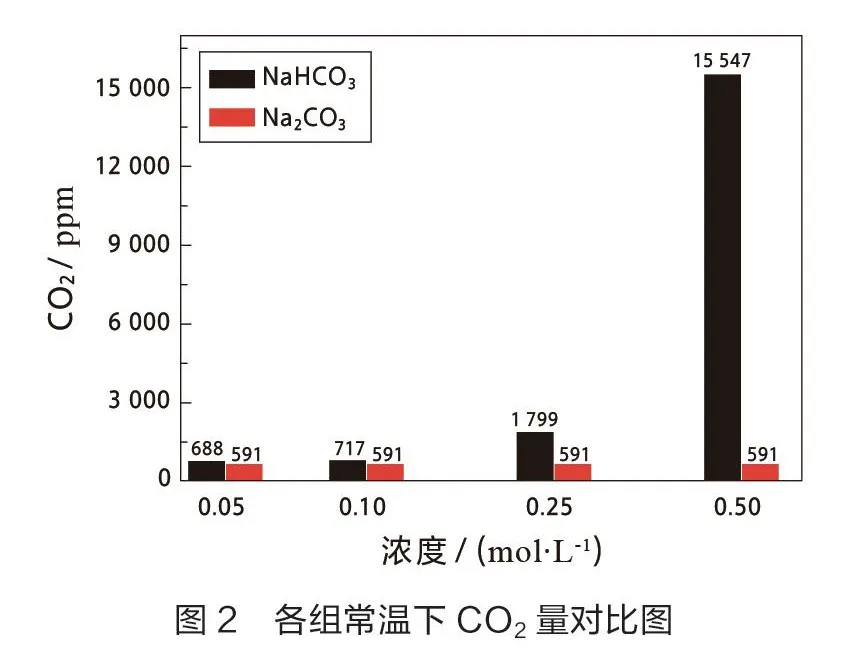
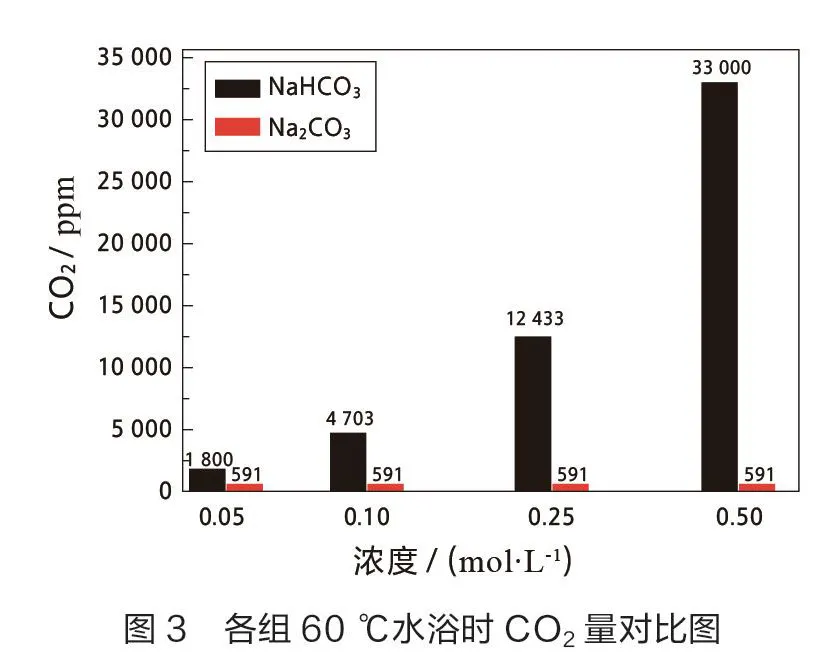
对反应后CO的生成进行观察,用传感器检测,其结果如下(见表2,如图2和图3)。
由表2及图2中数据可知,此实验条件下,NaCO溶液与CaCl溶液在任何浓度下反应均不生成CO,而NaHCO溶液与CaCl溶液反应均可生成CO。在低浓度时,NaHCO溶液与CaCl溶液反应生成的气体不易观察,高浓度时,生成气泡明显。在高浓度下用CaCl溶液鉴别等浓度的NaCO和NaHCO溶液是可行的。
三、理论分析
对于向NaCO和NaHCO溶液中分别加入CaCl溶液时均会出现沉淀的现象,前人已有大量实验证实并进行了理论解释[7]。笔者不再赘述,主要探讨为何反应中有CO气体生成,以及等浓度的NaCO和NaHCO溶液分别与相应浓度CaCl溶液反应,后者的沉淀量明显少于前者的原因。下面以此实验涉及的最小浓度0.1 mol/L进行计算。
(一) 0.1 mol/L NaHCO溶液中微粒浓度(混合前)
在NaHCO溶液中存在以下3个平衡[8]:
① HCO-+HO=HCO+OH- =/a
② HCO-+HO=CO2-+HO+ =a
③ HO++OH-=2HO =1/
其中, (NaHCO)=0.1 mol/L,查表知a= 4.5×10-7,a=4.7×10-11,则溶液中H+浓度: (H+)= aa=4.6×10-9,pH=8.34。设NaHCO溶液中 (HCO-)= mol/L, (CO2-)= mol/L, (HCO)= mol/L,根据溶液中的平衡得到3个方程:
+ + = 0.1
联立3个方程解得 (HCO-)=9.8×10-2 mol/L,(CO2-)=9.8×10-4 mol/L, (HCO)= 9.8×10-4 mol/L。
在水溶液中,1个离子可以同时参与多个平衡,浓度皆相同,所以式①+式②+式③得:
④2HCO-=CO2-+HCO = =a/a
(二)混合溶液中微粒浓度
将0.1 mol/L CaCl溶液加入到0.1 mol/L NaHCO溶液中,存在平衡①②③及平衡⑤。
⑤ Ca2++CO2-=CaCO =1/
溶液中的总反应为⑥,⑥=④+⑤。
⑥ Ca2++2HCO-=CaCO+HCO =
∴反应⑥的反应商
[查表知=3.36×10-9][8]
反应⑥的平衡常数:
<
∴反应⑥正向进行,因此生成CaCO沉淀和HCO的量增多,进一步释放CO气体。
综上所述,0.1 mol/L NaCO和0.1 mol/LNaHCO溶液分别与0.1 mol/L CaCl溶液等体积混合,后者因一有部分NaHCO在与CaCl反应生成沉淀的同时也生成了HCO,随之释放CO气体,根据碳元素的质量守恒可推知,NaHCO与CaCl反应生成沉淀的量明显少于NaCO。
笔者将此法在教学中进行了应用,取得预期效果。笔者引导学生对“能否使用CaCl溶液鉴别NaCO和NaHCO溶液”进行探究,不仅帮助了学生进一步掌握CaCl、NaCO和NaHCO的性质,而且全面整合了研究物质性质的基本方法和一般思路。利用手持技术精准放大了实验现象,实现了科学可视化,完成了科学研究从显性沉淀(CaCO)到隐性气体(CO)的角度转变。信息技术的科学应用也让学生获得宝贵的探究体验。
参考文献
[1] 钟汝永.碳酸钠和碳酸氢钠的溶液能否用氯化钙溶液鉴别[J].教学仪器与实验,2014(10):45-46.
[2] 吴名胜,诸全头.碳酸氢钠与氯化钙溶液真的不反应吗[J].化学教育,2008(2):65-66.
[3] 李大塘,施国军.教育创新下培养学生的创新精神——以对氯化钙鉴别碳酸钠和碳酸氢钠方法的再分析为例[J].教育现代化,2018(36):48-50.
[4] 肖中荣,陈进前.让学生理解碳酸氢钠和氯化钙能反应[J].中学化学教学参考,2015(Z1):46-48.
[5] 符吉霞,丁伟.运用手持技术探究用氯化钙鉴别碳酸钠和碳酸氢钠溶液[J].中学化学教学参考,2019(13):60-62.
[6] 杨飞,马宏佳.用氯化钙或氯化钡鉴别碳酸钠与碳酸氢钠溶液的再认识[J].化学教育,2014(11):82-84.
[7] 王冬.对氯化钙鉴别碳酸钠和碳酸氢钠方法的再认识[J].化学教与学,2016(2):38.
[8] 华彤文,王颖霞,卞江,陈景祖.普通化学原理(第四版)[M]. 北京:北京大学出版社,2013:166-167.
(作者游宏系北京市第九中学教师;王杨薇子系北京市第九中学教师;昌洪娟系北京市第九中学教师)
责任编辑:祝元志
