利用手持技术促进学生证据推理素养发展
2021-12-29谢立平





一、手持技术的应用有助于发展学生证据推理素养
证据推理是一种高阶思维能力,是学生必须掌握的思维方法,尤其是化学学科。《普通高中化学课程标准(2017年版2020 年修订)》对证据推理阐释为:具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系;知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系[1]。证据推理的起点是证据,终点是结论,推理是达到目的的合理方式。证据包括图像、图表、数据、文本信息和已有经验(知识、原理和规律)。获取证据最为有效途径是实验。
化学实验在化学教学中占有十分重要的地位。物质性质及转化的认识、化学概念的形成、科学理论的理解都依赖于实验获得的感性知识。这些化学内容大多可以设计成实验用于教学。任何实验皆包含两个要素:可操作的实验对象和可观测的实验变量。实验变量包括浓度、温度、压强、热量等。用传统方法操作化学实验,观察实验变量,经常遇到以下问题:一是实验过程中,不同学生对气体出现、颜色或浑浊度等变化的敏感程度不同,导致获得的实验证据出现偏差,得出的图表数据可靠性不足;二是学生通常可以观察到比较明显的宏观现象,但过程中变量是实时变化的,用肉眼无法观察[2]。手持技术的使用很好地解决了这个问题。手持技术具有定量化和可视化的特点,传感器等相关仪器支持不同变量的观测,如温度传感器、pH传感器、压力传感器、电导率传感器、色度传感器,还有用于观测特定物质的专用装备,如二氧化碳传感器、二氧化硫传感器、氧气传感器等。这些传感器在化学实验中广泛使用为师生取得可靠、理性、过程化的实验证据提供了保障。
二、手持技术与化学实验融合的探索
(一)手持技术的有效选择
传感器种类繁多,在实验过程中如何选择有效传感器是首要问题。教师需要依据教学内容、实验原理合理选择。有的实验现象明显,观测误差不大,或者实验过快或过慢、干扰因素过多等都无法发挥手持技术的优势。如何研究化学反应速率的影响因素?可操作的化学实验很多,但支持学生观察的并不多。例如,NaOH与HCl的中和反应、铁钉的锈蚀,学生就难以观察化学反应速率的快慢。
人教版必修第二册教材之所以选择使用HO分解、盐酸与大理石反应,且在实验活动中选择NaSO与HSO反应作为化学反应速率的研究对象,正是由于反应本身具有对反应条件的要求较低、反应速率适中、现象比较容易观察、干扰因素较少等特点。如何选择传感器?需要对化学反应本身进行深入分析。
2HO=2HO+O↑反应过程中,物质变化为O生成和HO减少,能量变化为温度升高。其中,可观测的实验变量是单位时间内观察气泡产生的多少和温度的升高。常规观察气泡时受人为因素影响,尤其差异不大的时候,误差较大。此外,不同人对温度的敏感程度不同。依据反应特点,教师可以选用氧气传感器和温度传感器测量数据。
NaSO+HSO=NaSO + SO↑+S↓+ HO反应过程中,物质的变化有SO2-和H+的减少,生成SO和S,其中,S是以浑浊物的状态出现。能量的变化并不明显。由于相同时间内溶液浑浊的观察也不易准确,依据反应特点,教师可以选择pH传感器、SO传感器和色度计测量数据。
(二)手持技术的有效使用
依据反应特点选择传感器,并不意味一定可以得到有效的证据。实验者需要分析如何利用传感器得到有效的数据。
HO分解反应过程中放热较多,据实验测算,0.6%HO溶液(以MnO为催化剂)20 s时温度可由24.5 ℃上升到48.6 ℃。若以此反应来探究浓度对化学反应速率的影响,由于同时有温度与浓度的变化,得到的证据无法有效用于推理。探究浓度对化学反应速率影响时,选用氧气传感器比温度传感器得到的数据更具有说服力。
NaSO与HSO反应过程中有SO生成,从理论上讲可以使用SO传感器进行测定,但由于SO具有溶解性,如照此实验几乎看不到有气体冒出,也得不到有效数据。随着反应的进行,HSO中(H+)减小。理论上讲可以用pH传感器测量反应过程中(H+)的变化,但因反应有SO溶在水中,有H+电离出来,故(H+)变化不唯一,得到的数据也不是有效的。选用色度计做实验得到的结果更准确。
(三)手持技术实验结果的有效推理
其一,应用氧气传感器探究催化剂对2HO=2HO+O↑反应的影响,实验操作及结果如下(见表1)。
将数据采集器与3个氧气传感器相连,并与电脑连接,开启DISLab 8.0软件。利用单机生成“组合曲线”,添加3条“氧气的百分含量—时间”曲线。取编号为1、2、3的3只500 mL的三颈烧瓶(一口连接气球,另一口连接装有3 mL 5%HO溶液的5 mL注射器),不加或加入催化剂,连接氧气传感器后同时注入3 mL 5%HO溶液,观察体系中氧气浓度的变化情况。待氧气的浓度不再变化,停止采集数据,保存曲线图像。
图1中蓝线为没有加入催化剂时体系中氧气浓度随着时间的变化曲线,红线为加入少量MnO固体作催化剂时体系中氧气的浓度随着时间的变化曲线,绿线为加入3滴饱和氯化铁溶液作催化剂后体系中氧气的浓度随着时间的变化曲线。由图1可以看出,实验2中曲线最早出现拐点且曲线的斜率最大,实验3曲线次之,实验1中曲线几乎没有变化。
对比上述实验证据可进行如下推理:在其他条件相同时,使用催化剂可以改变HO分解的反应速率。MnO固体和氯化铁溶液均对HO溶液分解有催化作用且催化效率不同。
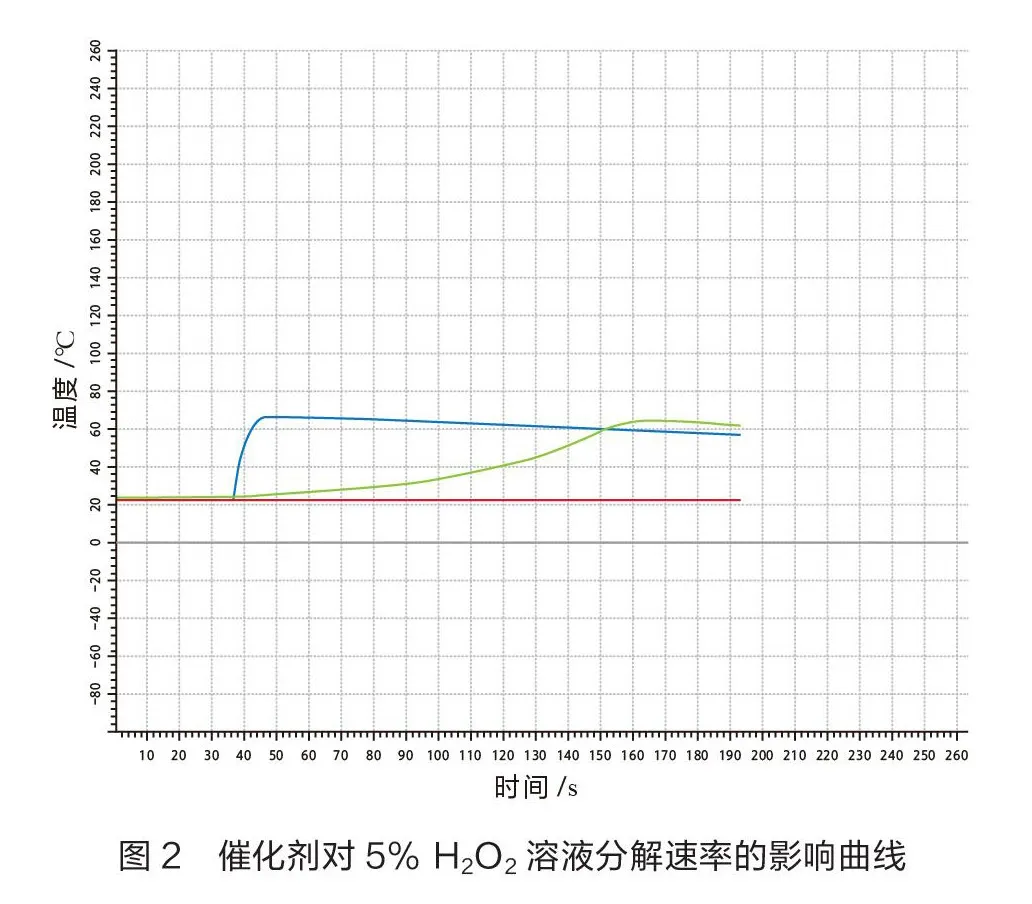
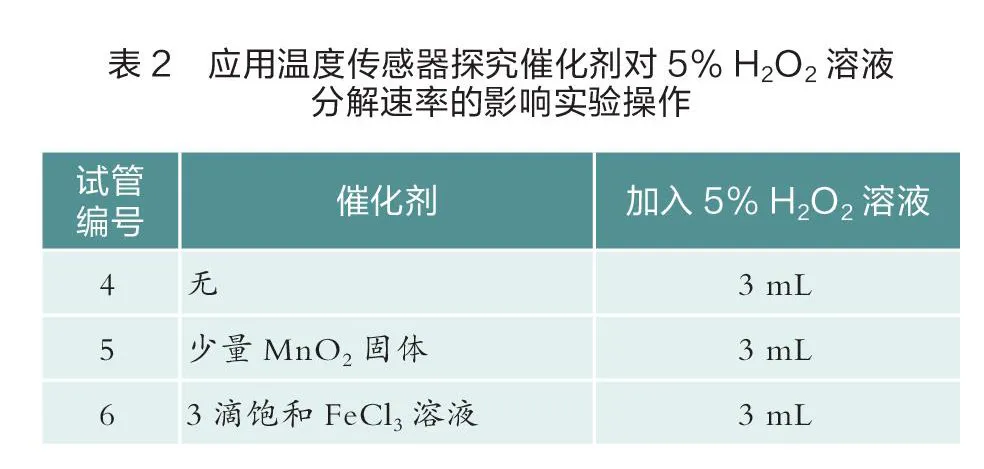
其二,应用温度传感器探究催化剂对 HO溶液分解速率的影响,实验操作如下(见表2)。
图2中红线为没有加入催化剂时溶液温度随着时间的变化曲线,蓝线为加入少量MnO固体作催化剂时溶液温度随着时间的变化曲线,绿线为加入3滴饱和氯化铁溶液作催化剂时溶液温度随着时间的变化曲线。由图2可以看出,实验5中曲线最早出现拐点且曲线的斜率最大,实验6曲线次之,实验4中曲线几乎没有变化。对比实验4、5和实验4、6可知:在其他条件相同时,使用催化剂可以改变HO分解的反应速率。MnO固体和氯化铁溶液均对HO溶液分解有催化作用且效率不同。
无论是使用氧气传感器还是温度传感器,探究催化剂对化学反应速率的影响时,最终得出的结论是一致的。
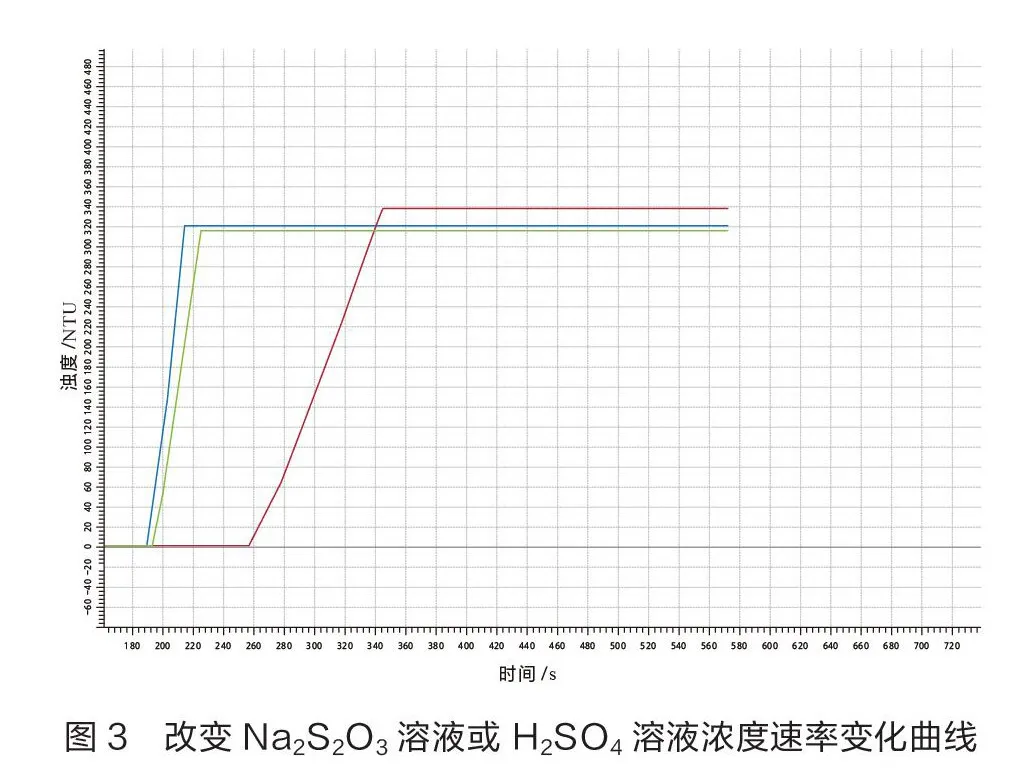
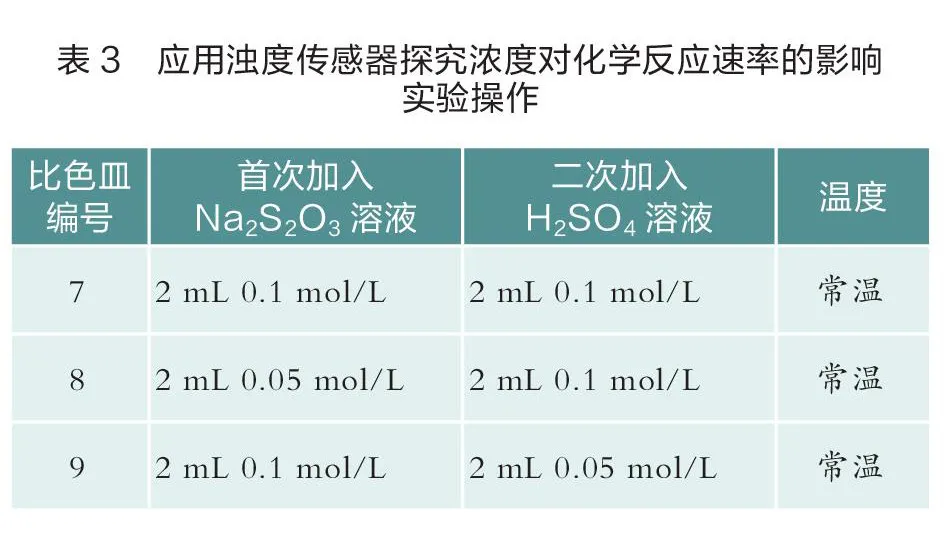
其三,应用浊度传感器探究浓度对NaSO与HSO反应的影响,实验操作如下(见表3)。
在常温下,改变NaSO溶液或HSO溶液浓度后的反应变化曲线如图3所示。蓝线为2 mL 0.1 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验7),绿线为2 mL 0.1 mol/L NaSO溶液与2 mL 0.05 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验9),红线为2 mL 0.05 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验8)。从图3可以看出,实验7曲线出现拐点的时间最早,曲线斜率最大,其次是实验9,最后是实验8。
对比上述实验出现拐点的时间以及曲线斜率可进行如下推理:在其他条件相同时, NaSO溶液浓度越大,该反应的化学反应速率越大;对比实验7、9出现拐点的时间以及曲线的斜率可以看出:在其他条件相同时,HSO溶液的浓度越大,该反应的化学反应速率越大。说明:3条曲线达到的最大值是传感器能检测到的最大值,由于传感器灵敏度不同,最大值略有不同。
其四,应用浊度传感器探究温度对化学反应速率的影响,实验操作如下(见表4)。
将数据采集器与3个浊度传感器相连,并与电脑连接,开启DISLab 8.0软件。利用单机“组合曲线”,添加3条“浊度—时间”曲线并调零。待3个比色皿中溶液浊度均达到检测的最大值且数据稳定后,停止采集数据,保存曲线图像。
在不同温度下,2 mL 0.1 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应变化曲线如图4所示。蓝线为常温下2 mL 0.1 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验11),绿线为热水加热后2 mL0.1 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验12),红线为冰水冷却后2 mL 0.1 mol/L NaSO溶液与2 mL 0.1 mol/L HSO溶液反应过程中溶液浊度的变化曲线(实验10)。从图4可以看出,实验12曲线出现拐点的时间最早,曲线斜率最大,其次是实验11,最后是实验10。对比实验10、11、12出现拐点的时间及曲线的斜率可以看出:在其他条件相同时,温度越高,反应速率越大。说明:3条曲线达到的最大值是传感器能检测到的最大值,由于传感器灵敏度不同,所以最大值略有不同。
利用浊度传感器探究浓度、温度对化学反应速率的影响得到了合理的结论。学生利用手持技术实验,对化学实验方法有了更深刻的理解,得到了比较准确的数据,在合理推理的过程中理解了化学知识,提升了证据推理素养水平。
此外,教师应用手持技术分析速率曲线还可以引申出很多值得深入探讨的问题,给学生更大的思维拓展空间。但必修阶段,不宜拓展太多。笔者在教学中未做过深分析,所得实验证据留待选修阶段继续探究。
三、总结
宋心琦教授曾说,“由眼见为实获得的信息可能并不是实验对象所提供的全部。数字化教学手段的引入将是课程改革发展的趋势之一”。手持技术具有定量化、可视化的优势,在化学实验教学中大有可为。课后笔者对学生进行访谈,结果表明学生获得的不光是实验的结论,还有科学、定量的认识方法。手持技术与化学实验深度融合不仅可以促进学生证据意识和推理水平,而且可以加深学生对知识的理解,使微观本质宏观化。这种融合在今后的教学中会越来越受重视。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准:2017年版 2020年修订[S].北京:人民教育出版社,2020.
[2] 吴蕴.利用传感器技术改善化学反应速率教学[J].中国教育技术装备,2015(17):164-166.
(作者系北京市顺义区教育研究与教师研修中心教研员)
责任编辑:祝元志
