基于电导率传感器的实验探究教学设计
2021-12-29顾仲良




化学是一门以实验为基础的学科,化学实验是实现教学目标的重要方法和途径。新课标要求在内容选择上精心设计学生必做实验,同时适当增加数字化实验、定量实验和创新实践活动等,让学生在实验探究活动中学习科学方法,认识科学探究过程,体会、认识技术手段的创新对化学科学的重要价值[1]。难溶电解质在水溶液中存在的溶解平衡是一个重要的化学平衡。笔者利用电导率传感器进行实验探究,引导学生论证溶解平衡的存在,体验溶度积常数的获得,判断溶解平衡的移动。应用数字化实验进行探究与数理分析,有利于学生加深对化学平衡理论的理性认识,增强数据实证意识,发展学生的化学学科核心素养。
一、教材内容分析
人教版[2]与鲁科版[3]教材分别以难溶电解质AgCl和PbI为例,说明存在溶解平衡,指出溶度积常数只与难溶电解质的性质与温度有关,而与沉淀的量无关。难溶电解质在水溶液中的溶解度很小。利用传统的实验手段很难搞清其微观离子在水中的存在和运动,而应用电导率传感器可以探知微弱的离子浓度变化,并以数字化的形式呈现难溶电解质的溶解平衡及影响因素。笔者在教学设计中创新实验方案,通过测量难溶电解质PbI饱和液的电导率,获得各离子的实际浓度和溶度积常数,通过测量悬浊液稀释过程和升温过程的电导率变化,说明溶解平衡的存在和温度效应的影响,以加强实验与理论结合的数据实证,提高学生的化学学科能力。
二、教学现状分析
很多化学教师非常关注并开展了相关的数字化实验教学研究。郑晓红[4]利用氯离子传感器,通过氯离子浓度的升降来定性研究氯化银沉淀溶解平衡的移动。杨玲等[5]利用pH传感器与电导率传感器探究碳酸钙的溶解平衡的移动方向。相关实验研究思路新颖,推理缜密,证明了溶解平衡的存在和移动,但都没有对离子浓度、溶度积常数进行定量计算,没有研究温度对溶解平衡的影响,且普通的氯离子传感器在浓度极低时的敏感性和精确性并不理想,只能作定性变化的研究。在溶解平衡的实验教学中要充分论证平衡理论,必须获得离子实际浓度并计算溶度积常数,因为离子的实际浓度变化是溶解平衡发生变化最直接的表达,也是溶解平衡移动方向最直接的判断,而溶度积常数可直观表现和比较沉淀的溶解性。
三、教学与评价目标
(一)教学目标
第一,通过对难溶电解质离子浓度与电导率关系的认识,初步理解溶解平衡的存在,并从宏观和微观角度解释溶解平衡。
第二,观察悬浊液的稀释和加热过程中电导率变化的情况,了解溶解平衡的存在和移动,并通过电导率、离子浓度、溶度积常数等判断溶解平衡的移动,解释平衡移动的原因。
第三,通过利用电导率传感器实验探究离子浓度和对有毒废弃物的无害化处理,培养学生严谨求实的探究精神和环保意识的社会责任。
(二)评价目标
第一,利用电导率与离子浓度的关系,计算溶度积常数,诊断并发展学生宏观—微观—符号三重表征的理解水平。第二,通过对电导率实验的设计和操作,诊断并发展学生利用数字化传感器进行科学实验的探究水平。第三,通过对稀释和加热悬浊液过程中的电导率变化曲线的解读和点评,评估并提高学生对化学平衡理论和溶解平衡移动的理解水平。
(三)教学重点与难点
重点是使学生掌握溶解平衡的存在和移动,难点是用离子浓度和化学平衡理论解读溶解平衡移动。
四、教学设计思路
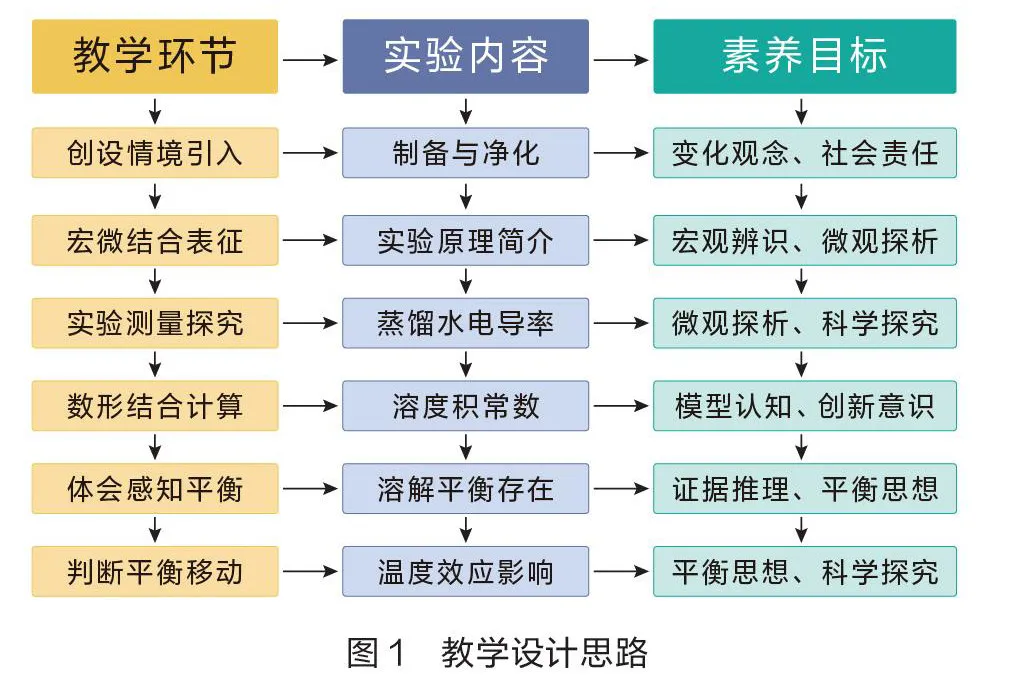
难溶电解质的溶解平衡是水溶液中一个重要的化学平衡。通过此内容的学习,学生能熟练应用化学平衡理论解释溶解平衡,同时更加透彻地了解溶液中离子浓度变化的情况。笔者采用教—学—评一体化策略,助力学生核心素养发展。在教学过程中,以黄金雨为情境,通过6个教学步阶,引导学生电导率实验探究溶解平衡的存在和移动,有效建构和完善化学平衡理论(如图1)。
五、教学过程
(一)碘化铅的制备与净化
首先取两个250 mL规格的烧杯,分别加入0.5 g硝酸铅和0.6 g碘化钾,向两个烧杯中分别加入150 mL 65 ℃热水,然后用玻璃棒搅拌加速溶解后将碘化钾溶液倒入硝酸铅溶液中,立即产生金黄色的碘化铅沉淀,最后将悬浊液趁热过滤于烧瓶中,烧瓶内在灯光的照射下不断生成闪着金光的“黄金雨”。滤液在冷却过程中不断地析出大小均一的碘化铅沉淀。
将碘化铅沉淀转移到离心试管内,加入5 mL蒸馏水,置于离心机上以900转/秒的转速离心3分钟,将上层清液倒入1个盛有NaS固体的烧杯中进行无害化处理,再加入蒸馏水按上述离心操作3次。
实验分析 :制备实验主角碘化铅(引入课题),展现鲜艳亮丽的色彩让学生体会化学之美,吸引学生的注意力,激发学生的兴趣。反复地离心操作和蒸馏水清洗,目的是除去多余的硝酸根、钾离子等可溶离子,确保碘化铅沉淀的纯度。净化操作可根据课时的安排,课前另制沉淀。强调含铅污染物的无害化处理,增强学生的环保意识,发展学生“社会责任”相关素养。
(二)电导率实验原理
固态物质的导电能力通常以电阻表示,而液态物质的导电能力通过用电导表示。电导是电阻的倒数。由于溶液导电能力主要受离子浓度影响,所以同种电解质的水溶液电导越大说明电解质离子浓度越大。难溶电解质多为溶解度极小的强电解质,电解质的极限摩尔电导率 (S·m2·mol-1)、测量电导率 (S·m-1)、电解质的离子浓度 (mol·L-1)、沉淀物(AB型)的溶度积常数(mol3·L-3)有如下关系:
查表[6]可得25 ℃时碘化铅的极限摩尔电导率为1.478×10-2 S·m2·mol-1。
实验分析:溶液的导电性是电解质电离性质的重要内容。介绍实验原理,让学生基本掌握溶液导电能力与离子浓度的关系,并知道可以通过电导率实验测量获得离子浓度,进一步计算难溶电解质的溶度积常数,达成化学研究微—宏—符的三重表征,发展学生“宏观辨识与微观探析”素养。
(三)蒸馏水电导率测定
按图2搭建实验装置。
在小烧杯中加入20 mL的蒸馏水,将电导率传感器放入蒸馏水中测量,将操作结果填入表1中,重复3次取平均值。
实验分析:虽然蒸馏水的电导率非常小,但由于溶有少量的杂质,如二氧化碳等,这些溶质相对于难溶电解质来说,仍有较大影响。测定蒸馏水的电导率进行数据处理时,用扣除溶剂电导率后的数据表示电解质的电导率较为精确。如果实验有更高精度的要求,还可以对蒸馏水进行预处理。处理的方法是向蒸馏水中加入少量高锰酸钾,用硬质烧瓶进行重蒸馏[7],得到“电导水”。“电导水”的电导率可以做到小于1 μS·cm-1。
(四)溶度积常数的获得
将纯净的碘化铅沉淀全部(沉淀越多溶解速率越快)倒入到盛有75.00 mL蒸馏水的大烧杯中,放入电导率传感器开始测量电导率,用玻璃棒辅助磁力搅拌器进行搅拌,直至电导率测量值表现为不再变化,达到溶解饱和呈悬浊状,获得数据记录并计算填表(见表2)。
实验分析:根据碘化铅的极限摩尔电导率,结合实验测量溶解饱和的悬浊液电导率,本实验可以比较精确地获得溶度积常数=7.40×10-9(26.5 ℃)。化学手册提供数据为7.10×10-9(25 ℃),误差仅偏大4.22%,故本实验操作方法有非常高的参考价值。本次实验测得的实验值略大于化学手册给出的数值。造成误差的主要原因是本次实验室内气温为26.5 ℃,比手册数据温度25 ℃略高。在电导率测量中,即便温度只高1.5 ℃,也会因为温度效应造成测量数值偏大。
(五)溶解平衡的存在
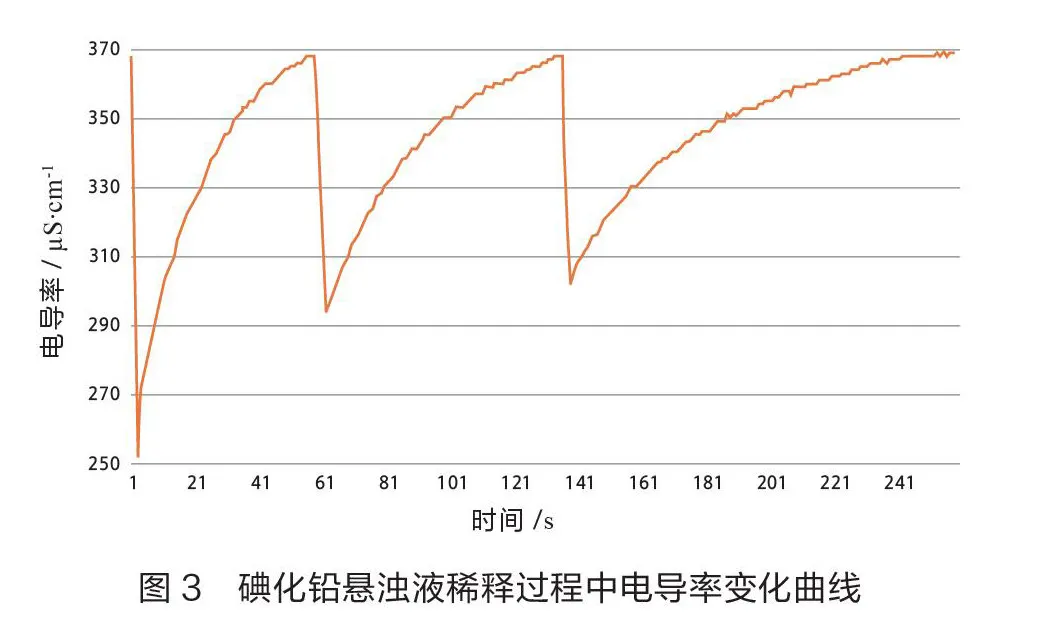
继续在上述悬浊液中测量电导率,将数据采集系统设置为每隔5 s采集1次电导率,用滴定管在烧杯中添加蒸馏水(每次加25.00 mL),用磁力搅拌器加上玻璃棒辅助搅拌,观察电导率回升到368 μS·cm-1时添加1次蒸馏水。共添加蒸馏水3次。获得电导率数据的变化曲线(如图3)。
实验分析:当悬浊液中加入蒸馏水后各离子浓度迅速下降,碘化铅离子积<,溶液部分为不饱和状态。根据溶度积规则,沉淀的溶解平衡向溶解方向发生移动,以达成=状态。这一过程碘化铅沉淀在搅拌作用下会逐渐溶解,溶液趋于饱和,离子浓度逐渐上升,表现为电导率逐渐上升。
每次加入蒸馏水后溶液电导率下降,下降幅度受加入蒸馏水的量与原有溶液的量之比影响。比值越大,下降越多。每次加入蒸馏水的量均为25 mL,而溶液则由75 mL变为100 mL、125 mL。比值逐渐减小,所以电导率下降的幅度也逐渐减小。每次加入蒸馏水搅拌后电导率逐渐升高,但由于悬浊液中固体的量减小、溶液的总量增加,溶解速率减慢,溶解沉淀达到饱和浓度逐渐困难,表现为电导率升高达到饱和(平衡)状态值所需的时间增加。
(六)平衡的温度效应
将上述碘化铅悬浊液加蒸馏水至400 mL,用磁力搅拌器和玻璃棒搅拌至饱和。经沉积之后将上层澄清液200 mL倒入一个同批次同容量的烧杯,将两个烧杯置于双孔恒温水浴锅中。在两个烧杯中分别放入电导率传感器,在其中一个烧杯中再放入温度传感器,设置水浴锅开始加热,用玻璃棒在两个烧杯中搅拌,系统设置为每隔0.5秒记录测量数据。
结合温度数据,绘制电导率数据变化曲线。
实验分析:与其他化学平衡一样,难溶电解质的溶度积常数也是随温度改变而变化的。由于大多数难溶电解质溶解与电离的总反应是吸热过程,所以溶度积常数是随温度升高而增大的。
通过澄清液升温过程电导率上升的对比实验,可知温度升高时溶液电导率上升并不完全是由于溶液中离子浓度增加引起的。从图4曲线可看出,澄清液电导率变化曲线与温度变化曲线几乎平行,这是由于澄清液中水的电离、离子的活度、离子的电迁移率(淌度)都在随着温度的升高而增大,电导率也随之增大。与澄清液相比,悬浊液电导率变化曲线有明显的跃起。这是因为悬浊液中还有离子浓度在增加的因素。温度升高,沉淀溶解平衡向正向移动,溶度积常数也在增大。
六、教学效果与反思
笔者进行教学设计时没有选用学生熟悉的硫酸钡、氯化银作为实验研究的对象,而采用色彩惊艳的碘化铅作为研究对象,主要是考虑到硫酸钡、氯化银的溶解度更小,测量其水溶液时需要的传感器精度要求很高,使用现有设备很难实现,同时利用碘化铅也可以让学生对非AB型难溶电解质消除陌生感,便于建构各类沉淀物溶度积计算的模型。实验结束,用试剂NaS妥善处理含铅废液,防止环境污染,使实验教学过程既能科学论证化学理论,又能保证环保无污染。
传统溶解平衡实验的数字化创新改进,可以使原本抽象的化学理论转化为直观的实验现象和可靠的数据实证,让学生体验实验前的变量选择、实验中的过程操作、实验后的数据处理。亲历实验使学生对化学理论更加信服,批判性、创新性思维能力和科学探究能力得以提高。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准:2017年版2020年修订[S].北京:人民教育出版社,2020.
[2] 王晶,郑长龙.化学反应原理(选择性必修1)[M].北京:人民教育出版社,2020.
[3] 王磊,陈光巨.选择性必修1 化学反应原理[M].济南:山东科学技术出版社,2019.
[4] 郑晓红.利用手持技术探究难溶电解质的溶解平衡[J].中学化学教学参考,2016(9):56-57.
[5] 杨玲,吴晓红,王亚涛.借助传感器探究难溶电解质的溶解平衡[J].教育与装备研究,2020,36(7):71-73.
[6] J.A.迪安.兰氏化学手册[M].魏俊发,译.北京:科学技术出版社,1991.
[7] 孙文东,陆嘉星.物理化学实验(第三版)[M].北京:高等教育出版社,2014.
(作者系浙江省海宁市第一中学教师)
责任编辑:祝元志
