干扰素λ联合顺铂介导STAT信号通路对乳腺癌细胞抗增殖作用的研究
2021-12-29彭鑫宇刘佳妮李小龙
彭鑫宇,刘佳妮,杨 阳,李小龙
0 引言
乳腺癌是女性常见的恶性肿瘤之一,其发病率约占全球女性癌症的24.2%,严重威胁女性的生命健康[1]。目前,化疗仍是乳腺癌的重要治疗方法。顺铂是临床应用最为广泛的化疗药物,其通过抑制DNA复制、RNA及蛋白质的合成,破坏肿瘤细胞膜,最终导致肿瘤细胞死亡,抑制肿瘤的发生发展[2]。临床研究显示,晚期乳腺癌患者身体基础差,且顺铂等化疗药物对患者机体影响较大[3]。因此,寻找有效且不良反应较小的治疗手段是目前临床研究的关键。干扰素-λ(Interferon-λ,IFN-λ)是Ⅲ型干扰素,其成员包括IFN-λ1、IFN-λ2与IFN-λ3,具有抗病毒、抗增殖、抗肿瘤和免疫调节等功能。李刚等[4]研究发现,IFN-λ与肝癌的发生发展相关;Lasfar等[5]研究显示,过表达IFN-λ可抑制黑色素瘤细胞转移。这些研究表明,IFN-λ具有抑癌因子作用。IFN-λ通过激发多级磷酸化并激活酪氨酸激酶2(Tyrosine kinase 2,TYK2)和JAK激酶1(Janus Kinase 1,JAK1)转导信号,使信号转导子和转录激活子1与2(Signal transducer and activator of transcription 1/2,STAT1/2)的酪氨酸残基磷酸化,而启动信号级联反应,促使干扰素刺激基因3的形成,进入细胞核启动相应的基因转录,从而抑制病毒复制与细胞分裂增殖、产生抗病毒、调节机体免疫等[6]。研究发现,IFN-λ通过激活STAT信号通路发挥其抗肿瘤生物学功能[7-8],提示IFN-λ的抗肿瘤机制与STAT信号通路相关。IFN-λ协同顺铂可抑制食管癌细胞的增殖,提示IFN-λ联合顺铂可能具有调控肿瘤恶性生物学行为的功能[9]。因此,本研究通过探究IFN-λ联合顺铂(Cisplatin,CDDP)对乳腺癌细胞增殖、凋亡及周期的影响,阐明IFN-λ联合CDDP的抗肿瘤机制,以期为IFN-λ在乳腺癌的治疗研究提供参考依据。
1 材料与方法
1.1 主要试剂 人乳腺癌细胞系MDA-MB-231购自中国科学院细胞库;DMEM培养基、胰酶与胎牛血清购自中国赛默飞世尔科技有限公司;CDDP与干扰素-λ购自美国 R&D 公司,BCA蛋白定量试剂盒、蛋白提取试剂盒购自中国康维世纪生物科技有限公司;CCK8试剂盒购自武汉默沙克生物科技有限公司;细胞周期检测试剂盒与细胞凋亡检测试剂盒购自碧云天生物科技有限公司;p-STAT1、p-STAT2、STAT1、STAT2及山羊抗鼠二抗购自美国Cell Signaling Technology公司;STAT信号通路抑制剂HY-B0069购自美国MCE公司。
1.2 细胞培养及处理 MDA-MB-231细胞用含10%胎牛血清的DMEM培养基置于37 ℃、5% CO2的培养箱培养。收集对数生长期的MDA-MB-231细胞,进行实验。实验分为5组:①对照组:DMEM培养基培养24 h;②干扰素-λ组(IFN-λ组):含干扰素-λ(30 ng/ml)的DMEM培养基培养24 h;③CDDP组:含CDDP(0.3 μM)的DMEM培养基培养24 h;④干扰素-λ+CDDP组(IFN-λ+CDDP组):含干扰素-λ(30 ng/ml)与含CDDP(0.3 μM)的DMEM培养基培养24 h;⑤干扰素-λ+CDDP+HY-B0069组(IFN-λ+CDDP+HY-B0069组):含干扰素-λ(30 ng/ml)、CDDP(0.3 μM)及5 μM的STAT信号通路抑制剂HY-B0069的DMEM培养基培养24 h。
1.3 CCK8法检测MDA-MB-231细胞的存活率 收集对数生长期的MDA-MB-231细胞,将细胞浓度调整为1.5×103个/100 μl,接种于96孔板内,培养24 h。根据上述分组加入对应药物,作用于MDA-MB-231细胞,每组均设置3个平行孔,在37 ℃、5%CO2的培养箱培养。取出96孔板,每孔加入 10 μl的CCK-8,37 ℃孵育2 h,于460 nm波长处检测吸光度值(OD值),以不予任何处理的空白对照组的活力为100%,计算细胞增殖率。
1.4 流式细胞术检测MDA-MB-231细胞的凋亡与周期变化 将各组MDA-MB-231细胞利用胰酶消化,离心收集于离心管内,将细胞在预冷磷酸盐缓冲盐水(PBS)中洗涤2次,避光下加入5 μl FITC annexin V和5 μl碘化丙钠(PI),静置15 min,加入400 μl Binding Buffer,混匀后放置于冰上,样品在1 h内用流式细胞仪检测细胞凋亡情况。收集各组MDA-MB-231细胞,细胞数目调整为1×106个/ml,PBS洗涤2次,2 500 r/min离心5 min,尽可能去除上清,逐滴加入-20 ℃预冷的70%乙醇1 ml固定细胞,边加边振荡,4 ℃固定30 min以上。使用PBS洗涤2次,2 000 r/min离心5 min,弃上清,加入50 μl 100 μg/ml的RNase,37 ℃孵育30 min,加入200 μl 50 μg/ml的碘化丙啶(PI),充分振荡,孵育15 min后,使用流式细胞仪检测分析细胞周期。
1.5 Western blot检测p-STAT1、p-STAT2、STAT1及STAT2蛋白表达 采用遇冷的含有蛋白酶抑制剂的RIPA缓冲液提取各组MDA-MB-231细胞蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度,具体操作步骤根据说明书进行。SDS-PAGE凝胶电泳分离等量蛋白,湿转法将凝胶中的蛋白质转至PVDF膜。5%脱脂牛奶室温封闭2 h后,于4 ℃下与大鼠抗人抗体p-STAT1、p-STAT2、STAT1及STAT2(1∶1 500)孵育过夜,用TBST洗膜5 min×3次,加入HRP标记的山羊抗鼠二抗(1∶1 000)37 ℃孵育1 h,用TBST洗膜5 min×3次,采用ECL显影,凝胶成像仪曝光拍照。
2 结果
2.1 干扰素λ与CDDP对MDA-MB-231细胞的协同抗增殖作用 CCK8法实验结果显示,与对照组相比,IFN-λ组、CDDP组和IFN-λ+CDDP组作用MDA-MB-231细胞的存活率显著降低,差异具有统计学意义(P<0.05);与IFN-λ组和CDDP组相比,IFN-λ+CDDP组MDA-MB-231细胞存活率显著降低,差异具有统计学意义(P<0.05)。见图1。
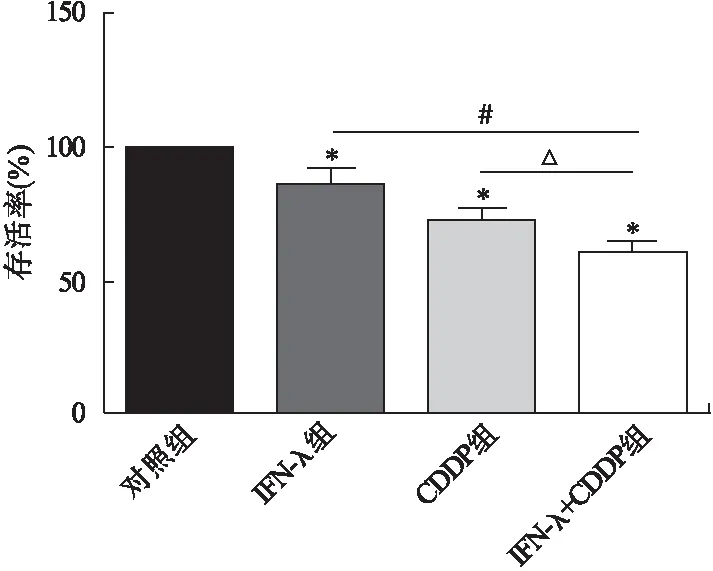
图1 干扰素λ与CDDP对MDA-MB-231细胞的协同抗增殖作用
2.2 干扰素λ联合CDDP对MDA-MB-231细胞凋亡的影响 流式细胞术实验结果显示,与对照组相比,IFN-λ组、CDDP组及IFN-λ+CDDP组的MDA-MB-231细胞凋亡能力均升高。与IFN-λ组与CDDP组相比,IFN-λ+CDDP组的MDA-MB-231细胞凋亡能力升高。见图2。

图2 干扰素λ联合CDDP对MDA-MB-231细胞凋亡的影响
2.3 干扰素λ联合CDDP对MDA-MB-231细胞周期的影响 流式细胞术实验结果显示,与对照组相比,IFN-λ组、CDDP组及IFN-λ+CDDP组的MDA-MB-231细胞G1期占比升高;与IFN-λ组和CDDP组相比,IFN-λ+CDDP组MDA-MB-231细胞G1期占比升高。见图3。
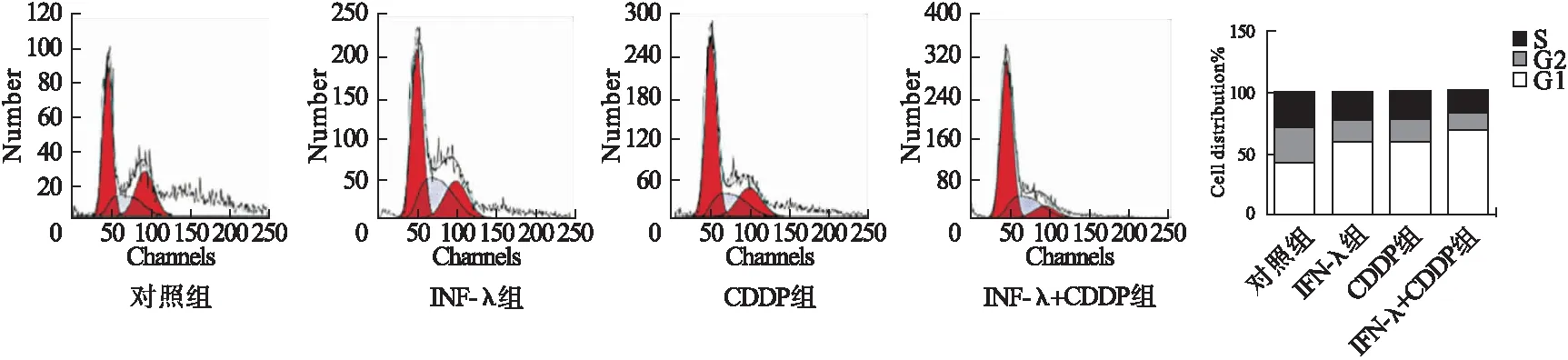
图3 干扰素λ联合CDDP对MDA-MB-231细胞周期的影响
2.4 干扰素λ联合CDDP对MDA-MB-231细胞STAT信号通路的影响 Western blot实验结果显示,与对照组相比,IFN-λ组、CDDP组及IFN-λ+CDDP组MDA-MB-231细胞的p-STAT1与p-STAT2蛋白表达升高,差异具有统计学意义(P<0.05);与IFN-λ组和CDDP组相比,IFN-λ+CDDP组MDA-MB-231细胞的p-STAT1与p-STAT2蛋白表达升高,差异具有统计学意义(P<0.05)。见图4。
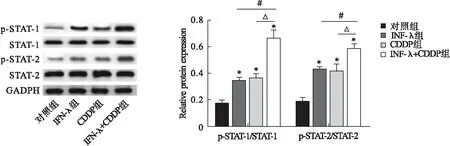
图4 干扰素λ联合CDDP对MDA-MB-231细胞STAT信号通路的影响
2.5 STAT信号通路抑制剂HY-B0069对干扰素λ联合CDDP作用MDA-MB-231细胞的影响 CCK8法实验结果显示,与对照组或HY-B0069组相比,IFN-λ+CDDP组,IFN-λ+CDDP+HY-B0069组的MDA-MB-231细胞的存活率显著降低(P<0.05),前两组无明显差异(P>0.05);而与IFN-λ+CDDP组相比,IFN-λ+CDDP+HY-B0069组细胞存活率明显升高(P<0.05);流式细胞术实验结果显示,与对照组或HY-B0069组相比,IFN-λ+CDDP组,IFN-λ+CDDP+HY-B0069组的MDA-MB-231细胞的凋亡率显著升高,且G1期细胞占比增加,前两组无明显差异;而与IFN-λ+CDDP组相比,IFN-λ+CDDP+HY-B0069组细胞凋亡率与G1期细胞比例均明显降低。见图5。
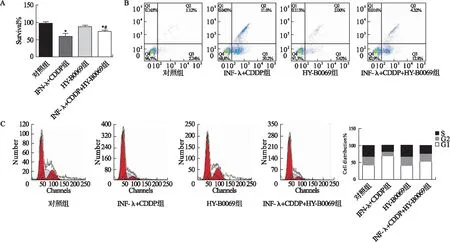
图5 STAT信号通路抑制剂HY-B0069对干扰素λ联合CDDP作用MDA-MB-231细胞的影响
3 讨论
乳腺癌作为一种高度异质性肿瘤,是女性癌症相关死亡的第二大原因[10-11]。近年随着肿瘤免疫研究的发展,免疫治疗已成为继手术、放化疗之后的新的治疗手段[12]。肿瘤免疫治疗主要针对机体的免疫系统,借助免疫系统的力量抑制肿瘤进展。肿瘤免疫治疗包括单克隆抗体与小分子化合物、靶向治疗、肿瘤疫苗及细胞因子治疗等[13]。细胞因子是由免疫细胞(巨噬细胞、NK细胞、T细胞等)和非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成分泌的具有广泛生物学活性的小分子蛋白[14]。杨媚[15]的研究显示,干扰素诱导跨膜蛋白3的表达,进而影响乳腺癌细胞增殖。Lasfar等[5]研究显示,IFN-λ一方面可诱导黑色素瘤细胞表面MHC I类表达,提高NK/NK T细胞的杀瘤活性,另一方面可抑制肿瘤在体内的转移,这提示IFN-λ具有抑制肿瘤发生发展的功能。
IFN-λ是Ⅱ型细胞因子家族成员之一,与Ⅰ型IFN的基因及结构不同,IFN-λ由IFN-λ1(IL-29)、IFN-λ2(IL-28A)和IFN-λ3(IL-28B)3个亚型组成,通过与其受体结合,调控STAT信号通路,形成干扰素刺激调节因子进入细胞核,启动相应基因的转录及表达,影响肿瘤进展[16]。近年研究发现,IFN与化疗药物联合影响肿瘤的恶性生物学行为。Li等[17]研究发现,IFN-MBP通过激活细胞周期阻滞和细胞凋亡通路基因p53、p21、CDK2、cyclin A、caspase 9、Bcl-2和Bax,可增强多柔比星乳腺癌化疗的疗效。Legrier 等[18]研究发现,IFN-γ与顺铂联合可诱导乳腺癌细胞凋亡。李竞等[9]研究发现,IFN-λ联合顺铂通过激活凋亡的线粒体通路及死亡受体通路,且下调凋亡抑制基因Survivin表达,增加肿瘤细胞对顺铂及阿霉素的药物敏感性。本研究发现,IFN-λ与CDDP联合应用,可进一步抑制乳腺癌细胞MDA-MB-231细胞增殖活性,促进细胞凋亡,使细胞停滞于G1期,表明CDDP可提高IFN-λ对MDA-MB-231细胞恶性生物学行为的抑制。
近年研究显示,IFN-λ可以在多种肿瘤细胞中激活信号通路,例如Burkitt′s淋巴瘤[19]、乳腺癌[20]、肝癌[21]及肺癌[22]。Niwa等[23]研究发现,IFN-λ可诱导上皮细胞STAT1/STAT2信号通路的激活。Li等[24]研究发现,STAT1激活的程度随IFN-λ刺激强度的增加而增强。这些研究提示,IFN-λ的抑癌机制可能与STAT通路相关。此外,Yamauchi等[25]研究发现,IFN-λ诱导ISGs表达,激活Caspase3和Caspase7并促进凋亡,可能与STAT通路持续激活相关;陈元岩等[26]研究发现,华蟾素通过抑制STAT通路活化,抑制胃癌肿瘤细胞增殖和诱导细胞凋亡,这说明,STAT信号通路参与肿瘤细胞增殖与凋亡的调控。本研究发现,IFN-λ联合CDDP可激活MDA-MB-231细胞的STAT信号通路,且STAT信号通路抑制剂可影响IFN-λ联合CDDP对MDA-MB-231细胞增殖、凋亡及周期的作用,表明IFN-λ联合CDDP影响MDA-MB-231细胞的抗增殖作用,可能与激活STAT信号通路相关。
综上所述,IFN-λ联合CDDP可显著抑制乳腺癌细胞的增殖活性,促进细胞凋亡,使细胞停滞于G1期,这可能与STAT信号通路相关。本研究为IFN-λ联合化疗药物治疗乳腺癌的研究提供新的思路。
