芍药甘草汤对多囊卵巢综合征大鼠整体代谢及肠道菌群紊乱的调节作用
2021-12-29邓贵凤刘俊瑾常壮鹏邵云云侯锐钢
邓贵凤,刘俊瑾,常壮鹏,邵云云,许 丁,侯锐钢*
0 引言
多囊卵巢综合征(Polycystic ovary syndrome,PCOS)是临床常见的妇科疾病,主要临床特征为高雄激素血症、无排卵或稀发排卵,具体表现为月经周期紊乱、高血糖、肥胖甚至不孕。其发病机制复杂且尚未完全明确,临床上多以对症治疗为主,效果不佳且不良反应较多。中医学将PCOS归结于“闭经”、“不孕”、“崩漏”等范畴,认为其发病机制主要与肾虚脾弱、痰瘀气塞有关。芍药甘草汤(Shaoyao-Gancao Decoction,SGD)是出自《伤寒论》的著名方剂,由芍药和甘草两味草药组成,是治疗PCOS的经典名方之一,两者合用既可理气健脾、滋阴养肝,又可缓急止痛、活血化瘀[1],与PCOS的病机甚为吻合。本课题组前期实验已初步证实SGD可有效改善PCOS大鼠的症状[2],但其作用机制尚不明确,影响了其在临床上的应用与推广。
近年来,代谢组学通过反映机体整体代谢变化被广泛用于研究药物干预或疾病条件下机体的内在调控机制,同时为中药的多靶点作用机制研究提供新的方法。肠道菌群具有维持机体代谢、调节免疫系统平衡等多种功能,常被用于糖尿病、肥胖症、心血管疾病及PCOS等代谢性疾病的研究与治疗。研究发现,多种中药复方可通过重塑肠道菌群发挥药效,如泻心汤作为治疗2型糖尿病的经典名方,其主要是通过调整产饱和脂肪酸及炎症的菌群,重塑肠道菌群而发挥作用。PCOS疾病状态下肠道微生物的组成会发生变化[3-6]。同时,有文献报道,PCOS患者血浆中二甲胺水平升高,胆碱水平降低,二甲胺作为肠道菌群代谢胆碱的产物[7],提示PCOS患者的肠道菌群活性增加,进一步揭示了肠道菌群参与PCOS发病机制的可能性。
本实验旨在利用代谢组学和肠道微生物组学方法,研究SGD对PCOS大鼠内源性代谢产物及肠道菌群的影响,进一步为临床治疗PCOS提供实验基础。
1 材料与方法
1.1 仪器 超高效液相色谱仪(日本岛津公司),四极杆飞行时间质谱仪Q-TOF(美国AB Sciex公司),Kinetex XB-C18色谱柱(2.1 mm×100 mm,2.6 μm),DZF-6050型真空干燥箱(苏州江东精密仪器公司),Illumina MiSeq PE300(Illumina MiSeq,USA),台式离心机(Thermo Fisher),Qubit®3.0荧光计(Invitrogen),PCR仪(BIO-RAD,T100TM Thermal Cyeler)。
1.2 药物与试剂 白芍饮片(安徽精诚本草中药饮片有限公司)和甘草饮片(国药乐仁堂河北药业有限公司)经山西医科大学第二医院药学部张京平中药师鉴定,来曲唑片(国药准字H19991001,2.5 mg/片,江苏恒瑞医药股份有限公司),炔雌醇环丙孕酮片(达英-35,国药准字J20140114,每片含醋酸环丙孕酮2 mg和炔雌醇0.035 mg,拜耳医药保健有限公司广州分公司);甲醇和乙腈(色谱级,美国Fisher公司),睾酮标准品(批号#K1716031,纯度≥98%,aladdin),基因组DNA提取试剂盒(M5635-02,美国Omega Bio-Tek公司),DNA检测试剂盒(Q10212,美国Life公司),2×Taq Master Mix(P111-03,南京诺唯赞生物科技有限公司),DNA纯化试剂盒(EC401-03,法国Transgen公司)。
1.3 实验动物 SPF级雌性SD大鼠,体重180~220 g,购自中国食品药品检定研究院实验动物中心,合格证号SCXK(京)2014-0013。本研究经山西医科大学第二医院实验动物伦理委员会审批通过,批准编号2015KS001。
1.4 实验方法
1.4.1 芍药甘草汤的制备 中药复方芍药甘草汤由白芍和甘草按1∶1比例研碎混匀,加入10倍量的水浸泡1 h后煎煮3次(每次1 h),趁热过滤,合并3次滤液并将其浓缩制成生药质量浓度为4.24 g/ml的浓缩液。
1.4.2 动物分组及给药 24只大鼠饲养于12 h光照与12 h黑暗交替的环境,温度(25± 2)℃,自由饮食,适应性喂养1周后按体重随机分为正常组、模型组(PCOS组)、芍药甘草汤组(SGD组)和阳性对照达英-35组(Diane-35组),每组6只。按照课题组已经成熟的造模方法[2],对各组大鼠进行处理,造模开始后对各组大鼠进行阴道涂片观察动情周期变化,动情周期紊乱表明造模成功,之后进行连续2周的药物干预。本课题组前期采用SGD低、中、高剂量[12.5、25、50 g/(kg·d)]干预PCOS大鼠后,发现高剂量组疗效最为显著[2],故本实验SGD组给予50 g/(kg·d)灌胃治疗,达英-35组每日给予达英-35[0.203 5 mg/(kg·d)]灌胃给药,正常组与PCOS组给予等量生理盐水。每天称量1次大鼠体重。
1.4.3 阴道涂片 用浸泡在0.9%氯化钠注射液中的无菌棉签在阴道侧壁上1/3处轻刮黏液及细胞,将其薄而均匀地涂在载玻片上,用甲醇固定3 min,并用姬姆萨染液染色30 min,用蒸馏水缓慢冲洗干净,晾干后镜检。
1.4.4 卵巢形态学观察 取大鼠两侧卵巢,称重后左侧卵巢用4%甲醛溶液固定,依次使用乙醇(70%、80%、90%、95%)、二甲苯常规脱水,石蜡包埋切片,采用HE染色,光镜下观察大鼠卵巢形态学变化。
1.4.5 睾酮(T)水平的测定 采用UHPLC-MS/MS技术对大鼠血浆T水平进行检测。色谱条件:含0.1%甲酸的蒸馏水(A)∶乙腈(B)=50%为流动相进行等度洗脱,柱温40 ℃,流速0.3 ml/min,进样量5 μl。质谱条件:采用电喷雾离子源(ESI)正离子模式,气帘气40 psi,喷雾气50 psi,辅助气50 psi,离子源温度500 ℃。
1.4.6 内源性代谢产物检测条件 色谱条件:流动性水(A)和甲醇(B)梯度洗脱(0~2 min,5% B;2~8 min,5%~15% B;8~13 min,15% B;13~17 min,15%~30% B;17~22 min,30% B;22~26 min,30%~95% B;26~28 min,95% B;28~28.2 min,95%~5% B;28.2~30 min,5% B),其他条件同“1.4.5”色谱项下。质谱条件:采用ESI+/ESI-模式,其他条件同“1.4.5”质谱项下。
1.4.7 生物样品的收集与处理 ①血浆样本的收集与处理:取大鼠腹主动脉血,4 000 r/min离心10 min得到血浆样本,取100 μl血浆,加入300 μl甲醇涡旋离心取上清,将上清真空干燥,加入100 μl初始流动相复溶,再经涡旋离心后取上清待测。②粪便样品的收集与处理:末次给药24 h后,收集大鼠新鲜粪便,置于2 ml无菌干燥的冻存管中,液氮速冻后放入-80 ℃冰箱中,随后将大鼠粪便放入干冰中送往生工生物工程(上海)股份有限公司进行细菌V3-V4区的16S rDNA基因测序。预处理后的粪便样本采用基因组DNA提取试剂盒提取总DNA,采用琼脂糖凝胶检测DNA完整性,随后进行PCR扩增,引物序列:341F(CCTACGGGNGGCWGCAG),805R(GACTACHVGGGTATCTAATCC)。对得到的PCR引物进行DNA纯化回收后,采用DNA检测试剂盒对回收的DNA精确定量,按照1∶1的等量混合后上机测序。
1.5 数据处理 肠道菌群按97%的一致性将序列聚类成OTUs,通过LEfSe软件对肠道菌群进行差异分析,筛选P<0.05,LDA>4的菌落进行展示和比较。实验数据采用SPSS 22.0统计软件,组间差异采用One-way ANOVA检验,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SGD对PCOS大鼠药效学的影响
2.1.1 SGD对PCOS大鼠体重及卵巢重量的影响 与正常组相比,PCOS大鼠体重和卵巢重量显著增加。经SGD干预2周后,大鼠体重和卵巢重量明显下降,与正常组比较,差异无统计学意义(见图1)。

图1 SGD对PCOS大鼠体重(A)及卵巢重量(B)的影响
2.1.2 SGD对PCOS大鼠动情周期的影响 正常组有4~5 d的规律动情周期,与正常组相比,PCOS大鼠动情周期出现不同程度的紊乱(多处于动情间期),经SGD干预后,动情周期重新呈现4~5 d的规律变化。
2.1.3 SGD对PCOS大鼠卵巢形态学改变的影响 镜下观察到正常组有多个黄体及不同发育阶段的卵泡,卵母细胞结构完整,颗粒细胞排列整齐。与正常组相比,PCOS大鼠卵巢囊性扩张卵泡增多,颗粒细胞层数减少,黄体及卵母细胞明显减少。SGD干预后,黄体及各级卵泡数增多,颗粒细胞层数增多(如图2)。
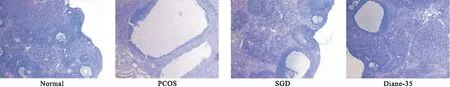
图2 SGD对PCOS大鼠卵巢形态学改变的影响(HE,100×)
2.1.4 SGD对PCOS大鼠睾酮(T)水平的影响 与正常组相比,PCOS大鼠血浆中T水平显著升高。SGD干预后T水平明显下降,与正常组之间差异无统计学意义(如图3)。
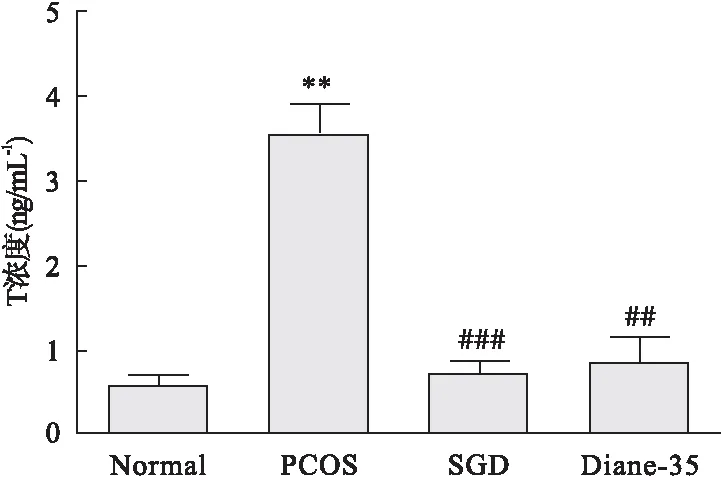
图3 SGD对PCOS大鼠T水平的影响
2.2 SGD对PCOS大鼠血浆差异代谢产物的影响 采用UHPLC-MS/MS方法对大鼠血浆内源性代谢产物进行检测,通过正交偏最小二乘方-判别分析(OPLS-DA)(VIP>1)与t检验(P<0.05)筛选出差异代谢产物。结果发现,与正常组相比,PCOS大鼠血浆中存在37种差异代谢产物(见表1),SGD干预后,其中10种代谢产物变化发生逆转,其中亮氨酸、谷氨酰胺、色氨酸、脯氨酸、尿酸、腺苷含量显著升高,乙酰肉碱、月桂酸、棕榈酸和亚油酸含量明显降低。对所有差异代谢物进行热图聚类分析(见图4A),发现SGD对PCOS疾病状态下引起的差异代谢产物均有一定水平的回调。经MetaboAnalyst通路富集分析,SGD干预主要涉及亚油酸代谢与丙氨酸、天门冬氨酸和谷氨酸代谢通路(见图4B)。

表1 正常组与PCOS组血浆中的37个差异代谢产物
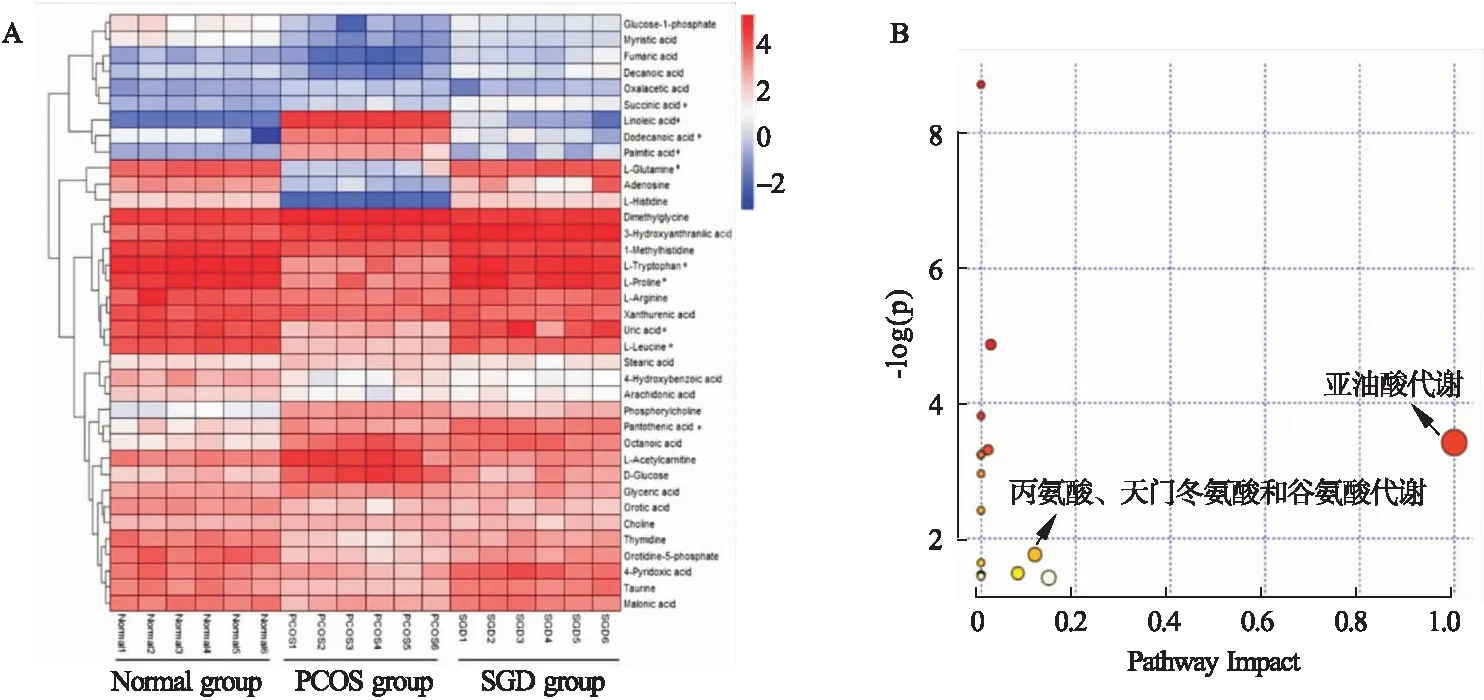
图4 分析SGD对PCOS大鼠血浆差异代谢的影响
2.3 SGD对PCOS大鼠肠道菌群多样性和丰度的影响
2.3.1 菌群多样性分析 在97%的相似水平下进行OTU分析,计算不同组大鼠肠道菌群的α多样性指数,见表2,ACE是估计群落中OTU数目的指数,Shannon和Simpson指数用来评估样品中微生物的多样性,Shannon指数越大,群落多样性越高;Simpson指数越大,群落多样性越低。PCOS组肠道菌群多样性较正常组和SGD组多样性显著降低。
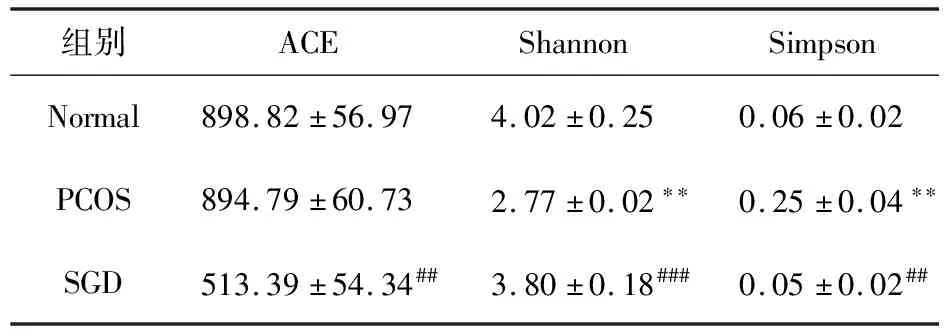
表2 各组样品菌群多样性指数(n=6)
2.3.2 LEfSe菌群差异分析 如图5所示:A图为线性判别(LDA)分析,将不同组中有显著差异(P<0.05,LDA>4)的物种以柱状图的形式展示,柱状图的长度代表了差异物种的影响程度。B图将差异以进化分支图的形式展示,从内至外辐射的圆圈代表从门到属的分类级别。由图可知,乳酸杆菌科和Odoribacter属为PCOS组的优势菌群,值得注意的是,在其他类似的代谢性疾病中也有同样的发现[8-9],提示PCOS大鼠肠道菌群紊乱,而这些菌群在SGD组和正常组中表达较低。

图5 通过线性判别分析(A)和进化分支图(B)对各组差异菌群进行分析
2.3.3 各组间菌群组成分析 见图6、表3。

图6 SGD分别在门(A)和属(B)水平下对PCOS菌群丰度的调节
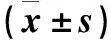
表3 SGD对PCOS大鼠主要差异菌群相对丰度的影响
结果显示,相比于正常组,PCOS组在门水平上,厚壁菌门的相对丰度升高,拟杆菌门的相对丰度降低,厚壁菌门与拟杆菌门的比值(Firmicutes/Bacteroidetes,F/B)显著升高。SGD干预后,厚壁菌门的相对丰度下降,拟杆菌门的相对丰度增加,F/B显著降低。在属水平上,与正常组相比,PCOS大鼠乳酸杆菌的相对丰度升高。SGD给药后,乳酸杆菌的相对丰度降低。
3 讨论
来曲唑灌胃诱导PCOS大鼠模型是一种成熟的造模方法。本研究结果表明,与正常组相比,经来曲唑造模给药3周后,大鼠体重、卵巢重量及T水平显著升高,动情周期呈现不同程度的紊乱,与临床PCOS患者表现一致[10]。卵巢形态学显示,PCOS大鼠卵巢囊性扩张卵泡增多,颗粒细胞层数减少,黄体及卵母细胞减少,表明PCOS大鼠造模成功。而SGD干预后,大鼠体重、卵巢重量、血浆T水平明显降低,动情周期重新恢复规律,卵巢形态恢复正常,提示SGD对PCOS具有显著的干预作用。然而目前对SGD干预PCOS的作用机制研究仍处于初级阶段,其作用靶点仍不清楚,且SGD作为中药复方,成分复杂,单一指标阐明其作用机制存在局限性和主观性。代谢组学思路具有整体性与客观性的优势,可从整体的角度出发寻找干预因素所导致的差异信号,通过认识体液“代谢物指纹图谱”的变化,阐明药物的作用机制,非常适合化学成分尚不明确的中药复方作用机制的研究。
本研究采用代谢组学技术发现与PCOS模型相关的37种差异代谢物,而SGD可以回调其中的10种代谢产物,其中亮氨酸、谷氨酰胺、色氨酸、脯氨酸、尿酸、腺苷含量显著升高,乙酰肉碱、月桂酸、棕榈酸和亚油酸含量明显降低,主要涉及亚油酸代谢与丙氨酸、天门冬氨酸和谷氨酸代谢2条通路。有报道,不饱和脂肪酸亚油酸的摄入会引发炎症,升高白介素-6、肿瘤坏死因子-α等促炎因子的表达[11-12];而丙氨酸、天门冬氨酸和谷氨酸代谢能够改善机体免疫调节功能[13],其中该通路中谷氨酰胺的摄入能够通过降低炎症因子水平抑制炎症反应[14]。研究发现,慢性低度炎症在PCOS发生发展中发挥重要的作用,SGD能够通过抑制炎症治疗PCOS[2,15]。因此,通过对PCOS大鼠血浆差异代谢物的分析,SGD可能通过降低亚油酸代谢通路中亚油酸水平,同时升高丙氨酸、天门冬氨酸和谷氨酸代谢通路中谷氨酰胺水平调节炎症,从而改善PCOS大鼠炎症症状。
近年来,随着肠道菌群在代谢性疾病中的作用被逐渐挖掘,临床上,重塑肠道菌群已成为一种新的治疗策略。研究证实,在PCOS患者中肠道菌群多样性降低,且肠道菌群可影响性激素的生成[3-4],这些研究为本项目提供了可借鉴的研究思路。但SGD是否通过调节肠道菌群发挥作用尚不明确,因此,本实验进一步探究了肠道菌群在SGD疗效中的作用。人体肠道菌群在门水平上主要由厚壁菌门与拟杆菌门组成,F/B常被认为是评价健康状态的重要指标,F/B值与脂质代谢、肥胖、胰岛素抵抗等临床表现密切相关,在多种代谢性疾病的发生发展中起着重要作用[16-19]。PCOS患者多伴有肥胖和胰岛素抵抗症状,本研究发现,PCOS大鼠肠道F/B值异常增高,而SGD可降低该比值,故推测SGD可能通过降低F/B值改善PCOS大鼠肥胖和胰岛素抵抗症状。此外,在属水平上,实验发现,PCOS大鼠肠道乳酸杆菌和Odoribacter菌水平较高,而SGD干预后显著降低。其中Odoribacter菌是产乙酸、丙酸等短链脂肪酸的主要菌群[20-21],短链脂肪酸与受体FFA2、FFA3结合后,可显著抑制胰岛素的分泌[22],引起高血糖;而乳酸杆菌在肥胖患者肠道中高表达[23]。可见,肠道菌群在SGD干预PCOS中发挥重要作用,SGD在临床上对PCOS的治疗作用可能与调节肠道菌群紊乱有关,其主要通过降低肠道中异常增高的F/B值、乳酸杆菌和Odoribacter菌水平改善PCOS相关症状。
综上所述,PCOS大鼠体内存在37种内源性差异代谢产物,肠道菌群紊乱,SGD能够有效改善PCOS的疾病症状,调节PCOS大鼠血浆中10种内源性差异代谢物,主要涉及亚油酸代谢与丙氨酸、天门冬氨酸和谷氨酸代谢2条通路。推测SGD可能是通过调节内源性代谢物及改善PCOS肠道菌群紊乱发挥治疗PCOS的作用。
