药物球囊主动保护技术在冠状动脉分叉病变中的远期临床获益研究
2021-12-28陈伟泉梁茂锦陈许宁梁伦昌
陈伟泉 梁茂锦 陈许宁 梁伦昌
广东省罗定市人民医院心血管内科 527200
冠状动脉分支病变与其他冠状动脉病变相比存在着较高的剪切力以及更易形成涡流,造成治疗中极易出现铲雪现象、不稳定斑块移位、夹层撕裂等,从而造成介入治疗手术难度高,成功率低,分支再狭窄闭塞发生率高,中远期治疗效益不佳[1-3]。目前冠状动脉分支病变的治疗尚有争议,但是2018 年欧洲心脏病学会《血运重建指南》推荐Provisional T 技术作为冠状动脉分支病变的首选治疗方案,该技术是指在主支血管放入支架,分支血管根据患者的实际状况决定采用球囊扩张或是置入支架[4]。药物涂层球囊(DCB)主动保护技术以球囊导管为载体,在球囊扩张时将抗增殖药物释放于冠状动脉血管壁,目前大量研究表明DCB 技术在减少支架内血栓形成,减少晚期管腔丢失以及再狭窄、闭塞方面具有明显优势[5]。目前关于冠状动脉分支病变治疗在使用Provisional T 技术治疗基础上,分支血管使用药物涂层球囊主动保护技术进行处理的治疗效果研究尚不足,本研究探讨药物球囊主动保护技术在冠状动脉分叉病变治疗应用中的远期临床效果,现报道如下。
1 资料与方法
1.1 一般资料 随机纳入罗定市人民医院2018 年1 月至2019 年1 月确诊为冠状动脉分叉病变患者78 例,男51 例,女 27 例,年龄18~65(43.89±7.97)岁,采用随机数字法将患者分为两组,每组39 例。药物球囊主动保护组男25 例,女 14 例,年龄18~64(43.47±8.14)岁;普通球囊主动保护组男26例,女13例,年龄18~65(43.15±7.44)岁。(1)纳入标准:①冠状动脉造影符合冠状动脉分支病变诊断标准者,主支血管狭窄程度>75%,分支血管狭窄程度<50%[6];②符合经皮冠状动脉介入治疗(PCI)适应证;③患者及家属签署研究知情同意书并且能够配合医院进行造影随访;④分支血管直径>2 mm。(2)排除标准:①既往有外科搭桥手术史,或靶病变部位为冠状动脉支架植入术后血栓或再狭窄部位;②合并严重心力衰竭、急性心肌梗死、心源性休克、持续性心房颤动等的患者;③合并严重肝肾功能不全,无法耐受手术者;④合并严重出血性疾病、凝血功能障碍性疾病、严重的消化性溃疡等无法使用抗血小板治疗的患者;⑤对碘造影剂过敏无法完成冠状动脉造影的患者;⑥预期寿命<1 年的重大疾病患者。本研究经罗定市人民医院医学伦理委员会审批通过。
1.2 治疗方法 药物球囊主动保护组:主支血管置入药物洗脱支架,分支血管使用药物涂层球囊进行主动保护,普通球囊主动保护组:主支血管置入药物洗脱支架,分支血管使用普通球囊进行主动保护。患者入院后接受常规的阿司匹林、氯吡格雷和替格瑞洛进行抗血小板治疗,术前1 d进行负荷量的氯吡格雷、替格瑞洛治疗。两组均进行PCI。(1)桡动脉穿刺后将2 根导丝分别置入主支和分支血管,主支和分支血管均使用半顺应性球囊进行预扩张。(2)药物球囊主动保护组:将药物涂层球囊释放于分支血管1 min左右后将药物涂层球囊预埋于分支血管,药物涂层球囊采用的为德国贝朗公司的紫杉醇释放冠脉球囊导管,球囊直径与血管直径比为0.8∶1,球囊扩张使用缓慢加压模式每3~5 s进行1 atm 加压,球囊扩张最大压力为7~8 atm。普通球囊主动保护组:将普通球囊预埋于分支血管。(3)球囊预埋完成后主支血管送入药物洗脱支架。(4)先进行分支球囊扩张后再释放主支血管支架,以实现分支球囊与主支支架对吻释放。(5)分支球囊撤出,主支支架进行支架内后扩张后完成手术。
1.3 观察指标 (1)心肌梗死溶栓试验(TIMI)血流分级:记录术后即刻患者主支和分支血管的TIMI 分级情况,达到TIMI 3 级为治疗有效,TIMI 3 级判断标准为:完全灌注,造影剂在冠脉内快速充盈和消除。(2)主要不良心血管事件(MACE)发生率:术后1、3、6、9、12 个月门诊随访患者是否存在心绞痛及其严重程度,MACE(靶血管重建、心源性死亡、心梗)发生率。(3)分支血管晚期管腔丢失(LLL):术前、术后即刻、术后12 个月进行冠状动脉造影,测量主支血管近段、主支血管远段、分支血管最小管腔直径(MLD)以及血管狭窄程度,计算主支和分支LLL,即术后即刻MLD 与术后9 个月MLD 的差值的情况,以及分支血管再狭窄的发生情况。
1.4 统计学方法 应用SPSS 20.0 统计软件对数据进行统计学分析,计数资料以例(%)表示,组间比较采用χ2检验,符合正态分布的计量资料以均数±标准差()表示,组间比较采用独立样本t检验,组内比较采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TIMI 血流分级 药物球囊主动保护组和普通球囊主动保护组患者术后即刻主支血管和分支血管血流的TIMI 3 概率相近,两组比较差异均无统计学意义(均P>0.05),具体见表1。
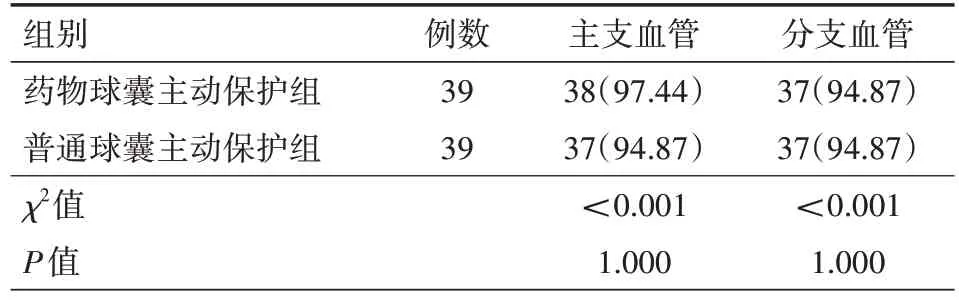
表1 两组冠状动脉分叉病变患者术后即刻TIMI 3级发生情况比较[例(%)]
2.2 MACE 发生情况 两组患者随访配合情况良好,并无失访的情况发生,于术后1、3、6、9、12 个月门诊随访时患者没有出现心源性休克,其他不良事件心绞痛、心肌梗死、靶血管再狭窄均有发生,药物球囊主动保护组MACE 总发生率明显低于普通球囊主动保护组,差异有统计学意义(χ2=6.303,P=0.012),详见表2。
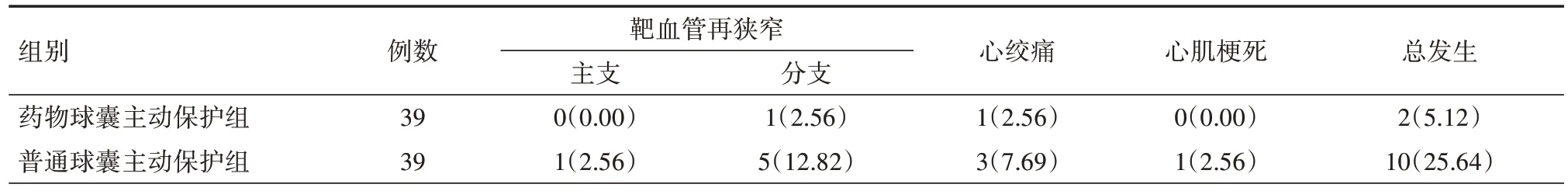
表2 两组冠状动脉分叉病变患者主要不良心血管事件发生情况比较[例(%)]
2.3 主支、分支血管MLD 狭窄程度 在术前、术后即刻两组患者主支、分支血管MLD、血管狭窄程度以及术后9、12 个月主支血管MLD、血管狭窄程度比较差异均无统计学意义(均P>0.05);在随访的术后9、12 个月时药物球囊主动保护组分支血管MLD 明显高于普通球囊主动保护组,分支血管狭窄程度明显低于普通球囊主动保护组,差异均有统计学意义(均P<0.05)。具体见表3~6。
表3 两组冠状动脉分叉病变患者主支血管最小管腔直径比较(mm,)

表3 两组冠状动脉分叉病变患者主支血管最小管腔直径比较(mm,)
注:a为与同组术前比较,P<0.05
组别药物球囊主动保护组普通球囊主动保护组t值P值术后12个月2.78±0.23a 2.74±0.18a 0.598 0.546例数39 39术前0.66±0.11 0.65±0.10 0.420 0.676术后即刻2.94±0.23a 2.89±0.22a 0.981 0.329术后9个月2.83±0.19a 2.78±0.21a 0.638 0.534
2.4 主支、分支血管LLL 两组患者在术后12 个月无论是主支还是分支血管都未出现再狭窄,但是术后12 个月药物球囊主动保护组分支血管LLL 明显低于普通球囊主动保护组,差异有统计学意义(P<0.001)。具体见表7。
表7 两组冠状动脉分叉病变患者术后12个月主支、分支血管晚期管腔丢失情况比较(mm,)
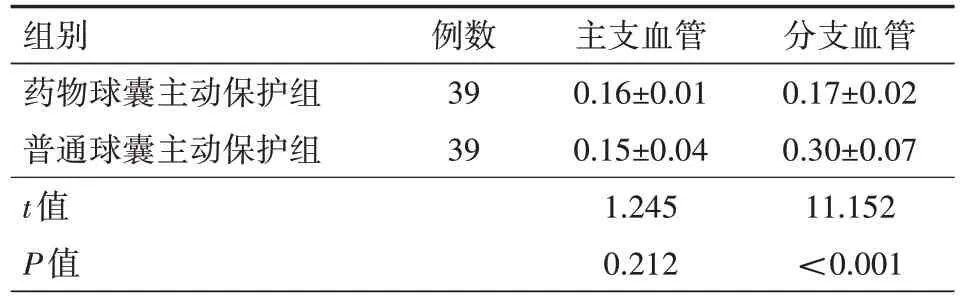
表7 两组冠状动脉分叉病变患者术后12个月主支、分支血管晚期管腔丢失情况比较(mm,)
组别药物球囊主动保护组普通球囊主动保护组t值P值例数39 39主支血管0.16±0.01 0.15±0.04 1.245 0.212分支血管0.17±0.02 0.30±0.07 11.152<0.001
3 讨 论
冠脉分叉病变一直以来都处于PCI 领域的热点和难点地位。因该部位主支血管与分支血管呈现特殊的倒“Y”字型解剖结构,并且分支血管直径较主支血管小[7]。该处血流极易形成湍流并且存在着较高的剪切力,造成分叉处极易形成动脉粥样硬化斑块,斑块负荷较其他血管部位重,容易出现血管分叉嵴移位,血栓形成概率也更高[8]。这都造成介入治疗时血管分叉处极易出现支架金属钢梁层叠,贴壁不良[9]。导致介入治疗不仅手术难度更高,而且极易出现分支血管闭塞、支架内血栓、支架内再狭窄等并发症[10]。因此在冠状动脉分叉病变的治疗中,除了要保证主支血管通畅外,如何保证分支血管通畅以及如何减少分支血管再狭窄、闭塞也同样非常重要[11-12]。目前治疗指南中推荐冠状动脉分叉病变首选使用Provisional T 技术进行治疗,即主支血管推荐置入支架,但分支血管的处理尚无定论[13-14]。大规模临床研究显示,分支血管置入支架长期疗效并无优势,并且支架内血栓和再狭窄的发生率甚至更高[15]。分支血管采用球囊主动保护技术同样也存在着损伤分支血管内膜,损伤主支血管支架药物涂层的风险,仍然存在着较高的支架内血栓和再狭窄的风险[16]。因此,本研究探讨了药物球囊主动保护技术在冠状动脉分叉病变治疗应用中的远期临床效果。
表4 两组冠状动脉分叉病变患者分支血管最小管腔直径比较(mm,)
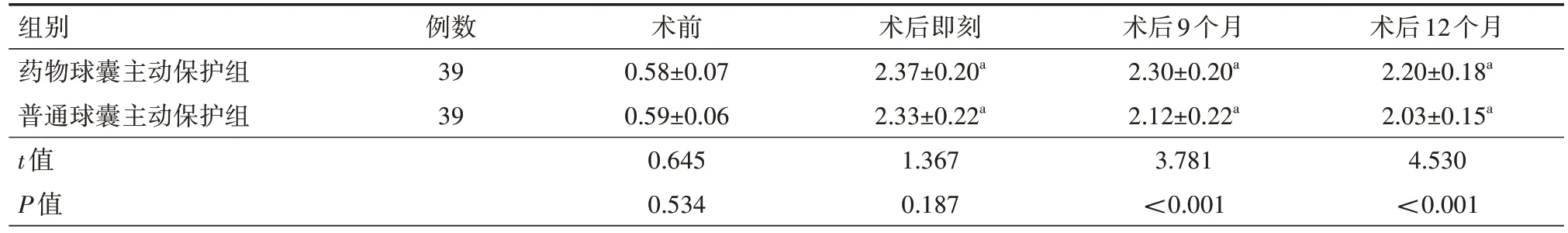
表4 两组冠状动脉分叉病变患者分支血管最小管腔直径比较(mm,)
注:a为与同组术前比较,P<0.05
组别药物球囊主动保护组普通球囊主动保护组t值P值术后12个月2.20±0.18a 2.03±0.15a 4.530<0.001例数39 39术前0.58±0.07 0.59±0.06 0.645 0.534术后即刻2.37±0.20a 2.33±0.22a 1.367 0.187术后9个月2.30±0.20a 2.12±0.22a 3.781<0.001
表5 两组冠状动脉分叉病变患者主支血管狭窄程度比较(%,)
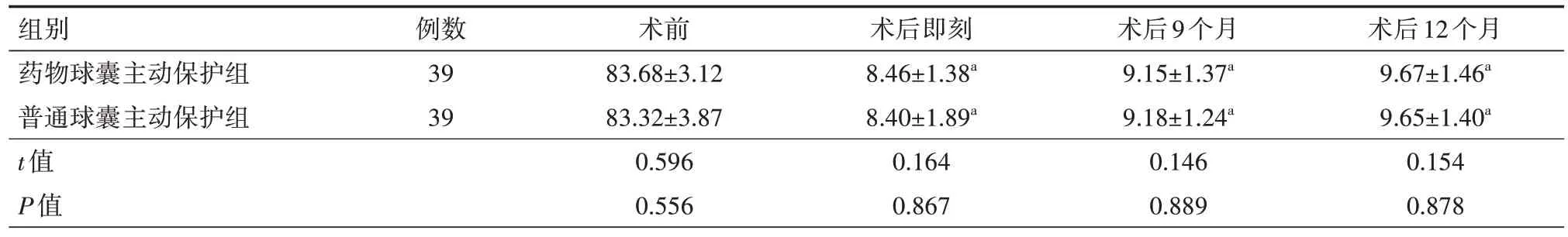
表5 两组冠状动脉分叉病变患者主支血管狭窄程度比较(%,)
注:a为与同组术前比较,P<0.05
组别药物球囊主动保护组普通球囊主动保护组t值P值术后12个月9.67±1.46a 9.65±1.40a 0.154 0.878例数39 39术前83.68±3.12 83.32±3.87 0.596 0.556术后即刻8.46±1.38a 8.40±1.89a 0.164 0.867术后9个月9.15±1.37a 9.18±1.24a 0.146 0.889
表6 两组冠状动脉分叉病变患者分支血管狭窄程度比较(%,)
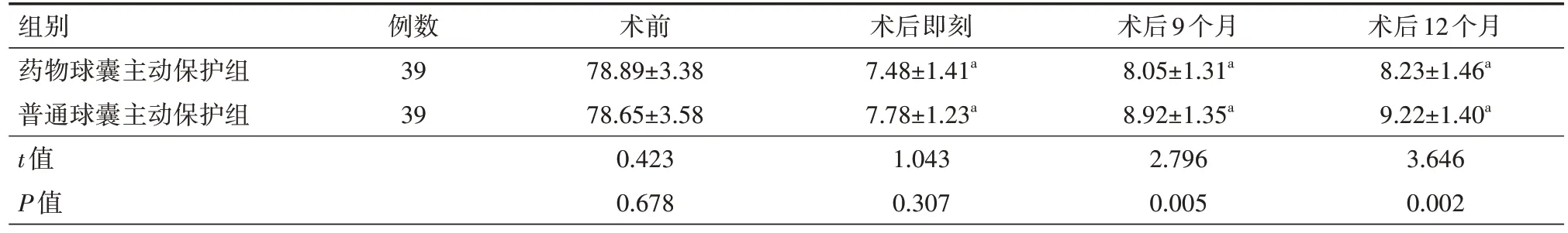
表6 两组冠状动脉分叉病变患者分支血管狭窄程度比较(%,)
注:a为与同组术前比较,P<0.05
组别药物球囊主动保护组普通球囊主动保护组t值P值术后12个月8.23±1.46a 9.22±1.40a 3.646 0.002例数39 39术前78.89±3.38 78.65±3.58 0.423 0.678术后即刻7.48±1.41a 7.78±1.23a 1.043 0.307术后9个月8.05±1.31a 8.92±1.35a 2.796 0.005
本研究将患者分为药物球囊主动保护组和普通球囊主动保护组。本研究结果表明,两组患者在术后即刻主支和分支血管血流达TIMI 3级的概率方面比较差异无统计学意义,药物球囊主动保护组MACE 发生率明显低于普通球囊主动保护组,两组患者在术后随访过程中主支血管MLD、血管狭窄程度、LLL 比较差异均无统计学意义,并且分支和主支血管都未发生再狭窄;但是术后随访过程中药物球囊主动保护组与普通球囊主动保护组相比,分支血管MLD 更高,血管狭窄程度明显更低,LLL 也明显更低。研究认为,DCB 在球囊扩张血管时释放抗增殖药物紫杉醇,可以达到抑制血管内膜增生和炎症反应[17]。与药物洗脱支架相比没有金属网络和聚合物基质等异物残留,同时药物释放也更均匀,对冠状动脉血管结构和功能影响较小[18]。与普通球囊相比可以减少分支血管内膜增生从而减少分支血管再狭窄的发生率[18-19]。药物涂层球囊在介入治疗中有较高的应用价值以及安全性。
综上所述,药物球囊主动保护技术在冠状动脉分叉病变的治疗中可以明显降低MACE 的发生,并且可以明显减少分支血管再狭窄、闭塞的发生,具有较好的临床治疗远期效果,值得在临床介入治疗中推广使用。
利益冲突:所有作者声明无利益冲突。
