蜂毒肽与多组分生物膜作用:电性与相态的影响
2021-12-27石铭芸蒋中英
石铭芸, 范 荣, 盛 洁, 朱 涛, 蒋中英,
(1.伊犁师范大学 电子与信息工程学院 微纳电传感技术与仿生器械重点实验室, 伊宁 835000; 2.南京大学 物理学院 固体微结构物理国家重点实验室, 南京 210093)
1 前 言
抗菌肽是动物体内抵御细菌的天然免疫工具[1], 具有重要的生物医学研究价值. 蜂毒肽(melittin)是典型的阳离子两亲性抗菌肽[2], 能够非特异性的靶并引发细菌死亡[3].
为理解蜂毒肽的靶向性杀伤机制, 需要理解蜂毒肽与不同生物膜作用的差异. 由于细胞细菌脂膜的复杂性, 常采用简化的仿生磷脂囊泡[4], 以其内含物的泄露来考查多肽的作用效果[5]. Lee[6]等发现, 只有蜂毒肽在膜内高于某临界浓度时, 多肽才会与磷脂组装成孔洞导致内含物泄露. 元冰[7]等实验发现, 膜-肽作用受到膜组分相态[8]等多种因素[9]的影响. 当磷脂低于主转变温度, 蜂毒肽在膜表面成孔效率显著降低. 同时, 牛葳[10]Russell[11]等认为负向膜电位磷脂会影响蜂毒肽的取向, 不易形成跨膜通道; 蜂毒肽可通过静电引力竞争性取代二价钙、镁阳离子, 实现细胞膜的渗透作用. 这些研究表明了磷脂相态、电性[12]在调控肽-膜作用中的重要性. 但是, 早先研究常采用单一组分的磷脂膜开展研究, 真实生物膜组分的多样性会如何影响肽-膜作用尚不清楚.
在本研究中, 我们利用荧光光谱等考察了蜂毒肽与单组分、多组分磷脂膜的作用机制. 结果表明, 对于不同电性与相态的单组分磷脂膜, 肽-膜作用呈现为稳定桶板型孔、非稳U型孔及变薄裂解等多种机制, 具有显著不同的内含物泄露效率. 对于多组分磷脂囊泡, 泄露性质并不是每种组分泄露性质的平均, 而主要取决于与肽具有较强亲和性的组分. 研究深化了多肽与生物膜作用的理解, 为提升多肽载药体系的释控能力提供了参考.
2 实验部分
2.1 材 料
二油酰基磷脂酰胆碱(DOPC)、二油酰基磷脂酰丝氨酸(DOPS)、二棕榈酰磷脂酰胆碱(DPPC)购于Avanti Polar Lipids. 蜂毒肽、DOPE-Rhodamine B购于Aladdin(分子结构如图1). 荧光染料为钙黄绿素, Triton TM X-100购于百灵威.
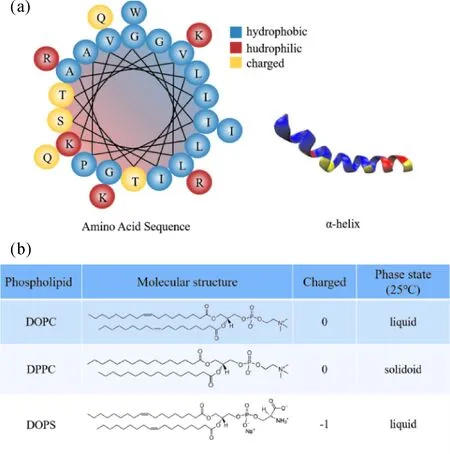
图1 蜂毒肽与DOPC、DOPS和DPPC. (a)蜂毒肽氨基酸序列. 蜂毒肽是正电性两亲多肽; 与膜结合后, 呈α-螺旋结构. (b)DOPC与DPPC为双电性磷脂, 在25 ℃分别为液相和凝胶相; DOPS为负电性磷脂.Fig. 1 Melittin and DOPC, DOPS and DPPC. (a) Amino acid sequence of melittin. melittin is a positively charged amphiphilic peptide, which transforms to α-helix when interacts with membrane. (b) DOPC and DPPC are zwitterionic phospholipids, which are in liquid and gel phases at 25 ℃, respectively. DOPS is a negatively charged phospholipid.
2. 2 囊泡制备
囊泡通过挤出法制备[13], 先用氮气流干燥混合于氯仿溶液中的磷脂使其成膜, 真空干燥6小时后加入钙黄绿素溶液(10 mM Tris, 50 mM 钙黄绿素, 375 mM 蔗糖, pH = 7. 4)水化形成多层囊泡, 通过聚碳酸酯膜挤出器(100 nm孔径滤膜)循环挤压20次获得单层囊泡. 使用Sephadex G-25凝胶过滤柱层析(GE Healthcare Life Sciences)除去未被包封的荧光染料[14].
2. 3 荧光光谱检测囊泡内荧光染料的泄露
通过Perkin Elmer LS55荧光光谱仪检测多肽诱导的钙黄绿素泄漏. 激发波长为488 nm, 发射波长为518 nm. 制备囊泡包裹的高浓度染料发生自猝灭. 逐渐滴加蜂毒肽导致膜双层结构受损, 荧光染料从囊泡中泄出稀释于外部溶液, 荧光强度增强. 基于荧光强度的变化量获取泄露百分比(Leakage%):Leakage%=[(F-FB)×100]/(FD-FB), 其中F、FB分别是添加多肽之后、之前的荧光强度,FD是使用100%泄漏的荧光强度(Triton滴定实现)[15]. 所有实验均在室温下( 25 ℃ )进行.
2.4 荧光光谱检测蜂毒肽与生物膜的结合
使用Perkin Elmer LS55检测蜂毒肽在不同磷脂囊泡表面的吸附量. 蜂毒肽中色氨酸残基的自发荧光受周边介质环境的影响. 设定激发波长为280 nm, 当肽与生物膜结合时, 荧光发射峰由352 nm向336 nm[16]红移. 基于两波长的荧光强度的比值(F336/F352)表征蜂毒肽与不同脂膜的结合量.
2.5 膜-肽作用的显微观测
将DOPE-Rhodamine B(RhB-PE)标记的不同脂质组分囊泡与蜂毒肽溶液在体相中共培养2 min, 置于全内反射荧光显微镜(TIRF, Olympus)下观察(100倍油镜, 543 nm激光器, Andor 897 EMCCD). 使用cellSens Dimension软件采集图像. 加入蜂毒肽前, 首先采集囊泡与肽作用图像. 加入蜂毒肽作用3 min后(肽浓度为8.7 μmol/L), 再次采集囊泡与肽作用图像.
3 结果与讨论
3. 1 单组分脂质体的肽致泄露
首先, 我们表征了蜂毒肽引起的DOPC、DOPS及DPPC磷脂囊泡中的荧光染料钙黄绿素的泄露. 对于DOPC(图2a), 滴加三次蜂毒肽后荧光强度开始提高, 说明达到了泄露的临界肽脂比(P/Ls= 0.03, 荧光染料开始泄露). 随着蜂毒肽的继续加入, 样品荧光逐渐增强. 直到肽脂比(P/L)达到0. 11, 后续的肽滴加无法造成荧光强度的继续提高, 说明达到了泄露的饱和肽脂比(P/Lo= 0.11, 荧光染料泄露极限). 加入Triton使囊泡解体, 发现荧光强度未进一步提高, 说明蜂毒肽实现了荧光染料的完全泄露. Alexandre[17]等计算机模拟研究发现, PC极性头与阳离子性蜂毒肽存在静电排斥, 蜂毒肽插入双层, 以桶板型与膜作用[18](图3), 可实现高效的蜂毒肽打孔与内含物的泄露. 这与我们实验观测的现象是一致的.
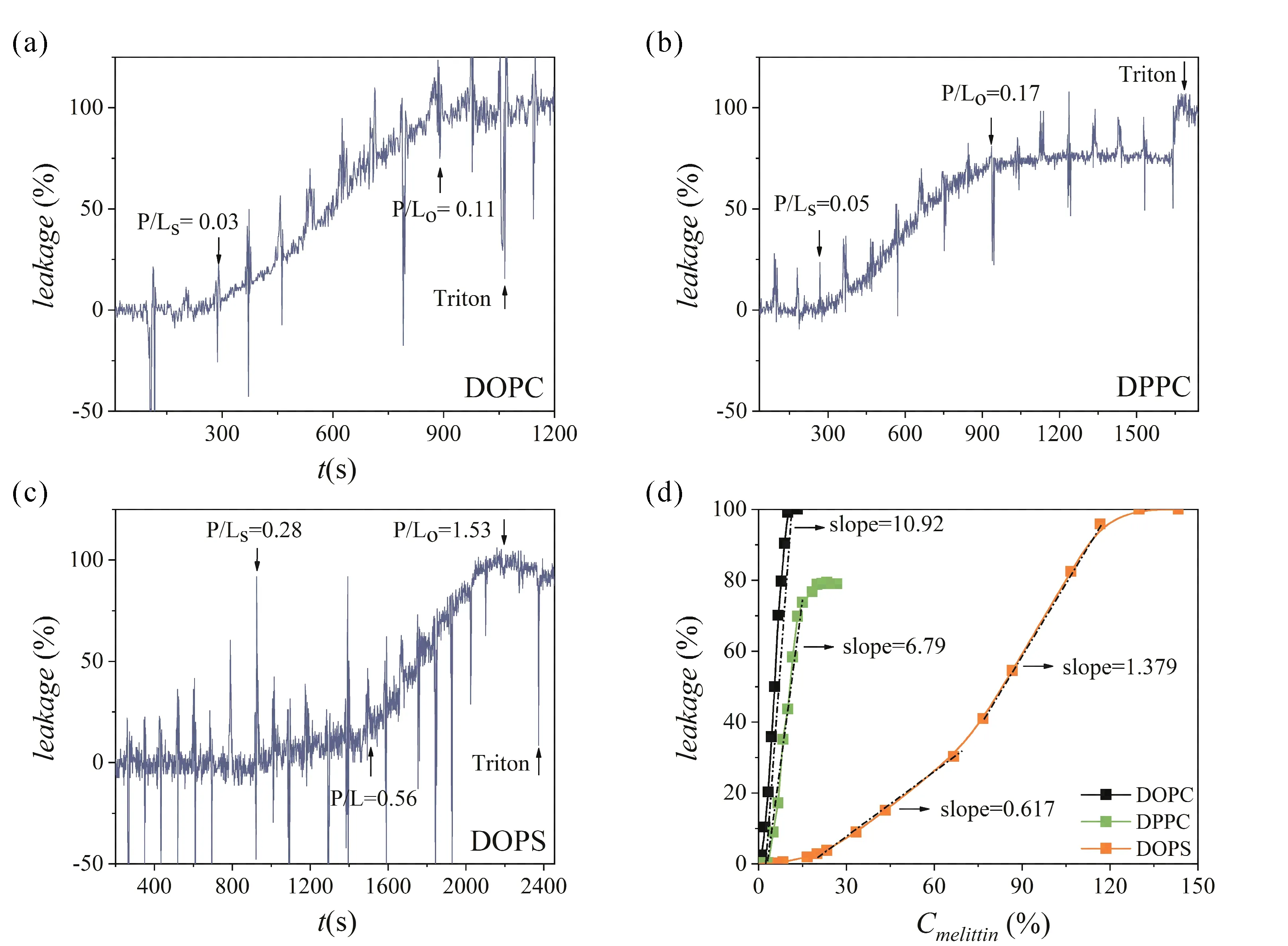
图2 (a-c) 蜂毒肽导致的囊泡内荧光染料泄露曲线. 间隔的荧光强度波动代表着蜂毒肽的逐渐滴入与肽浓度的提高. (d) 给定P/L下的平均泄露量, slope为曲线的线性拟合斜率.Fig. 2 (a-c) Melittin-induced fluorescent dye leakage in vesicles. The intermittent fluctuation of fluorescence intensity represents the gradual dripping of melittin and the increase of peptide concentration. (d) Average leakage at given P/L and its linear fitted slopes.
蜂毒肽也可造成DPPC囊泡中荧光染料的泄露. 但相较于DOPC, DPPC的P/Ls与P/Lo分别提高了67%和55%(图2b), 表明DPPC囊泡的泄露显著慢于DOPC. 图2d展示了给定P/L下的平均泄露量(三次重复实验获得)与它们的线性拟合斜率(slope).DPPC实验的slope较DOPC下降37. 8%, 即脂膜的相态影响了膜-肽的作用. Kolattukudy[19]等分子动力学模拟(MD)研究发现, 流动性差的DPPC凝胶相囊泡会影响多肽分子在膜表面的组装, 产生不稳定的U形构象孔隙, 囊泡内含物泄露速率较低. 同时, 图2b展示了蜂毒肽无法实现DPPC囊泡中荧光染料的完全泄露. 这可能是由于多肽与DPPC在孔隙处形成胶束[20], 阻碍了泄露(图3).

图3 DOPC、DOPS和DPPC囊泡与蜂毒肽的作用示意图Fig. 3 Schematic diagram of the interactions between melittin and DOPC, DOPS, DPPC vesicles.
相较于DOPC, DOPS的P/Ls与P/Lo值提高了一个量级(图2c), 与Geert[21]的报道基本一致. 进一步发现, DOPS囊泡的泄露过程呈现为两个显著差异的阶段(图2d). 阶段一(P/L在0.28~0.56), 泄漏量随多肽加入缓慢提高,slope为 0. 617; 阶段二(P/L在0.56~1.53), 泄漏量随多肽加入快速拉升,slope为1. 379. 这可能源于DOPS膜与蜂毒肽结合复杂的中间过程. 由于静电吸引, 蜂毒肽往往平铺在DOPS膜表面, 在低浓度下无法形成稳定的孔洞[22], 对应较低的slope; 直到较高浓度的多肽会对膜结构强烈的干扰(磷脂间拉伸和膜变薄), 膜的裂解造成内含物的完全泄露[23](图3), 造成较高的slope.
3. 2 二元混合组分脂质体的肽致泄露
随后, 选用二元脂质DOPC/DPPC(1:1)和DOPC/DOPS(1:1), 观测蜂毒肽造成它们包裹的荧光染料泄露. 如图4b所示, DOPC/DPPC的P/Ls和P/Lo分别为0. 03、0. 08. 显著性差异分析表明, 相较于DPPC(P/Ls=0.05,P/Lo=0.17), DOPC(P/Ls=0.03,P/Lo= 0.11)与DOPC/DPPC(1:1)的P/Ls及P/Lo值差异性较低(图4ef), 表明后两者的肽致泄露性质相似. 如混合组分的泄露性质是每种组分泄露性质的平均, 则DOPC/DPPC(1:1)的P/Ls、P/Lo应为0.04、0.14, 这与实验获得的数值并不相符. 为理解该现象, 通过荧光光谱的F336/F352表征了DOPC、DPPC磷脂囊泡上蜂毒肽的吸附量. 由图4a所示, 随着P/L的提高, DOPC的F336/F352快速增长并最终平衡在0. 98, 表明绑定在膜表面的蜂毒肽含量提高并逐渐饱和. 相较于DOPC, DPPC的F336/F352增长较慢, 平衡值较低(0. 947), 表明DPPC对蜂毒肽的结合能力低、亲和力弱. DPPC脂膜中分子间范德华疏水作用较强[24], 磷脂排布较紧密, 不利于两亲性蜂毒肽的结合. 因此蜂毒肽更利于与DOPC组装, 导致DOPC/DPPC表现出与纯DOPC囊泡相近的泄露性质.
而相较于DOPC, DOPC/DOPS(1:1)的P/Ls与P/Lo分别提高一个量级以上. 显著性差异分析表明, DOPC/DOPS(1:1)与DOPS的泄露性质差异性较低(图4c). 并且, DOPC/DOPS的泄露呈现为三个显著差异的阶段, 分别对应着slope 0. 072、1. 47、0. 54, 说明DOPC/DOPS的泄露是多阶段过程(图4d), 也与DOPS相似. 继而表征了DOPC与DOPS磷脂囊泡表面的蜂毒肽吸附量. 由图4a所示, 相较DOPC, DOPS脂膜上蜂毒肽吸附更快, 平衡吸附量更大. 在实验pH值下, DOPC的两性离子头基显电中性, 而DOPS的负电性头基显负一价. 由于静电吸引, 后者更易与正电性的蜂毒肽分子结合. 因此蜂毒肽更利于与DOPS组装, 导致DOPC/DOPS表现出与纯DOPS囊泡相近的泄露性质.
3. 3 DOPC/DOPS(1:1)囊泡的膜-肽作用观察
图5展示了RhB-PE标记的DOPC、DOPS以及DOPC/DOPS(1:1) LUVs模型与蜂毒肽作用前后的荧光显微镜图. 加入蜂毒肽之后, DOPC囊泡尺寸无明显变化, 表明DOPC采用对脂膜完整性影响较小的成孔机制, 造成内含物泄露; 而对于DOPS及DOPC/DOPS(1:1)囊泡, 蜂毒肽的加入均造成了它们尺寸的显著提高, 表明结合蜂毒肽导致了它们内部磷脂间的拉伸与表面积增大. 这验证了膜变薄导致的膜失稳在后两者内含物泄露的重要作用.
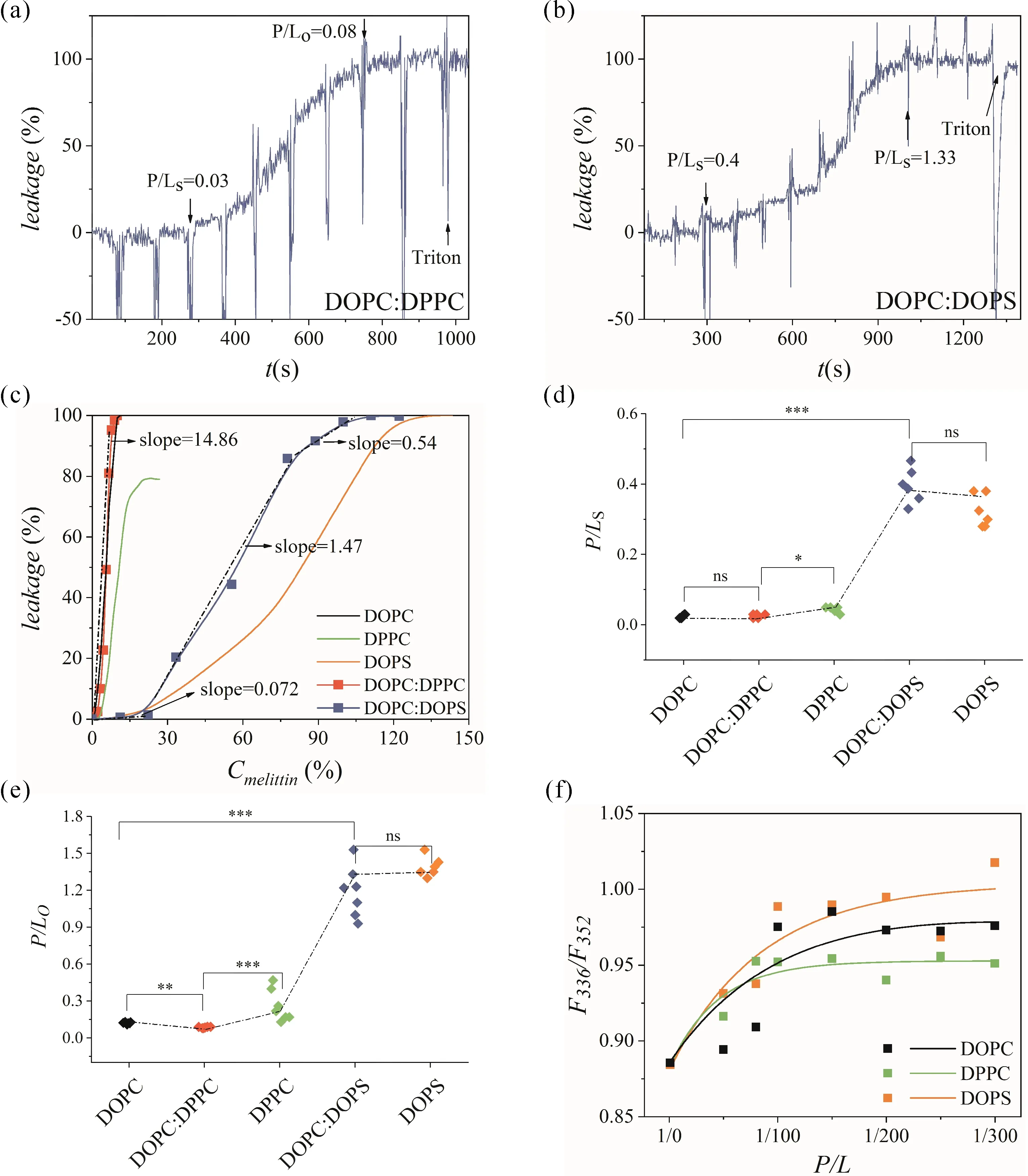
图4 (a-b)蜂毒肽导致的囊泡内荧光染料泄露曲线. (c) 给定P/L下的平均泄露量. (d-e) 单组分与混合组分囊泡的P/Ls 和P/Lo显著性差异分析(p值通过t检验获得:ns p> 0.05, * p< 0.05, **p< 0.01, ***p< 0.001). (f) 基于F336/F352表征蜂毒肽在DOPC、DPPC、DOPS膜表面的吸附量.Fig. 4 (a-b) Melittin-induced leakage curve of fluorescent dyes in vesicles. (c) Average leakage at a given P/L. (d-e) Statistical significance analysis of P/Ls and P/Lo values (p value was calculated using multiple t-test:ns p> 0.05, * p< 0.05, **p< 0.01, ***p< 0.001). (f) Attachment of melittin to DOPC, DPPC, and DOPS membranes characterized by F336/F352.

图5 DOPC、DOPS和DOPC/DOPS(1:1) LUV与肽作用的荧光显微图像. 左侧图像为作用前的囊泡, 右侧图像为作用后的囊泡.Fig. 5 Fluorescence microscopic images of the interactions between melittin and DOPC, DOPS, and DOPC/DOPS (1:1) vesicles. The left and right images display the vesicles before and after the addition of peptides.
4 结 论
在本研究中, 我们利用荧光光谱考察了蜂毒肽与仿生磷脂膜的作用机制. 单组分磷脂囊泡的泄漏实验表明, 蜂毒肽与不同相态、电性的生物膜作用机制是具有显著区别的:在液晶双电性磷脂膜中, 出现桶板型孔洞, 实现高效的泄露; 在凝胶相双电性磷脂膜中, 产生不稳定的U形孔隙, 囊泡内含物的泄露速率较低; 在负电性磷脂膜中, 呈现了肽平铺与膜变薄裂解两个作用阶段, 多肽导致的泄露最低效. 多组分磷脂囊泡的泄露实验表明, 泄露由肽亲和性较强的磷脂组分决定. 液晶-凝胶相混合磷脂囊泡中, 液相磷脂与肽的亲和性强, 混合组分膜与纯液相磷脂膜的泄露效率相近; 双电性-负电性混合磷脂囊泡中, 负电性磷脂与肽的亲和性强, 混合组分膜与纯负电性磷脂膜的泄露效率相近. 研究深化了多肽与生物膜作用的理解, 为提升多肽载药体系的释控能力提供了参考.
