紧密连接蛋白Occludin通过ANKRD37调控膀胱癌自噬的机制研究
2021-12-27何建忠
杨 帆,何建忠,刘 野
(中山大学附属第五医院 病理科,广东 珠海519000)
紧密连接结构是位于细胞表面用于连接相邻细胞之间的动态变化结构,紧密连接结构功能的失调或者破坏导致肿瘤细胞环境稳态改变,在肿瘤发生中有极大的影响作用[1]。OCLN作为紧密连接蛋白家族中的一员,发挥着稳定紧密连接结构的作用[2]。相关研究报道证实,OCLN在非小细胞肺癌、卵巢癌、肾透明细胞癌等众多实体肿瘤中均有异常表达,与肿瘤的发生密切相关[3-5],但是目前为止OCLN与膀胱癌的关系研究甚少。
自噬与肿瘤的关系十分复杂,目前尚未完全阐明。有研究证实,自噬在肿瘤发生中发挥的作用是相互矛盾的,长期抑制自噬会促进癌基因表达;而当肿瘤一旦形成,自噬受到抑制时却可增强药物治疗效率以及减弱肿瘤对药物的抵抗作用[6-7]。在膀胱癌中,自噬的调控机制仍不甚清楚,找到影响膀胱癌自噬的靶标有望为膀胱癌治疗提供新的思路。
目前针对紧密连接蛋白OCLN与膀胱癌自噬的关系尚不明确,本研究旨在探讨OCLN在膀胱癌中的表达情况及其对膀胱癌细胞自噬的影响,为膀胱癌的临床治疗提供理论依据。
1 资料与方法
1.1 样本来源
收集中山大学附属第五医院2016年1月至2020年12月病理诊断为膀胱尿路上皮癌的患者37例(其中3例包括对应的癌旁组织)。患者年龄范围41岁至88岁,平均年龄69.48±9.95岁,男女比例17.5∶1,纳入标准:(1)膀胱尿路上皮癌的临床诊断标准参考人民卫生出版社《外科学》第9版; (2)所有患者均在本院接受手术治疗且术前均未接受放化疗治疗,临床分期为Ⅰ期-Ⅳ期。排除标准:(1)转移性膀胱癌;(2)既往有放化疗史;(3)合并其他部位恶性肿瘤。
1.2 细胞与主要试剂
T24膀胱癌细胞及293T细胞受赠于中山大学医学院张幸鼎教授课题组,RPMI 1640及DMEM培养基购自美国Gibco公司, lipofectamineTM3000购自美国Invitrogen公司,qRT-PCR中所需的试剂盒购买于日本Takara公司, P62兔单克隆抗体购买于美国ABClonal公司,LC3B兔多克隆抗体购买于美国Sigma公司,HSP90鼠单克隆抗体及OCLN鼠单克隆抗体购买于ProteinTech公司(武汉),山羊抗兔及马抗鼠二抗均购买于美国Cell Signaling Technology(CST)公司。
1.3 实验仪器
二氧化碳细胞培养箱(Thermo); NanoDrop和实时荧光定量PCR仪(Thermo Fisher Scientific);垂直电泳仪、转膜仪和凝胶成像系统(Bio-Rad)。
1.4 主要方法
1.4.1免疫组化及评分标准 免疫组化采用二步法,实验步骤如下:切成石蜡切片,经脱蜡水化并进行抗原热修复,消除内源性过氧化物酶后,4℃孵育OCLN一抗过夜(1∶100稀释)。第2天经PBS浸洗后,按照PV9000二抗试剂盒说明书规范操作孵育二抗,DAB显色后经过苏木素染色,脱水,最后中性树脂封片。评分采用组织化学评分法。
1.4.2OCLN慢病毒构建 设计OCLN相应的敲降引物序列,将酶切好的PLKO.1载体与引物通过T4 DNA ligase连接酶进行连接。连接产物转化至Stbl3感受态并涂于氨苄青霉素抗性的LB琼脂糖平板上,37℃孵育过夜后挑选单克隆菌落,经DNA测序确定与Genebank中OCLN基因的敲降序列完全相符,将菌液扩增提取质粒。所提取的质粒与包装质粒PMD2.G/PSPAX2用转染试剂共转染至293T细胞,培养48 h后收集上清,将上清液3 500 r/min,离心5 min,再用0.45 μm过滤器过滤,得到病毒,-80℃保存,用于后续实验。
本文所用引物如下:
shNC正向引物:
5′-CACCGTTCTCCGAACGTGTCACGTTT-
CAAGAGAACGTGACACGTTCGGAGAATTTT-
TTG-3′
shNC反向引物:
5′-GATCCAAAAAATTCTCCGAACGTGTCACGTTCTCTTGAAACGTGAACGTTCGGAG-
AAC-3′
shOCLN-1正向引物:
5′-CGGGCACCAAGCAATGACATATATC-
TCGAGATATATGTCATTGCTTGGTGC TTT-
TTG -3′
shOCLN-1反向引物:
5′-AATTCAAAAAGCACCAAGCAATGAC-
ATATATCTCGAGATATATGTCATTGCTTGG-
TGC -3′
shOCLN-2正向引物:
5′-CCGGGGATGACTATAGAGAAGAAAG-
CTCGAGCTTTCTTCTCTATATCATCCTTTT-
TG -3′
shOCLN-2反向引物:
5′-AATTCAAAAAGGATGACTATAGAGA-
AGAAAGCTCGAGCTTTCTTCTCTATAGTCA-
TCC-3′
1.4.3OCLN过表达质粒构建 根据 OCLN的基因序列(NCBI Gene ID:100506658)设计上游引物为5’-TTTAAACTTAAGCTTGGTACCATGTC-
ATCCAGGCCTCTTGA-3’,下游引物为5’-GTCATCCTTGTAATCGAATTCTGTTTTCTGTC-
TATCATAGT-3’。以293T细胞的cDNA为模板进行PCR扩增,将PCR产物与酶切后pcDNA3.1载体连接重组,转化至DH5α感受态并涂于氨苄青霉素抗性的LB琼脂糖平板上,37 ℃过夜后,挑选单克隆菌落鉴定为阳性克隆后送DNA测序,与GeneBank中的OCLN基因序列完全相符,之后将菌液扩增提取质粒,用于后续实验。
1.4.4细胞培养及分组 T24细胞用RPMI 1640培养基,在温度为37℃,体积分数5% CO2饱和湿度的环境中贴壁培养。传代时以2.5×105个/孔的细胞数量接种在6孔培养板中,随机将细胞分为3组,分别用对照组,shOCLN-1和shOCLN-2慢病毒感染,24 h之后,用0.5 mg/L嘌呤霉素筛选稳转的细胞株,后经qRT-PCR和Western blot检测,感染成功的各组细胞用于后续实验。瞬时转染细胞时,按照转染试剂说明书分别配置含有pcDNA3.1-Vector质粒和pcDNA3.1-OCLN质粒的转染液,转染后于37℃培养箱中培养24 h,得到对照组和过表达OCLN组的细胞进行后续实验。
1.4.5RNA提取及qRT-PCR检测mRNA的表达 按照Trizol裂解液说明书步骤提取RNA,按照反转录试剂盒的标准实验步骤反转录RNA获取样本cDNA。采用SYBR Green法对目的基因进行相对定量,按照说明书加样后,将标本置于StepOnePlus PCR反应仪内,反应条件为初始变性95℃,30 s;95℃,5 s,60℃,30 s共40个循环。采用2-ΔΔCt法计算OCLN,ANKRD37、FLRT2的相对表达量,引物设计见表1。
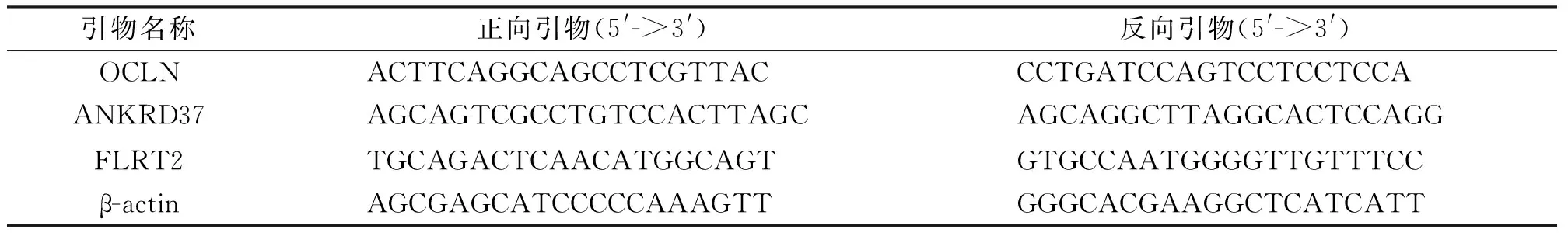
表1 引物设计
1.4.6OCLN、LC3B及P62蛋白表达检测 分组处理后收集细胞,去掉培养基之后用预冷的PBS液洗涤,冰上裂解,每10 min振荡1次,共3次,4 ℃条件下12 000 r/min离心15 min,提取总蛋白。后进行SDS-PAGE凝胶电泳实验,5%脱脂牛奶室温封闭1 h, P62(1∶1 000)、LC3B(1∶1 000)、OCLN(1∶1 000)、HSP90(1∶5 000)一抗4 ℃过夜;次日,用0.5% PBST洗膜3次,每次10 min,室温孵育二抗(1∶2 000)1 h,用0.5% PBST同样条件下洗膜3次,加入显影液,在化学显影仪中曝光。 用Image J软件对条带进行灰度分析,以对照组HSP90为参照,测定各组条带的相对表达量。
1.5 统计学方法
运用SPSS 20.0对数据进行统计学分析。采用Shapiro-Wilk(S-W)方法进行正态分布检验,符合正态分布则采用独立样本t检验比较两组间均值差异;如果不符合正态分布,则采用非参数秩和检验分析。检验水准α=0.05(双尾)。当P<0.05时,认为差异具有统计学意义。
2 结果
2.1 OCLN mRNA及蛋白在膀胱癌组织中的表达情况
利用TCGA数据库分析膀胱癌中OCLN mRNA的表达情况,结果显示随着膀胱癌病理分期的提高,OCLN表达水平明显上调(图1A)。通过对免疫组化结果进行分析,相对于癌旁组织,OCLN蛋白在癌组织的表达量明显上升(图1B),且随着膀胱癌病理分期的提高显著上升(图1C和表2)。
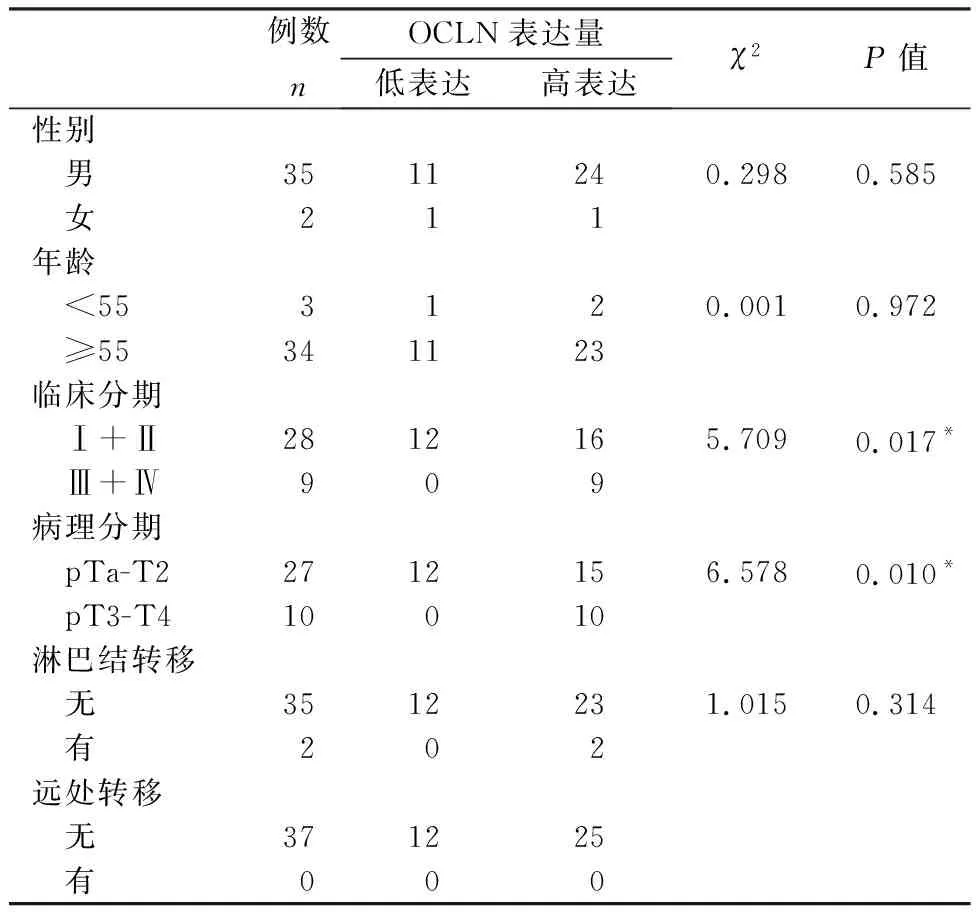
表2 膀胱癌OCLN蛋白表达情况与临床表征的关系

图1 OCLN在膀胱癌组织中的表达情况
2.2 慢病毒介导OCLN在T24细胞系中表达水平检测
制备的慢病毒转染膀胱癌T24细胞系,通过蛋白印迹法检测细胞中的蛋白表达情况,分析其敲降效果(图1A,B)。结果显示,以对照组shNC组作为参照,shOCLN-1组和shOCLN-2组OCLN蛋白的表达量分别为0.7519±0.1438,0.7319±0.1235,实验组与对照组间差异明显,差异有统计学意义,P=0.0037,P=0.0019;通过实时荧光定量法检测细胞中的mRNA变化情况,结果显示以对照组shNC组作为参照,shOCLN-1组和shOCLN-2组OCLN的mRNA表达量分别为0.3047±0.05578,0.4789±0.06215,实验组与对照组间差异明显,差异有统计学意义,P=0.0075,P=0.0172(图2C)。提示慢病毒的沉默效果可信,可以降低人T24细胞系中OCLN的表达水平。
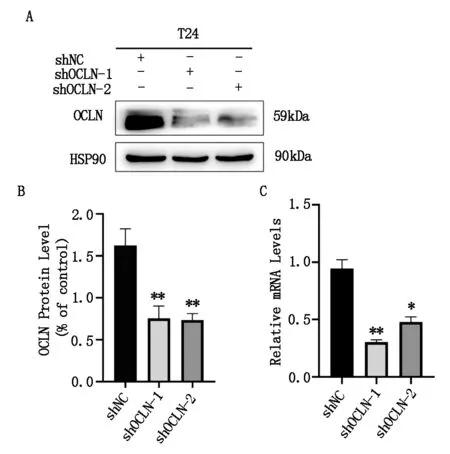
图2 慢病毒介导OCLN在T24细胞系中低表达效率检测
2.3 OCLN在T24细胞中调控细胞自噬水平
首先了解自噬在膀胱癌中的变化情况,通过TIMER2.0(图3 A)和GEPIA (图3 B)数据库分析LC3B在膀胱癌中的表达情况,结果显示在膀胱癌中
LC3B的表达量低于癌旁组织,膀胱癌中的自噬水平降低。通过免疫印迹法进一步验证,分别检测稳定敲降及过表达OCLN的T24细胞系中P62和LC3B的变化水平。结果显示,在稳定敲降OCLN的T24细胞系中,shOCLN-1组和shOCLN-2组中的LC3BⅡ/Ⅰ蛋白的比值明显提高(P=0.0107,P=0.0008),同时P62蛋白的表达水平降低(P=0.0382,P=0.0327)(图3C);而过表达OCLN后, P62蛋白的表达水平升高(P=0.0049),LC3BⅡ/Ⅰ的比值降低(P=0.0238)(图3D)。以上结果提示OCLN与膀胱癌自噬关系密切,且OCLN可以调控膀胱癌细胞系T24的自噬水平:敲降OCLN能提高T24细胞系自噬水平,反之,过表达OCLN能降低T24细胞系自噬水平。LC3BⅡ/Ⅰ蛋白灰度分析如图3 E所示,P62蛋白灰度分析如图3 F所示。

图3 OCLN在T24细胞中调控细胞自噬水平
2.4 OCLN影响与自噬相关ANKRD37基因的表达
为近一步探究OCLN调控膀胱癌自噬的机制,将敲降了OCLN的T24细胞系进行RNA-Seq测序,分析结果显示有22个与自噬相关基因(图4A)。通过条件筛选之后(P<0.05,FDR<0.01,|log2FC|>1)仅有13个基因(C15orf38-AP3S2,PHOSPHO2-KLHL23,CDC42EP5,GRIP1,FLRT2,GPR160,ANKRD37,NOV,SLC22A15,TENM3,CRELD1,ATF7IP2, MFSD14C)符合筛选条件,其中4个基因(PHOSPHO2-KLHL23,CDC42EP5, SLC22A15, MFSD14C)与OCLN无相关性,2个基因(C15orf38-AP3S2,NOV)未能在数据库中检索发现。为了进一步验证,采用qRT-PCR检测分别敲降和过表达OCLN之后在T24中剩余基因的表达情况,仅有ANKRD37和FLRT2两个基因在敲降了OCLN之后细胞中的表达较稳定(图4 B),其余基因未做展示;但在过表达OCLN之后的T24细胞系中检测发现FLRT2的表达效果不稳定,这部分未做展示。OCLN与ANKRD37相关性分析见图4 C。qRT-PCR结果显示OCLN敲降组ANKRD37的表达水平低于对照组(P=0.0108,P=0.0183)(图4 Bii),OCLN过表达组的ANKRD37表达水平高于对照组(P=0.0238)(图4 D),说明ANKRD37可能为OCLN调控的自噬相关的下游基因。
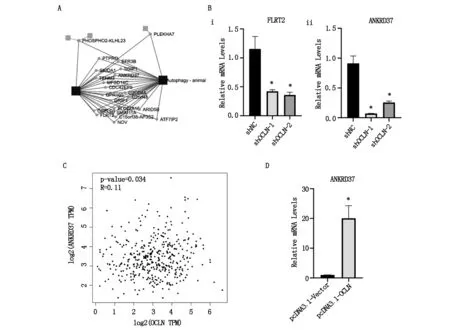
图4 OCLN影响与自噬相关ANKRD37基因的表达
3 讨论
膀胱癌是我国常见的泌尿系统恶性肿瘤,在所有肿瘤中发病率居第9位[8],男性发病率和死亡率均高于女性[9],是造成我国男性患者死亡的第六大因素[10]。目前,根据临床病理分期,临床上主要采取卡介苗BCG膀胱内灌注免疫治疗,手术切除以及以顺铂为基础的化学药物治疗[11-12],但是由于对化疗药物易产生耐药性,在40年的治疗随访中,5年生存率仅提高了5%-8%,且不良反应较多[13]。因此,通过研究膀胱癌的发病机制,寻找有效的治疗靶点是亟待解决的问题。
紧密连接蛋白与多种肿瘤关系密切,研究表明,紧密连接结构在不同肿瘤中发挥着不同作用[14-15]。作为第1个被发现的紧密连接家族成员,OCLN在稳定紧密连接结构中发挥重要作用的同时也与多种肿瘤的发生及发展关系密切。OCLN在子宫内膜癌中低表达,可导致细胞极性消失,提示OCLN可能是引发子宫内膜癌的重要蛋白[16]。在肺癌中,OCLN通过AKT/PI3K通路调控细胞凋亡,抑制了OCLN的表达之后肺癌细胞的增殖也受到抑制[17]。而OCLN与膀胱癌的关系及其作用机制目前研究甚少。本研究首先通过TCGA数据库分析发现膀胱癌中OCLN mRNA的表达与膀胱癌病理分期密切相关。为了进一步证实OCLN与膀胱癌的关系,本研究通过免疫组化染色,对37例膀胱癌临床样本的OCLN蛋白表达进行定量分析,结果发现OCLN蛋白水平的表达随着膀胱癌病理分期的提高而上升。
目前大量研究证实自噬与肿瘤密切相关且作用复杂。自噬是一种肿瘤抑制机制,临床上目前使用的许多抗癌药物会诱导肿瘤细胞发生自噬,同时自噬也作为某些抗癌药物杀伤肿瘤细胞的重要机制[18-19]。也有研究表明自噬可促进肿瘤进展,例如缺氧的肿瘤组织会诱导自噬并促进这些恶性肿瘤细胞的存活,导致放疗化疗不敏感[20]。自噬与膀胱癌的关系目前研究较少,Liu[21]等研究发现,与肿瘤相关的自噬基因beclin1的表达在膀胱癌中与患者的临床分期呈现负相关性,在膀胱癌中自噬受到抑制。也有研究证实,激活了膀胱癌细胞的自噬后,可抑制肿瘤细胞的增殖或促进细胞凋亡,从而起到治疗肿瘤的作用[22]。
目前为止,OCLN调节自噬在肿瘤,尤其在膀胱癌中的作用未见报道。本文就OCLN对膀胱癌自噬的影响进行探讨性研究。首先通过数据库分析发现,高级别的膀胱癌组织中OCLN表达水平高于低级别的膀胱癌组织,同时LC3B在癌组织中的表达量低于癌旁组织。那么OCLN与膀胱癌的自噬作用是否存在一定相关性,为了证实这一推测,首先通过细胞转染分别敲降和过表达T24细胞系中的OCLN,并通过Western blot实验检测P62,LC3B的表达变化,结果显示,敲降OCLN之后,P62蛋白表达量降低,LC3BⅡ/Ⅰ的比值增大,提示在T24中敲降了OCLN的表达之后,细胞自噬增强;相反,过表达OCLN 之后,P62表达升高,LC3BⅡ/Ⅰ的比值下降,细胞自噬受到抑制。通过以上实验结果表明OCLN是调控膀胱癌自噬的重要蛋白。
为了进一步探讨OCLN调控自噬的机制,通过对敲降OCLN的T24细胞系进行RNA-Seq测序,结果发现,在敲降OCLN之后的T24细胞系中,其与自噬相关的基因也发生相应的变化,其中变化最显著的是Ankyrin repeat domain protein(ANKRD)。在肠癌中ANKRD37的异常高表达与肠癌患者的不良预后呈明显正相关,在调控细胞核内缺氧诱导的癌细胞自噬中发挥着重要作用[23]。通过qRT-PCR检测后发现,在敲降OCLN之后的T24细胞系中,ANKRD37mRNA水平显著下降,而在过表达OCLN的T24中,ANKRD37mRNA水平明显升高,因此推测ANKRD37可能是OCLN影响膀胱癌自噬的重要靶基因。
综上所述,OCLN在膀胱癌中高表达,抑制OCLN的表达可促进膀胱癌细胞的自噬作用,进而影响了膀胱癌的发生发展,而ANKRD37可能是OCLN影响膀胱癌自噬作用的重要靶基因。
