肝胆期肝实质MRI的放射组学对小肝癌的预测价值
2021-12-27姜宇晴张孟超
姜宇晴,张孟超
(吉林大学中日联谊医院 放射科,吉林 长春130033)
肝硬化患者是发生肝细胞癌的高风险人群,需要定期检查以尽早发现肝细胞癌并进行治疗,从而提高其生存率[1-3]。现阶段的筛查方式敏感性低,仍存在质疑[4-5]。钆塞酸二钠(Gd-EOB-DTPA)是一种肝胆特异性对比剂,有研究表明,对Gd-EOB-DTPA增强MRI的肝胆期肝实质图像进行直方图分析,可以较为准确的评估肝硬化程度[6-7]。而放射组学分析包含直方图分析。因此,我们推测放射组学分析同样可以根据肝胆期肝实质图像对肝硬化程度进行评估,且有可能根据肝硬化程度与小肝癌发生的相关性,对小肝癌的发生进行预测。Gd-EOB-DTPA增强MRI在发现小肝癌方面具有更高的敏感性[8]。在此基础上,若肝胆期肝实质MRI的放射组学能够实现对小肝癌的预测,将为肝硬化患者随访监测小肝癌提供更好的选择。本研究将主要研究肝胆期肝实质MRI的放射组学对病毒性肝炎肝硬化患者发生小肝癌的预测价值。
1 材料与方法
1.1 研究对象
初始共搜集了292例在Gd-EOB-DTPA增强MRI检查中有明显肝硬化影像学表现的患者,时间跨度为2014年10月至2018年6月。排除标准如下:①接受过抗癌治疗,无论何种形式(n=104);②非病毒性肝炎引起的肝硬化(n=28);③患有会影响肝功能的全身性疾病或肝功能Child -Pugh分级为C级(n=11);④图像中存在伪影,干扰肝实质ROI的采集(n=5);⑤肝实质内同时存在肝细胞癌以外的恶性肿瘤(n=13);⑥存在的肝细胞癌直径>3cm(n=39)。最终得到92个病例。根据是否存在肝细胞癌,将病例分为两组:无肝癌组(n=44)和小肝癌组(n=48)。收集每位患者的以下临床信息:诊断年龄、性别、病毒性肝炎类型以及肝功能Child-Pugh分级情况,留待分析。测量并记录小肝癌组患者肝细胞癌的大小。因缺乏组织活检结果,本研究中肝细胞癌的诊断以影像学表现为标准,即病灶呈“快进快出”的典型强化方式,这一诊断标准符合中国原发性肝癌诊断和治疗指南(2017年版)中对肝细胞癌的临床诊断要求[9]。
1.2 图像采集
1.3 图像分析、临床信息比较
由两名高年资影像科医生在医学影像信息系统(PACS)工作站上对所有初始纳入病例的Gd-EOB-DTPA增强MRI进行独立盲法阅片,严格遵照排除标准筛选出最终的研究人口并进行分组,当两名医生的意见发生冲突时,则与另外1名高年资医生协商一致后进行确定。
1.4 图像处理、感兴趣区选取及放射组学特征提取
将两组病例的肝胆期MR图像以DICOM格式从PACS工作站导出,用A.K.软件(Artificial Intelligence Kit,A.K.,GE Healthcare,China)进行图像的预处理,这一过程可以校正不同MRI扫描仪、不同患者造成的图像差异。
随后进行感兴趣区域(ROI)的选取,由1名对临床信息及分组情况均不知情的高年资医生在 ITK-SNAP软件(http://www.itk-snap.org/) 中进行。ROI的选取原则:直径=30像素的圆形,位于临近肝门区层面的肝右叶,确保完全避开肝内的局灶性病变(如囊肿、血管瘤、癌灶等),同时要尽可能避免与肝内的主要血管、胆管重叠。
特征的提取在A.K.软件中进行,需将图像及ROI一一对应导入。一共可提取出385个特征,分为3类:(1)42个直方图特征;(2)9个形态学特征;(3)334个纹理特征,包括灰度共生矩阵(GLCM)、灰度行程矩阵(GLRLM)、灰度区域大小矩阵(GLZSM)。
1.5 数据划分、特征选择及预测模型构建
首先需处理特征值数据中的异常值,具体方法是用中位数替代异常值;然后以7∶3为分割比例,令计算机随机选取70%的样本作为训练集,用于特征选择并建立机器学习模型,30%的样本作为验证集,用于检验模型的准确性;最后对两组数据进行标准化处理(Standardization)。
特征选择的过程中,对数据依次进行了组间统计学差异检验、单因素Logistic回归及spearman相关性分析(threshold=0.8)。最终选取出的组学特征可重复性和稳定性均较高,可用来建立机器学习模型。
机器学习模型的建立以多元logistic回归模型作为分类器。用ROC曲线来说明放射组学特征的诊断性能,在训练集和验证集中分别计算ROC曲线下面积(AUC)、准确度、特异度、灵敏度作为评价指标,来评估分类器的性能。最后用DeLong’s test比较训练集和验证集AUC的差异。
以上过程均在R Studio(Version 1.0.143-Ⓒ 2009-2016 R Studio,Inc.)中进行。
1.6 统计学分析
对无肝癌组及小肝癌组患者的临床信息进行统计学分析,用t检验来比较两组患者的年龄有无差异,而性别、病毒类型及肝功能情况的比较选用卡方检验进行,上述方法均在P<0.05时表明两组数据存在统计学意义的差异,这一过程使用SPSS 22.0软件进行计算。
2 结果
2.1 基本临床信息
无肝癌组及小肝癌组的临床特征见表1, 统计分析结果表明,两组患者性别、年龄、病毒性肝炎类型的差异没有统计学意义(P>0.05);肝功能的差异有统计学意义(P<0.05),小肝癌组中肝功能为Child-Pugh B级的肝硬化患者多于无肝癌组。
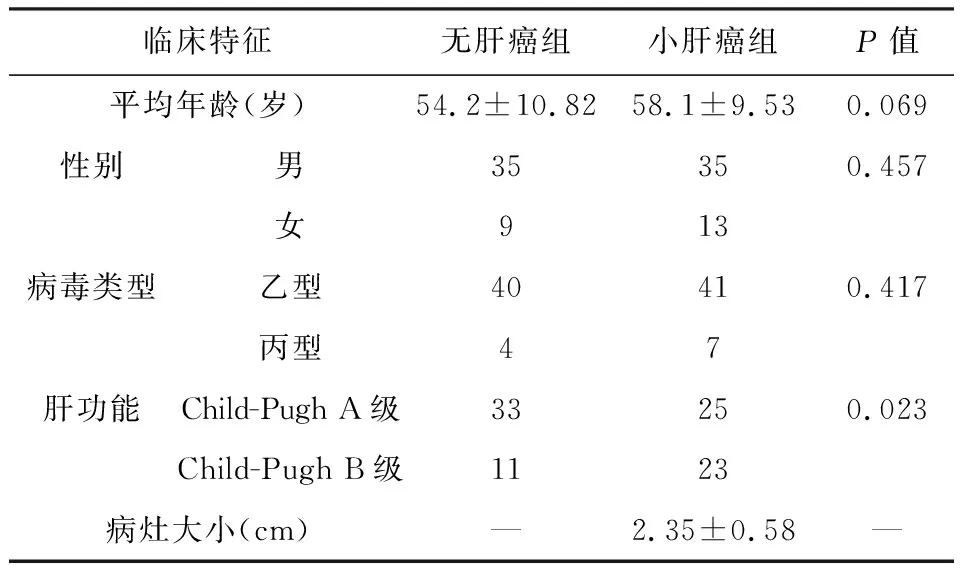
表1 患者的临床特征分析
2.2 数据划分及特征选择
训练集和验证集的数据划分如表2所示,通过二分类法,设置无肝癌组为0,小肝癌组为1。

表2 训练集和验证集的分配
特征选择时,进行组间统计学差异检验后,从385个组学特征中筛选出了94个特征,而第二步单因素Logistic回归后,剩余65个特征,然后运用spearman相关性分析进一步去冗余,最终得到7个组学特征,如表3所示。

表3 特征选择结果
2.3 预测模型构建
基于7个组学特征,用多元逻辑回归的方法建立机器学习模型并验证。训练集和验证集的ROC曲线分析结果如图1所示,训练集的AUC为0.809(95%CI:0.703-0.915),验证集的AUC为0.805(95%CI:0.643-0.967),并计算两组的准确度、灵敏度及特异性以评估模型的性能(表4)。最后用 DeLong’s test 对两组的AUC进行差异检验,得到P值=1.0,表明训练集与验证集之间的AUC不存在统计学差异,一致性好。

图1 训练集和验证集的ROC曲线分析结果

表4 训练集和验证集 logistic 回归模型分析结果
3 讨论
本研究对病毒性肝炎肝硬化患者的肝胆期肝实质图像进行放射组学分析,从而构建出了病毒性肝炎肝硬化患者发生小肝癌的预测模型,并用ROC曲线对其进行评估:训练集的AUC=0.809,说明该模型能够对病毒性肝炎肝硬化患者发生小肝癌进行较好的预测;而验证集的AUC=0.805,与训练集的结果相似,说明训练集的结果能够得到有效验证。
特征提取的过程中,我们最终得到了7个最优特征(如表3所示):4个短行程优势(Short Run Emphasis,SRE)特征,短行程高灰度优势(Short Run High Grey Level Emphasis,SRHGLE)特征、灰度非一致性(Grey Level Non-uniformity,GLN)特征及区域百分比(Zone Percentage,ZP)特征各1个。这4种特征均属于纹理特征,其中,灰度非一致性特征和区域百分比特征属于灰度区域大小矩阵(Gray Level Size Zone Matrix,GLSZM)特征,而短行程优势特征和短行程高灰度优势特征属于灰度行程矩阵(Grey Level Run-length Matrix,GLRLM)特征。GLSZM和GLRLM均是描述复杂纹理特征的高级统计矩阵。GLSZM是通过二元条件概率密度函数对纹理图像的像素分布进行计算而得出的一种统计表示,通常图像的纹理越均匀,计算得出的矩阵就越宽、越平坦,主要用于描述纹理的均匀性以及非周期性,同时能够很好的描述类似斑纹的纹理[10-13]。GLRLM是对预定方向上共线、连续并具有相同灰度的像素个数进行统计,来表示纹理在预定方向上的粗糙程度[10,14]。而GLN、ZP和SRE、SRHGLE这4种特征分别通过不同的计算公式,对GLSZM和GLRLM的复杂度、层次变化等进行描述。简而言之,这7个最优特征分别体现了肝胆期肝实质MRI纹理的某一特点,是一种复杂的细致的量化表达。
我们认为预测模型之所以可以很好的区分病毒性肝炎肝硬化患者是否存在小肝癌是因为患者肝实质中Gd-EOB-DTPA造影剂分布的均匀性与患者肝硬化的程度成反比。其相关的病理生理基础如下:肝硬化发生后,大量胶原蛋白、蛋白聚糖和其他大分子会沉积于肝细胞外基质中,逐渐形成纤维化带,致使有机阴离子转运肽1(OATP1)和多药耐药蛋白2(MPR2)的活性降低,使得肝细胞对钆塞酸的摄取减少,使得相应的肝胆期肝实质信号强度降低[15-16]。肝细胞外基质中大分子的沉积是不均匀的,肝硬化程度越重,这种不均匀越显著,使得肝胆期肝实质的信号不均匀性随之增加。而小肝癌的发生又与肝硬化的程度正相关。所以纹理特征通过识别这种肝胆期肝实质信号的不均匀程度,可以对肝硬化的程度进行判断,进而对患者是否存在小肝癌进行区分。Lee等的研究得出了与此相一致的结论,他们通过测算不同组别患者的肝胆期肝实质CV值,证实了肝胆期肝实质信号强度的变异程度与乙型肝炎患者发生肝硬化、肝细胞癌存在相关性[17]。当肝硬化严重到肝功能Child-Pugh分级为C级时,肝细胞对钆塞酸的摄取能力将严重下降,这会导致肝细胞摄取钆塞酸的时间显著延长,也就是说,在注射造影剂后20 min时钆塞酸不能被有效摄取,表现为此时的肝实质信号的相对增强与延迟期相比没有任何增加[18-19],这样的肝胆期图像不再具备有效性。因此,我们在选取病例时排除了肝功能Child-Pugh分级为C级的肝硬化患者。
预测模型可以有效的区分病毒性肝炎肝硬化患者的肝实质状态,这将为患者随访肝硬化程度并监测小肝癌的发生提供帮助。患者进行Gd-EOB-DTPA增强MRI检查后,对其肝胆期肝实质图像进行放射组学分析,如果结果判定符合无肝癌组,同时没有观察到可疑肝硬化结节,则可以认为患者近期发生小肝癌的风险较低,常规的6个月随访间隔是可行的;而如果结果判定符合小肝癌组,则说明患者发生小肝癌的概率较高,即使没有发现可疑的肝硬化结节,仍应高度警惕,适当缩短随访间隔,以便尽早发现肝癌病灶,为治疗提供更多选择同时提高患者的生存期。且放射组学模型作为一种图像的后期处理分析,不需要在患者做MR检查时进行额外的操作,在临床应用中具有较高的可行性。
本研究存在一些局限性:①本研究是一项回顾性的横向研究,所采集的是不同患者的肝实质图像,在反映肝硬化程度与小肝癌发生的关系上可能仍不够直观准确。若能够实现对相同患者进行具有时间线性的纵向研究可能会得到更好的结果。②本研究的研究人数较少。虽然有多个放射组学相关研究证实多元Logistic回归这一方法能在样本量较少时也很好的构建模型[20-22],本研究结果也没有出现过拟合的现象。但若能获得大量的数据样本无疑将得到更好更有说服力的结果。③由于纹理特征计算原理的限制,每个患者的肝实质图像中只能设置1个ROI,没能完整体现肝实质的肝硬化程度。
总之,基于肝胆期肝实质MRI的放射组学分析能够对病毒性肝炎肝硬化患者发生小肝癌进行预测,且拥有较好的预测效能。
