双通道同时检测Cys/Hcy和GSH荧光探针的构建及细胞成像应用
2021-12-25苗俊峰霍莹莹罗海艳郭炜
苗俊峰,霍莹莹,罗海艳,郭炜
(山西大学 化学化工学院,山西 太原 030006)
0 引言
生物体内含量最丰富的小分子生物硫醇分别为半胱氨酸(Cys)、同型半胱氨酸(Hcy)和谷胱甘肽(GSH)。由于它们的氧化还原特性和亲核性,它们在人类健康和疾病中发挥着重要作用[1]。例如,Cys不仅是GSH和乙酰辅酶A的前体,同时在维持蛋白质结构和功能中起重要作用[2-4]。其水平异常与神经毒性、毛发脱色、水肿、肝损伤、皮肤病变等疾病密切相关[5-8]。Hcy水平失衡是心血管疾病的重要诱发因素[9-11]。此外,Hcy的浓度也与先天畸形和老年人认知障碍有关[12-13]。GSH是含量最丰富的小分子硫醇,作为一种内源性抗氧化剂参与维持细胞内氧化还原平衡、新陈代谢和信号转导[14-15]。GSH水平的失衡与癌症、心血管、阿尔茨海默病等许多疾病直接相关[16-17]。因此开发能够特异性检测生物硫醇的荧光探针显得尤为重要。
近二十年来,大量的检测生物硫醇的荧光探针被报道,其中一些已经被商业化,但是大部分的探针都是跟所有含有巯基的化合物反应,没有选择性[18]。Strongin课题组首先开发了利用醛基(或丙烯酸酯)与Cys/Hcy的环化反应来选择性区分Cys/Hcy和GSH的荧光探针[19-20],随后许多利用相同策略的选择性识别Cys和Hcy荧光探针被报道[21-25]。接着利用芳香亲核取代重排或Michael加成反应结合空间位阻或静电作用选择性识别Cys的荧光探针也相继被报道[26-31]。然而能够选择性把GSH识别出来的荧光探针却少有报道[32-33]。尽管如此,在考虑生物系统的实际应用时,仍存在一些局限性,如使用有机溶剂或表面活性剂、响应时间长、选择性相对较差和光谱重叠等。此外,几乎所有的这些探针一次只能检测一种生物硫醇。为了阐明这些生物硫醇和相关生理过程之间的复杂关系,开发一个可以选择性地从不同通道来检测两种或三种硫醇的荧光探针是十分必要且极具挑战的,而且截至目前只有极少数这种类型荧光探针被报道[34]。然而报道的探针荧光激发和发射波长较短或者需要加入表面活性剂会限制它们在生物系统的进一步应用。
在此基础上,我们设计了一个苯肼基团取代的吡罗红荧光探针RB--PHZ(图1)。其中,苯肼基团不仅可以作为芳香亲核取代反应(SNAr)的离去基团,也可以作为光诱导电子转移(PeT)作用的猝灭基团来猝灭吡罗红荧光团。探针RB--PHZ和Cys/Hcy反应首先生成巯基取代产物,然后经过分子内重排生成氨基取代产物。当与GSH反应时,由于不稳定的大环过渡态,该反应仅停留在巯基取代产物阶段。鉴于巯基和氨基取代产物光物理性质的差异,探针RB--PHZ能够从可见光和近红外光两个不同通道选择性区分Cys/Hcy和GSH。

图1 RB--PHZ对Cys/Hcy and GSH的传感机理Fig.1 Flurescence sensing mechamism of RB-PHZ for Cys/Hcy and GSH
1 实验部分
1.1 实验仪器与试剂
荧光光谱仪Hitachi F-7000;紫外可见光谱仪Varian Cary 4000;高分辨质谱仪Varian QFT-ESI;超导核磁共振仪Bruker ARX600;激光共聚焦显微镜Zeiss LSM 880。合成过程所用的试剂均为分析纯,测试过程所用试剂均为色谱纯,所用水均为二次蒸馏水。
1.2 探针的合成
探针RB--PHZ的合成步骤如式1。

式1 探针RB-PHZ的合成路线Scheme 1 Synthetic route of he probe RB-PHZ
将1(0.86 g,2.0 mmol)和氰化钾(0.39 g,6.0 mmol)加入20 mL水中,搅拌加热回流18 h后冷却至室温,过滤后得固体,将固体溶解在200 mL的盐酸(2.0 mol/L)水溶液中,然后加入FeCl3·6H2O(1.61 g,6.0 mmol)的20 mL盐酸溶液(2.0 mol/L),混匀后将反应液加热到90℃后反应12 h。薄层色谱检测反应完成后将反应液冷却至室温,然后过滤得到固体。将固体在100 mL的碳酸氢钠饱和溶液中溶解接着回流3 d,反应液冷却至室温,过滤得到固体粗产品。使用柱色谱分离纯化(二氯甲烷/甲醇 =50∶1)得化合物2(0.323 g,产率32.3%)1HNMR(600 MHz,CDCl3)δ8.11(d,J=9.2 Hz,2H),6.66(d,J=9.0 Hz,2H),6.70(s,2H),3.47(q,J=7.52 Hz,8H),1.26(t,J=7.4 Hz,12H);13C NMR(150 MHz,CDCl3)δ177.11,161.41,154.93,130.76,114.54,111.52,99.27,47.66,15.47;ESI-MS :计算值[M+H]+339.206 6,测量值 339.206 7。
将化合物 2(80 mg,0.268 mmol)溶解在 15 mL干燥的CH2Cl2中,在0℃下逐滴加入Tf2O(90 μL,2 eguiv),反应 10 min后加入 0.29 g苯肼(10 eq)。搅拌10 h,待原料完全反应后,旋干除去溶剂。粗产物经过柱色谱分离得到黄色的固体RB--PHZ(92 mg,80%)。1H NMR(600 MHz,CDCl3)δ8.33(d,J=7.6 Hz,1H),8.12(d,J=7.8 Hz,1H),7.70(s,1H),7.31(s,2H),6.85(dd,J=25.7,18.6 Hz,2H),6.63~ 6.47(m,3H),6.39(s,1H),3.43(d,J=6.0 Hz,8H),1.29~ 1.17(m,12H);13C NMR(151 MHz,CDCl3)δ156.17,153.64,149.51,149.16,147.41,129.11,129.23,128.14,125.34,119.64,113.69,112.17,108.80,106.69,105.88,98.76,97.32,44.61,44.51,12.67(s);ESI-MS:计算值[M+H]+429.264 9,测量值429.264 5。
1.3 测试所用溶液的配制
探针RB--PHZ溶解到二甲亚砜溶剂中配制成2 mmol/L的母液。Cys、Hcy、GSH和其他化合物均溶解到去离子水中配置为20 mmol/L的储备液。
2 结果与讨论
2.1 探针RB--PHZ与小分子生物硫醇(Cys、Hcy和GSH)的吸收和发射光谱
首先,我们测试了探针RB--PHZ与Cys、Hcy和GSH反应前后的吸收光谱。如图2A和2D所示,探针RB--PHZ在可见光波长范围内吸收峰最大值为534 nm,RB--PHZ本身几乎没有荧光(量子产率ΦF=0.003)。当与Cys反应后,最大吸收峰蓝移到454 nm,并在545 nm产生强的荧光发射峰(ΦF=0.51);如图2B和2E所示,加入Hcy反应后,与加入Cys产生几乎一致的吸收光谱和荧光发射光谱变化(ΦF=0.51);如图2C和2F所示,当加入GSH时,吸收峰红移到585 nm,并620 nm处产生强的红色荧光发射峰(ΦF=0.48)。探针本身由于苯肼对吡罗红产生的PeT作用,荧光团的荧光被淬灭,当与硫醇反应后,荧光增强。首先发生巯基取代反应,苯肼基团离去,然后Cys和Hcy接着发生分子内亲核取代反应,但是GSH由于生成不稳定的大环过渡态,不发生分子内亲核取代,只停留在巯基取代的第一步反应。所以探针能选择性地区分Cys(Hcy)和GSH。

图2 RB--PHZ(4 μmol/L)与Cys(A),Hcy(B),GSH(C)(50 μmol/L)反应前后的吸收光谱变化。RB--PHZ(4 μmol/L)与Cys(D),Hcy(E)和 GSH(F)(50 μmol/L)反应前后的荧光光谱变化Fig.2 Absorption spectra of RB--PHZ(4 μmol/L)in the absence and presence of Cys(A,50 μmol/L);Hcy(B,50 μmol/L)and GSH(C,100 μmol/L).Fluorescence spectra of RB--PHZ(4 μmol/L)in the absence and presence of Cys(D,50 μmol/L);Hcy(E,50 μmol/L)and GSH(F,100 μmol/L)
2.2 探针RB--PHZ与小分子生物硫醇(Cys、Hcy和GSH)的反应的动力学响应
接着检测了RB--PHZ在不同激发波长下(455 nm和550 nm)的动力学响应。在455 nm波长光的激发下(如图3A所示),加入Cys和Hcy后,最大发射峰545 nm处荧光随着时间的变化不断增强,在50 min左右达到最大值;而加入GSH后,基本没有荧光的变化。用550 nm波长光激发,收集620 nm处的荧光峰值。如图3B所示,与Cys和Hcy反应后,几乎没有任何荧光增强。与之相反,与GSH反应后,荧光显著增强。因此,探针RB--PHZ可以在两个通道分别检测Cys(Hcy)和GSH。
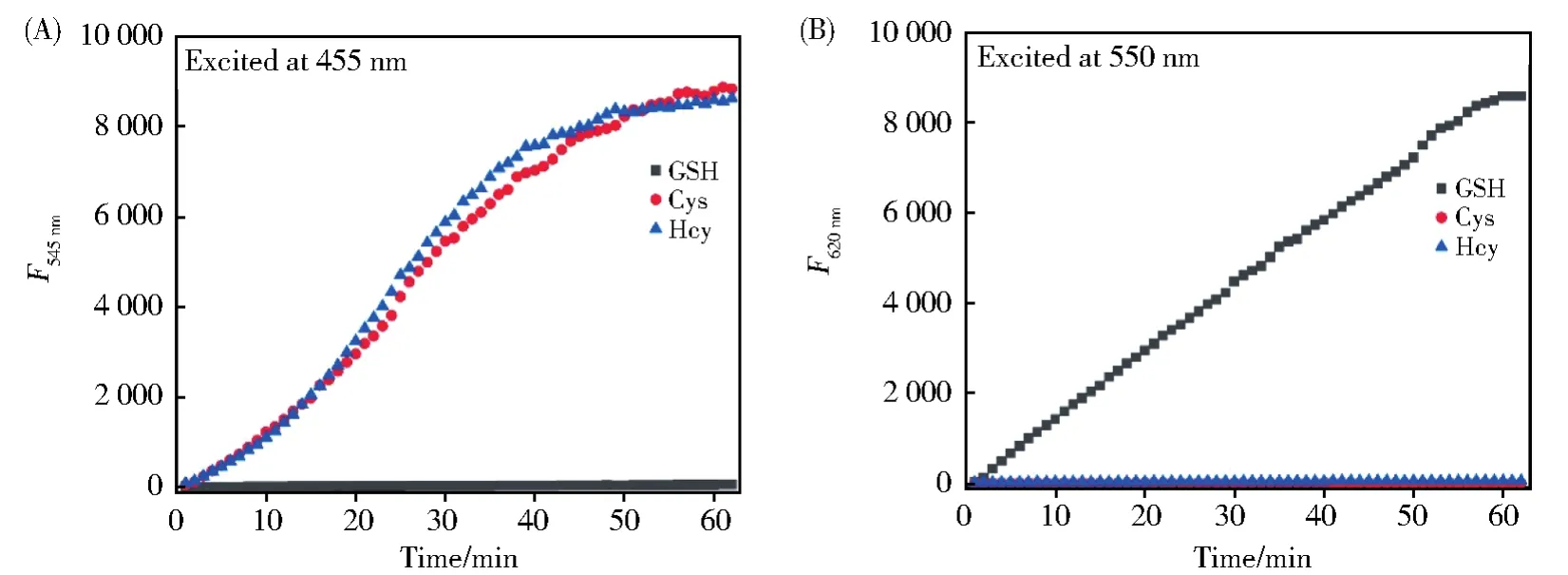
图3 RB--PHZ(4 μmol/L)与Cys/Hcy(50 μmol/L),GSH(100 μmol/L)的动力学。(A)455 nm光激发;(B)550 nm光激发Fig.3 Time course of fluorescence intensities of RB--PHZ(4 μmol/L)after treatment with Cys/Hcy(50 μmol/L)and GSH(100 μmol/L).(A)Excited at 455 nm;(B)Excited at 550 nm
2.3 探针RB--PHZ与小分子生物硫醇(Cys、Hcy和GSH)反应的荧光滴定实验
选取60 min作为反应时间,分别测定RB--PHZ与Cys、Hcy和GSH反应的荧光滴定实验。随着Cys(Hcy)浓度的逐渐增加,发射峰545 nm处的荧光不断增强。Cys(Hcy)浓度增加到50 μmol/L时,发射峰荧光强度增加到最大值(图4A和4B)。当加入GSH时,需要100 μmol/L才能达到饱和(图4C)。荧光强度与Cys(Hcy)浓度在0~8 μmol/L范围线性相关良好(R2=0.99)(图4D和4E),而与GSH反应的线性范围是0~18 μmol/L(图4F)。根据信噪比S/N=3,计算得到探针RB--PHZ对Cys、Hcy和GSH的检测限分别为21 nmol/L、22 nmol/L和45 nmol/L。上述结果表明,探针RB--PHZ是一个高灵敏性性和高分辨率的生物硫醇荧光探针。
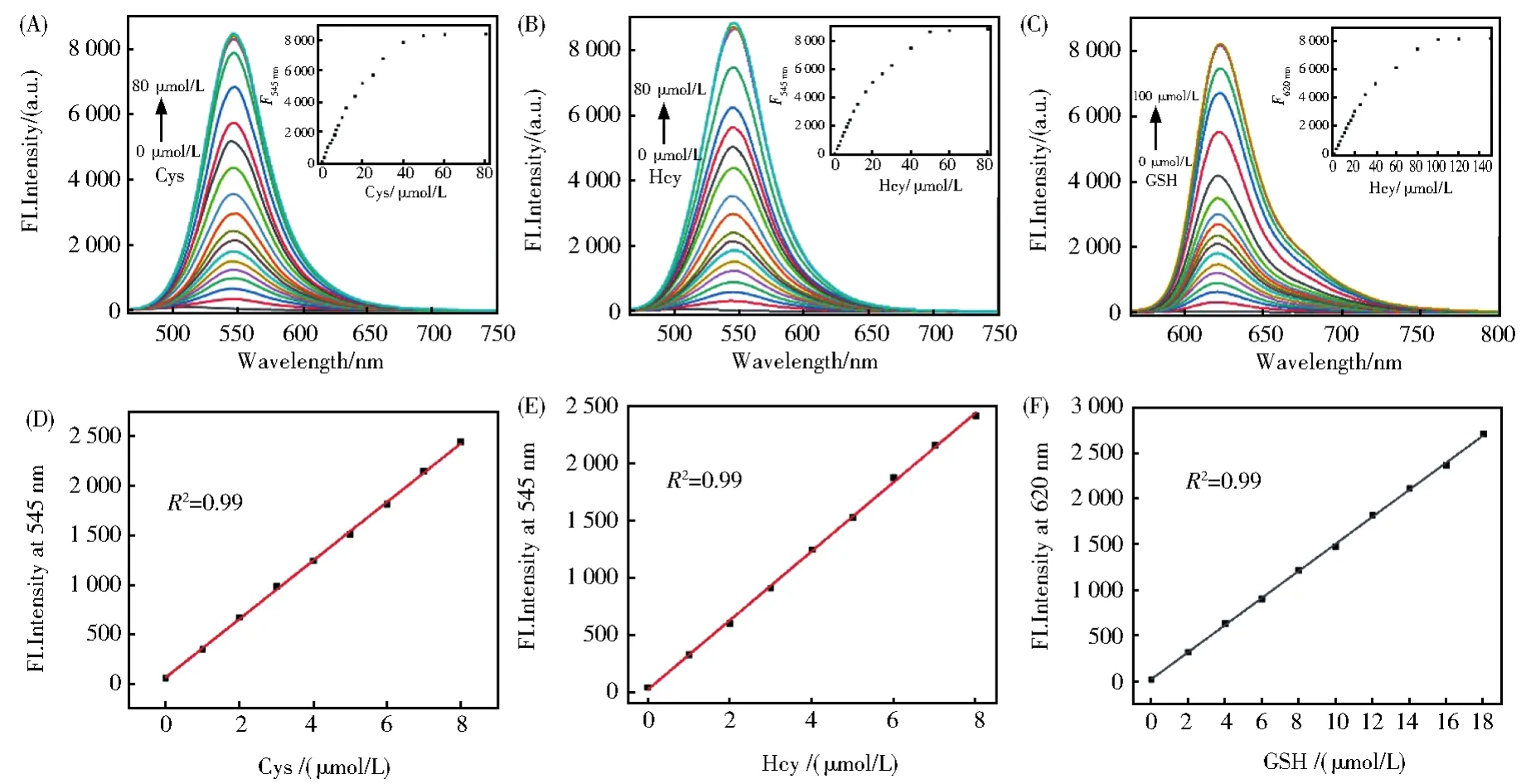
图4 (A-C)RB--PHZ(4 μmol/L)与不同浓度的Cys/Hcy(0~60 μmol/L),GSH(0~100 μmol/L)反应的荧光滴定光谱。(E)RB--PHZ在545 nm处的荧光强度与Cys/Hcy浓度(0~8.0 mol/L)的线性相关性。RB--PHZ在620 nm处的荧光密度与GSH浓度(0~18.0 mol/L)的线性相关性Fig.4 (A-C)Fluorescence spectra changes of RB--PHZ(4 μmol/L)treated with increasing concentrations of Cys/Hcy(0~60 μmol/L),GSH(0~00 μmol/L).(D,E)Plots of the fluorescence intensities of RB--PHZ at 545 nm as a function of the Cys/Hcy concentrations(0~8.0 μmol/L).(F)Plots of the fluorescence intensities of RB--PHZ at 620 nm as a function of the.GSH concentrations(0~18.0 μmol/L)
2.4 探针RB--PHZ对小分子生物硫醇(Cys、Hcy和GSH)的选择性研究
接下来我们研究了探针RB--PHZ对Cys(Hcy)和GSH的选择性。如图5A和5B所示,当向探针RB--PHZ的PBS溶液中加入氨基酸(His、Glu、Asp、Val、Phe、Tyr、Ala、Ser、Leu、Arg、Pro、Thr、Gin、Try、Iie和 Lys,200 μmol/L)和活性氧化物(ROS and RNS:ClO-、H2O2、1O2、O2·-、·OH、NO、and ONOO-,200 μmol/L),反应1 h 后检测,溶液的荧光强度几乎没有任何变化;而当向RB--PHZ的中加入Cys(Hcy)反应1 h后,溶液在545 nm的荧光发射峰明显地增强。而与GSH反应后,620 nm处荧光发射峰明显增强。表明探针RB--PHZ可以高选择性地识别Cys(Hcy)和GSH。
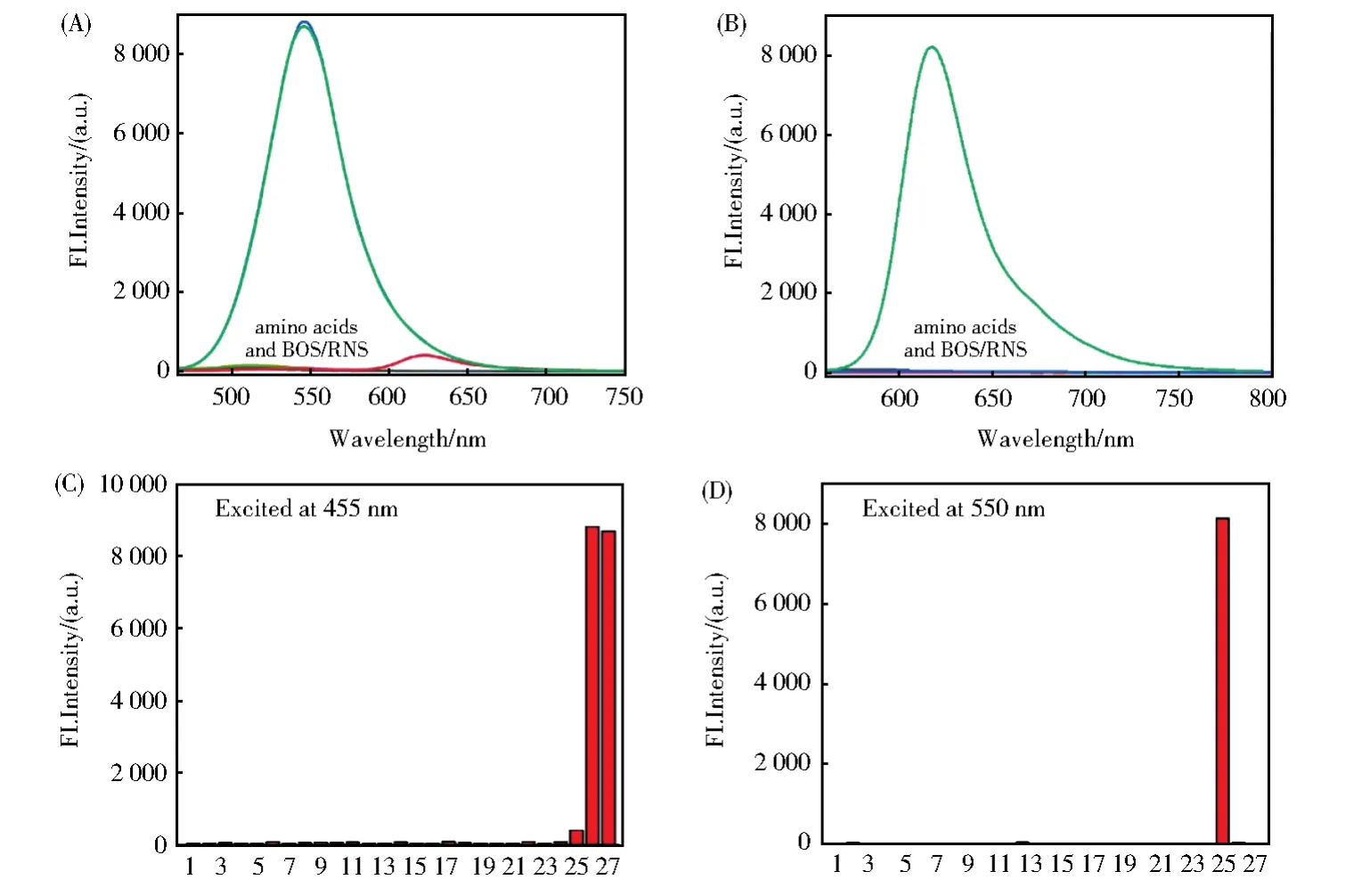
图5 (A-D)RB--PHZ 对各种生物相关的氨基酸和生物活性氧的荧光响应结果。(1)RB--PHZ;(2)Try;(3)Glu;(4)Gin;(5)Iie;(6)Leu;(7)Lys;(8)Val;(9)Asp;(10)His;(11)Phe;(12)Arg;(13)Pro;(14)Thr;(15)Ala;(16)Ser;(17)Tyr;(18)ClO-;(19)H2O2;(20)1O2;(21)O2·-;(22)·OH;(23)NO;(24)ONOO-;(200 μmol/L)(25)GSH;(100 μmol/L)(26)Cys;(27)Hcy(50 μmol/L)Fig.5 (A-D)Fluorescence response of RB--PHZ(4 μmol/L)treated with various biologically relevant species for 1 h,including(1)RB--PHZ;(2)Try;(3)Glu;(4)Gin;(5)Iie;(6)Leu;(7)Lys;(8)Val;(9)Asp;(10)His;(11)Phe;(12)Arg;(13)Pro;(14)Thr;(15)Ala;(16)Ser;(17)Tyr;(18)ClO-;(19)H2O2;(20)1O2;(21)O2·-;(22)·OH;(23)NO;(24)ONOO-;(200 μmol/L)(25)GSH;(100 μmol/L)(26)Cys;(27)Hcy(50 μmol/L)
2.5 不同pH条件下探针RB--PHZ对小分子生物硫醇(Cys、Hcy和GSH)传感性能研究
进一步,我们验证了不同pH条件下探针RB--PHZ对Cys(Hcy)和GSH传感性能。探针RB--PHZ在pH=5~12的范围内几乎没有荧光;当加入Cys(Hcy)和GSH后,pH=5~12范围内都显示了较大的荧光增强倍数,表明RB--PHZ在不同pH条件下都能够高选择性地影响生物体内的Cys(Hcy)和GSH。
2.6 细胞毒性实验
我们研究了探针RB--PHZ对HeLa细胞的毒性。如图7所示,在HeLa细胞孵入不同浓度探针RB--PHZ(1 μmol/L~10 μmol/L),培养 24 h 后,细胞存活率都在90%以上。表明探针RB--PHZ的细胞毒性较低,具有应用于细胞中的成像生物硫醇的潜力。
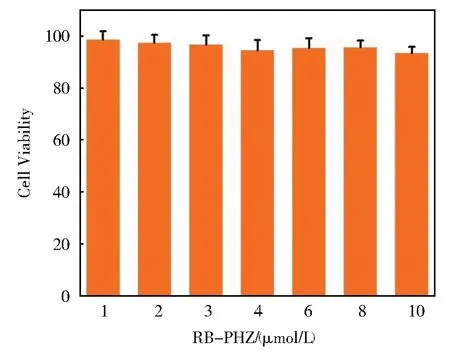
图7 HeLa细胞中加入不同浓度RB--PHZ(1 μmol/L~10 μmol/L)24小时后的细胞毒性Fig.7 Cytotoxicity testing results of RB--PHZ(1 μmol/L~10 μmol/L)in HeLa cell.The values represent percentage cell viability(mean% ± SD,n=6)
2.7 细胞成像实验
结合激光共聚焦显微镜在HeLa细胞系中测试了探针RB--PHZ对Cys(Hcy)和GSH的成像能力。如图8A所示,把探针RB--PHZ孵入HeLa细胞后,在红色和绿色两个通道都观察到明显的荧光增强。表明探针RB--PHZ可以进入细胞并与内源性的生物硫醇发生反应。HeLa细胞加入N-乙酰基马来酰亚胺(NEM,硫醇清除剂,0.5 mmol/L)进行预处理30 min,然后孵入探针RB--PHZ,红色通道和绿色通道都没有观察到明显的荧光增强(8B)。NEM预处理过的细胞中,分别加入Cys和Hcy,只在绿色通道观察到了明显的荧光增强(8C,8D);当加入GSH时,相反只在红色通道观察到了明显的荧光增强(8E)。这表明探针RB--PHZ在细胞中同样对Cys(Hcy)和GSH的识别有较高的选择性,具有潜在的生物应用价值。
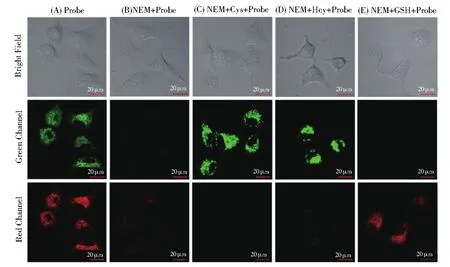
图8 (A)HeLa细胞的共聚焦成像,细胞只用RB--PHZ处理;(B)NEM预处理后加入RB--PHZ;(C-E)NEM预处理后,分别加入Cys(Hcy)(50 μmol/L)或者GSH(100 μmol/L),然后加入RB--PHZFig.8 (A)Confocal images of HeLa cells after treated with RB--PHZ(2 μmol/L)only;(B)pretreated with NEM and then treated with RB--PHZ;(C-E)pretreated with NEM and then respectively added Cys(or Hcy)(50 μmol/L)or GSH(100 μmol/L)then treated with RB--PHZ(4 μmol/L).Green channel:λex=561 nm and λem=566-650 nm;red channel:λex=633 nm and λem=638-750 nm
3 结论
本文设计合成了一个能够同时从两个通道选择性识别Cys/Hcy和GSH的荧光探针RB--PHZ。并在HeLa细胞中证实了探针RB--PHZ能够同时分别成像内源性和外加的Cys/Hcy和GSH。本工作为在生理和病理条件下研究不同小分子生物硫醇提供了一个优良的荧光成像工具。
