基于功能磁性材料和固相微萃取净化富集一体化的茶饮料中三唑类农药残留分析
2021-12-23齐沛沛黄志明王新全
王 娇, 齐沛沛, 虞 淼, 黄志明, 王新全*,
(1. 浙江省农业科学院 农产品质量安全与营养研究所,农产品质量安全危害因子与风险防控国家重点实验室,杭州310021;2. 浙江省植保检疫与农药管理总站,杭州 310004;3. 浙江养生堂天然药物研究所有限公司,杭州 310024)
三唑类杀菌剂是含有1,2,4-三唑环的有机含氮杂环类化合物,具有广谱、高效及残效期长等特点,常用于茶叶种植过程中防治各种病害,虽然目前登记用于茶树上的仅苯醚甲环唑一种,但实际生产中普遍存在违规使用其他三唑类杀菌剂的情况。该类农药具有内分泌干扰作用,长期低剂量暴露带来的健康风险不容忽视[1]。作为茶叶提取物,茶饮料同样具有农药残留的风险。随着对健康的不断重视,茶饮料中农药残留检测日益受到消费者关注[2]。因此,构建茶饮料中三唑类杀菌剂的灵敏分析技术对于开展后续的食用安全风险评估具有重要的技术支撑作用。
茶饮料中农药残留具有残留量低的特点,目前主要采用固相萃取、液−液萃取[3-6]等具有较强富集能力的前处理技术,但存在操作繁琐、有机试剂用量大、检测成本高等不足。固相微萃取(SPME) 技术集富集和净化于一体,具有操作简便、无需溶剂、易与检测仪器联用等优点[7-11]。依据目标分析物的挥发性与极性,合理选用萃取纤维材料,可有效富集目标化合物,实现快速、高效的样品检测。但由于SPME方法中萃取纤维长时间与样本作用,大量化学或物理性质相近的物质同时被富集,基质干扰不可避免,为后续分析的准确定性、定量带来极大难度[12],因此,净化基质样品是提高SPME 方法适用性和定量准确性的关键。
磁性材料具有超顺磁性、高比表面积、悬浮稳定性、易功能化修饰、易分离目标分析物等优势,是近年国内外研究的热点[13-15]。磁性材料在完成样品富集或净化后,可以与基质溶液快速分离,是理想的快速样品前处理材料,在分析化学领域展现出广阔的应用前景[16-17]。针对基质特点,合理设计并有针对性的研制功能化磁性材料,使基质中的杂质结合在磁性材料表面,而目标化合物仍保留在液相体系中,并结合SPME 的高效富集特点,可实现农药多残留分析简便、灵敏而准确的目标。
目前,针对茶饮料中农药残留检测技术的研究主要集中在菊酯类、有机氯类和新烟碱类农药,鲜有三唑类农药残留检测技术的研究报道[18-20];同时,SPME 富集结合磁性固相净化协同技术的研究也未见报道。因此,本研究针对茶饮料中有机酸和茶多酚等干扰物质,选择修饰了N-丙基乙二胺 (PSA) 的四氧化三铁磁性材料 (Fe3O4-PSA)为净化剂,以三唑类杀菌剂为研究对象,构建SPME 富集和功能磁性材料净化的协同技术,以期使目标三唑类药物在萃取纤维上的富集和有机酸等杂质的去除同时进行,有效缩短样品前处理时间,改善复杂样品的净化效果,提高样品定性、定量分析的准确性,提高农药残留分析检测能力。
1 材料与方法
1.1 试剂、材料和仪器
19 种三唑类杀菌剂标准品 (表1) 和内标物外99.8%环氧七氯,均购于上海农药研究所;甲醇(色谱纯) 购于Merck 公司;氯化钠、氢氧化钠和盐酸,购自华林化工;甲酸铵 (HPLC 级) 购于美国Tedia 公司;茶饮料为超市购置的瓶装绿茶(糖、脂肪、蛋白质含量为0 mg/kg,茶多酚含量≥160 mg/kg) 。四氧化三铁-N-丙基乙二胺(Fe3O4-PSA) 为自制磁珠,制备过程及表征见参考文献[21];数显恒温磁力搅拌器和SPME 手柄,购于Sigma-Aldrich 公司。Agilent 气相色谱(6890N) -质谱联用仪 (5975) ,购于北京安捷伦科技有限公司。SPME 萃取头 (涂覆85 μm 聚丙烯酸酯 (PA) 的石英玻璃萃取纤维) ,购于默克Sigma生物公司;SAX 固相萃取柱,购于天津博纳艾杰尔科技有限公司。
1.2 标准溶液配制及标准曲线绘制
将19 种药剂标准品分别溶解于丙酮中,配制成一定质量浓度 (1 000 ~ 2 000 mg/L) 的单标储备液;分别准确移取一定量的单标储备液于25 mL容量瓶中,混匀,丙酮定容至25 mL,配制成20 mg/L 的混合标准储备液,于4 ℃保存,使用时根据需要稀释成不同浓度的标准工作溶液。将20 mg/L 的混合标准储备液用丙酮逐级稀释至质量浓度为0.002、0.005、0.02、0.05、0.1 和0.2 mg/L的溶剂标准溶液。同时,将20 mg/L 的混合标准储备液用茶饮料基质空白提取液逐级稀释至质量浓度为0.002、0.005、0.02、0.05、0.1、0.2 mg/L的基质匹配标准溶液。以目标化合物质量浓度为横坐标(x),对应峰面积 (y) 为纵坐标绘制标准曲线。
1.3 检测条件
色谱条件:Agilent HP-5MS 色谱柱 (15 m × 0.25 mm, 0.25 μm);载气为氦气;柱流速为1 mL/min;柱温箱程序升温梯度:初始柱温60 ℃,保留1 min,然后以30 ℃/min 的速率升温至210 ℃,保留1 min,继续以8 ℃/min 的速率升温至280 ℃,保留5 min;进样量1 μL;进样口温度230 ℃。
质谱条件:EI 离子源;传输线温度260 ℃;离子源温度230 ℃;EI 电子能量70 eV;灯丝电流100 A;采用选择离子监测模式测定化合物,离子信息见表1。
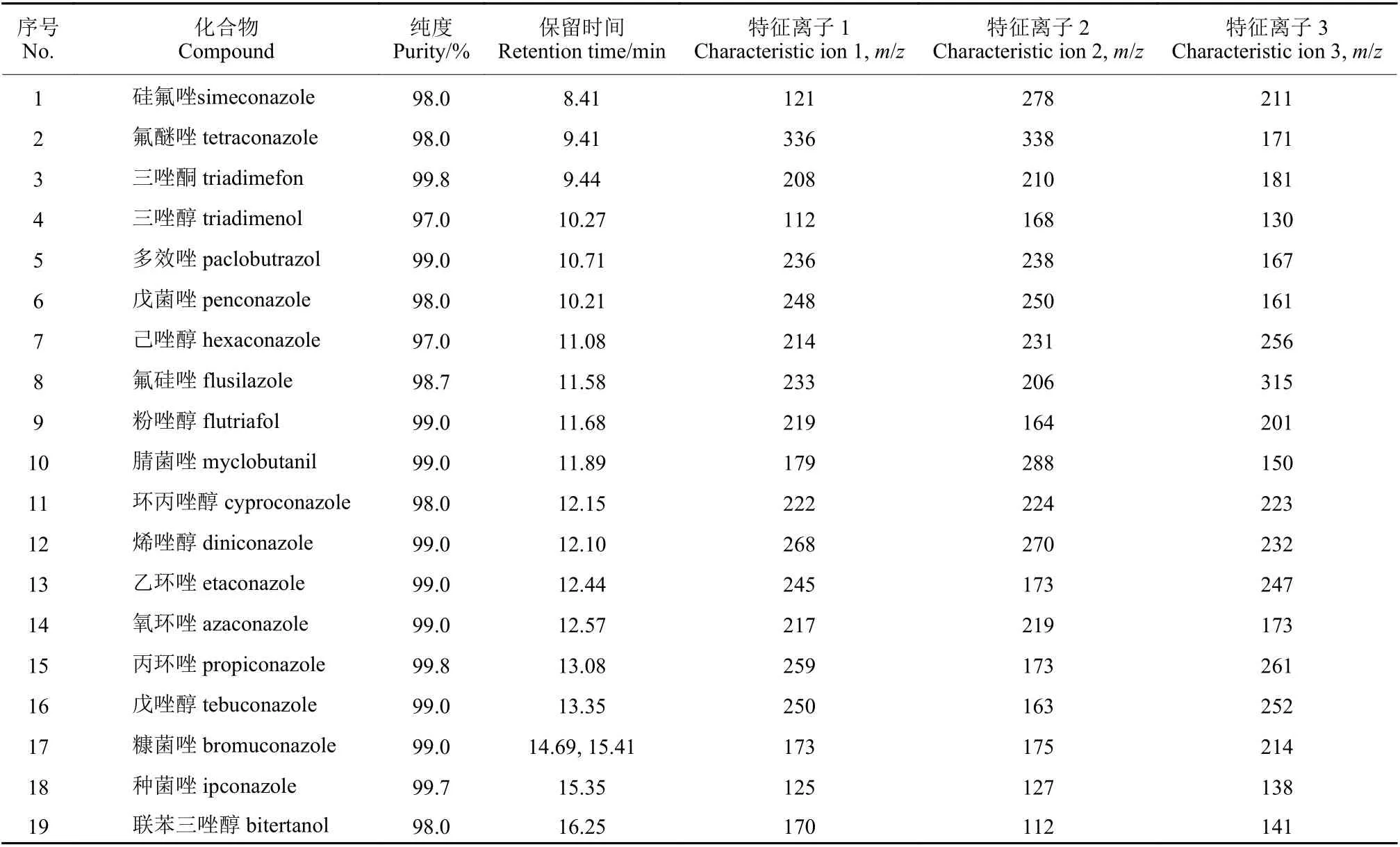
表1 19 种三唑类农药的保留时间和特征离子Table 1 Retention time and characteristic ions of 19 triazole pesticides
1.4 试验方法
1.4.1 固相微萃取处理方法 称取0.75 g 氯化钠于含有15 mL 茶饮品的棕色样品瓶中,加入30 mg Fe3O4-PSA,置于数显恒温磁力搅拌器上,于55 ℃恒温水浴下,用SPME 萃取头在1 500 r/min 条件下浸入萃取40 min 后取出,置于GC-MS 进样口解析6 min,供GC-MS 分析。
1.4.2 固相萃取处理方法 参考文献中固相萃取(SPE) 方法进行方法[22]并加以改进,采用SAX SPE 柱对三唑类农药进行富集:用12 mL 纯水、12 mL 甲醇和12 mL 正己烷依次活化SAX 柱,保持固相萃取柱处于浸润状态;将15 mL 茶饮料样品上柱富集,流速约为0.5 mL/min,待上样完毕,用15 mL 甲醇洗脱;收集洗脱液,氮气吹至近干,加入1 mL 甲醇溶解残渣后过0.45 μm 滤膜,供GC-MS 分析。
1.4.3 添加回收试验 采用茶饮料空白样品中进行添加回收试验,添加水平为0.002、0.01 和0.02 mg/L,每个水平重复3 次,按照优化的试验方法,通过基质匹配标准溶液线性回归方程计算样品中农药残留浓度,进一步计算回收率及相对标准偏差 (RSD)。
2 结果与分析
2.1 SPME 条件优化
试验检测灵敏度与萃取条件密切相关。首先,萃取未达到平衡之前,萃取时间越长,萃取效率越高,响应值也越高;其次,萃取温度越高,扩散系数越大,扩散速度随之增大,但升温同时会使待测物分配系数减小,影响SPME 萃取头的吸附量;此外,样品溶液中盐的存在会增加溶液离子强度,降低待测物在溶液中的溶解度,提高分配系数,增强待测物响应值[23];pH 值会影响待测物和杂质在溶液中的带电性,进而影响萃取针和磁性材料的吸附量[24]。因此,本研究针对萃取时间、萃取温度、氯化钠用量及pH 值进行了优化。方法优化过程中各化合物的添加水平均为0.05 mg/L。
2.1.1 萃取时间优化 基于萃取温度 (55±1) ℃、氯化钠用量5 %、pH=7、解析时间6 min 为固定萃取条件,比较不同萃取时间 (20、30、40、50、60、80、100 min) 的萃取效果。为了更清晰地展示化合物峰面积在不同条件下的差异,采用归一化法进行处理,以20 min 时各化合物的峰面积为1,计算其他条件下峰面积与20 min 时峰面积的比值。由图1A 可知,在20 ~ 80 min 之间,随着萃取时间的延长,各农药组分的响应值均增大,当萃取时间为100 min 时,响应值下降。综合不同萃取时间对农药响应值的影响程度,并且考虑过长的萃取时间不利于试验进度,最终选择40 min 作为最佳萃取时间。
2.1.2 萃取温度的优化 基于萃取时间40 min、氯化钠用量5 %、pH=7、解析时间6 min 为固定萃取条件,比较不同萃取温度 (25 ℃、35 ℃、45 ℃、55 ℃、65 ℃) 的萃取效果 (图1B,以25 ℃时的响应值为1,对其他条件下的响应值进行归一化处理) 。结果发现,随着温度的升高,各农药组分的响应值均增大,但65 ℃时对各农药响应值的影响程度差异较大,如三唑酮、多效唑、环唑醇、乙环唑的归一化响应值大于9,而氟硅唑、糠菌唑、种菌唑和联苯三唑醇的归一化响应值小于3,响应变化较大,说明此8 种农药对65 ℃温度敏感程度相差较大;此外,65 ℃条件下各化合物峰面积的相对标准偏差 (n=3) 明显高于其他条件 (归一化数据处理后未体现在图中) ,其中多效唑等11 种农药的RSDs 大于20%,因此最终选择 (55±1) ℃为最佳萃取温度。
2.1.3 氯化钠用量的优化 基于萃取时间40 min、萃取温度 (55±1) ℃、pH=7、解析时间6 min 为固定萃取条件,比较了不同氯化钠用量 (0、5%、10%、15%、20%) 的萃取效果 (图2A,以0 时的响应为1,对其他条件的响应值做归一化处理) 。结果发现,随着氯化钠用量的增加,部分农药的响应值越来越大;但也有一部分农药当氯化钠用量自5%升为10%时,响应值不升反降;并且当氯化钠用量超过10%时,对不同农药响应值的影响程度差异悬殊。这可能是由于氯化钠影响了各农药在水相和有机相间的分配系数所致。因此,最终选择氯化钠用量为5%。
2.1.4 pH 值的优化 基于萃取时间40 min、萃取温度 (55±1) ℃、氯化钠用量 5%、解析时间6 min 为固定萃取条件,比较了不同pH 值 (pH=5、6、7、8,以1 mol/L 的NaOH 或HCl 调节) 的萃取效果,结果如图2B所示 (以pH=5 时的响应值为1,对其他条件响应值做归一化处理) 。从中可看出:pH 值对农药响应值的影响不大,由于pH=7 时多种农药达到要求响应值,且考虑到调节pH 会增加试验操作步骤,因此选择pH=7 为最佳条件。
2.2 磁性材料用量及固相微萃取条件的交互影响
在极性溶液体系中,磁性纳米材料在吸附杂质的同时也会吸附靶标农药。本研究通过加入有机溶剂来平衡磁性材料对目标物的吸附与去除杂质之间的关系,以确定最佳分析条件。为此,采用正交试验设计探讨磁性材料用量、甲醇含量以及萃取时间对样品基质中各农药组分响应值的交互影响。以萃取温度 (55±1) ℃、氯化钠用量5%、pH=7、解析时间6 min 为固定条件,正交试验设计如表2 所示,选取磁性材料Fe3O4-PSA 用量、甲醇含量和萃取时间3 个因素、4 个水平组合的L16(43),测定在16 个试验条件下各农药组分的响应值,每个试验3 次平行。

表2 Fe3O4-PSA 用量、甲醇含量、萃取时间L16(43)正交试验表Table 2 Orthogonal experiments of Fe3O4-PSA dosage,methanol content, and extraction time L16(43)
16 组正交试验中,分别将磁性材料Fe3O4-PSA 用量为0、10、20、30 mg 的条件找出并计算各组分峰面积的平均值K,进而计算极差R值和R平均值 (R-average) (见附表S1 ~ S3) 。R-average越大,表明该条件对结果影响越大。不同甲醇含量和萃取时间的R-average也同理可得。由表3 可知:主次顺序为R-average (甲醇含量) >R-average(萃取时间) >R-average (Fe3O4-PSA 用量) ,因此甲醇含量和萃取时间是影响萃取效率的主要因素,不同组分随甲醇含量和萃取时间变化的规律和程度不完全一致,根据不同条件下各农药组分的响应平均值,发现当Fe3O4-PSA 用量0、甲醇含量0、萃取时间40 min 时萃取效果最佳,但鉴于Fe3O4-PSA 的添加可以减轻萃取纤维的损耗,并且Fe3O4-PSA 用量30 mg 时的萃取效果 (平均峰面积11 755 668) 仅次于不添加时的萃取效果 (平均峰面积12 476 695) ,因此选择Fe3O4-PSA 用量30 mg、甲醇含量0 、萃取时间40 min 作为试验条件。
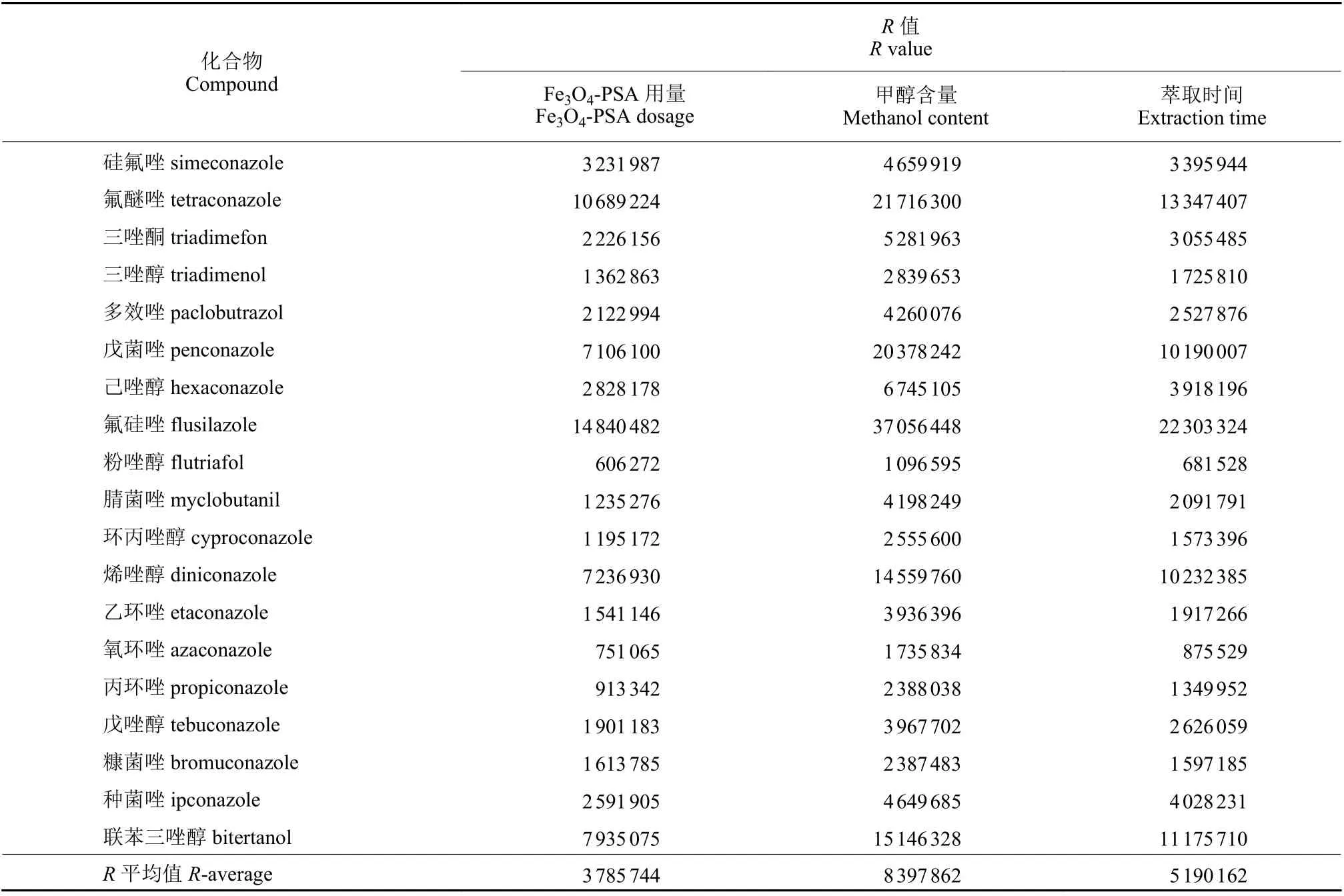
表3 不同参数对茶饮料中各农药组分响应值的影响Table 3 Effects of different parameters on the response values of pesticide components in tea drinks
2.3 方法确证
2.3.1 线性关系和基质效应 结果 (表4) 表明:在0.002 ~ 0.2 mg/L 范围内,19 种三唑类农药在茶饮料中均表现出很好的线性关系,相关系数(r)均大于0.99。以目标农药3 倍信噪比所对应的浓度计算,检出限(LOD)为0.000 12 ~ 0.008 9 mg/L。
基质效应可通过基质匹配标准曲线线性方程斜率和溶剂标准曲线线性方程斜率之比来评价。如果斜率比为1,说明不存在基质效应;斜率比小于1 为基质抑制效应;斜率比大于1 为基质增强效应。结果 (表4) 可见:19 种农药均表现为基质抑制效应,其中硅氟唑、氟硅唑、粉唑醇、腈菌唑、环丙唑醇、已环唑、氧环唑、丙环唑、戊唑醇、糠菌唑、种菌唑和联苯三唑醇存在明显的基质抑制效应,说明在定量分析中基质影响较大,因此建议使用基质匹配标准溶液进行校正定量分析。
2.3.2 方法的准确度及精密度 在0.002、0.01 和0.02 mg/L 添加水平下,19 种三唑类农药的平均回收率在71% ~ 98%之间,相对标准偏差 (RSD) 均小于16%。所有农药组分的回收率都可满足欧盟文件SANTE/12 682/2019[25]分析要求,表明本研究建立的方法可用于茶饮料中三唑类农药残留的分析。欧盟文件SANTE/12 682/2019[25]规定定量限(LOQ)为试验中最低添加浓度水平,且回收率必须满足试验需求。本方法中最低添加水平为0.002 mg/L,回收率范围为71%~98% (表5) ,故本方法19 种三唑类农药的LOQ 为0.002 mg/L。
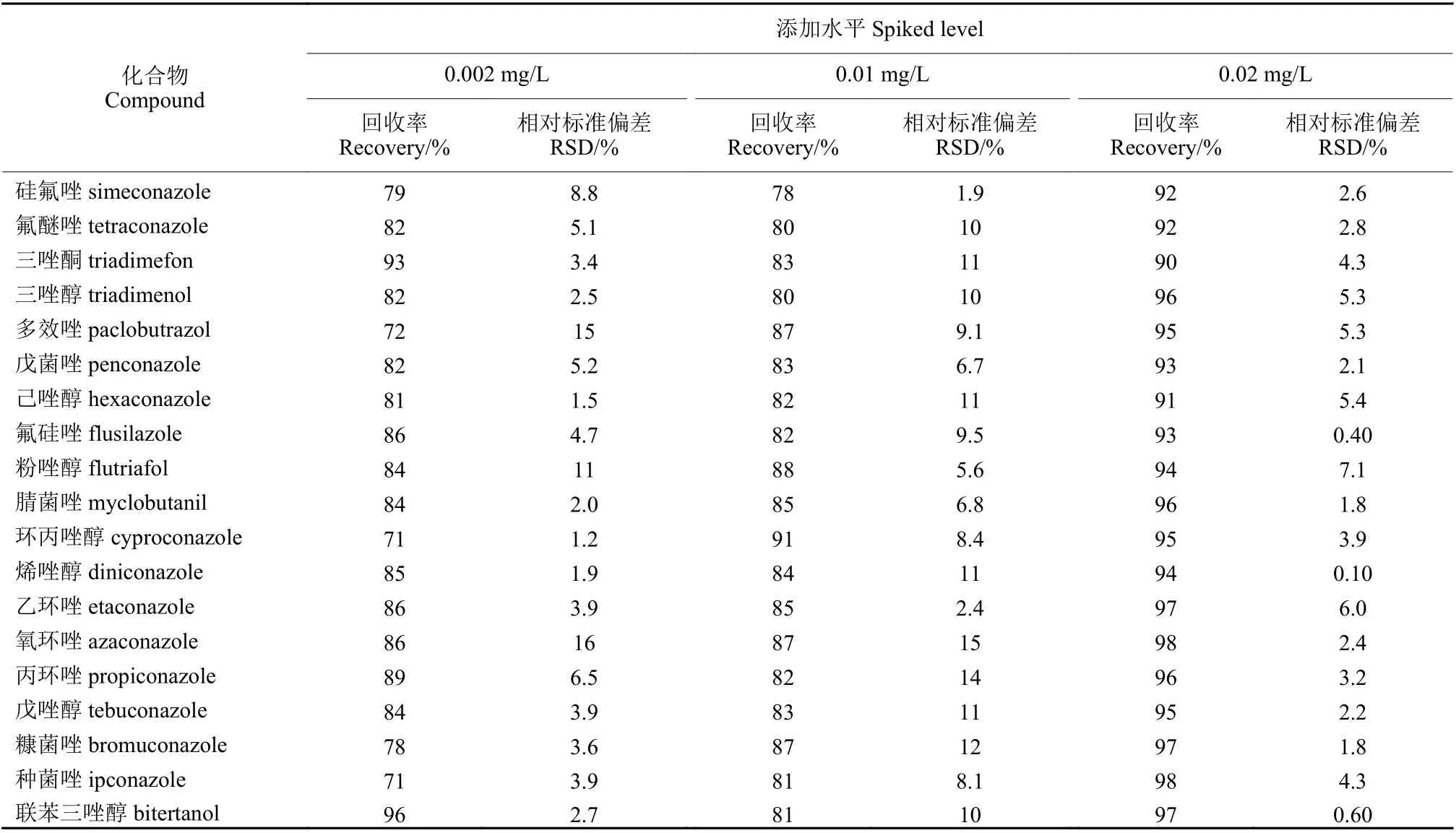
表5 19 种农药在茶饮料中的回收率及相对标准偏差 (n=3)Table 5 The recoveries of 19 pesticides spiked in the tea drinks (n=3)
2.4 方法比对
为验证本方法的适应性及有效性,将本方法与文献报道的SPE 方法进行对比。按照试验方法分别对15 mL 绿茶饮料中的三唑类农药残留进行分析,比对结果见附表 S4。在添加水平为0.01 mg/L时,本方法中84% 的农药的回收率在80% ~110%之间,而SPE 方法中19 种农药的回收率均低于80%。在有机试剂用量上,常规富集净化方法有机试剂用量高达40 mL,而本方法中未使用有机试剂。在样品处理速度上,现有文献方法中涉及过柱及氮吹,耗时较长,而本方法经SPME直接富集萃取后上机检测,方便快捷。因此,本方法在确保准确度的情况下,具有高效、快捷及环保等优势。
2.5 实际样品分析
随机在零售超市购买绿茶饮料10 份,经本方法预富集与上机测试后,均未检出本研究中涉及的19 种三唑类农药。
3 结论与讨论
本研究旨在利用具有净化吸附功能的磁性纳米材料及SPME 高效富集的功能,构建新型一体化、双重净化技术平台。以茶饮料中19 种三唑类农药为研究对象,采用磁性纳米材料Fe3O4-PSA分别去除基质中的极性有机酸和茶多酚等杂质。在确定分析三唑类农药的基础SPME 条件后,利用正交试验设计探讨了Fe3O4-PSA 用量、萃取时间以及甲醇用量等影响因素,筛选出最佳的一体化分析方法条件。系统的方法确证试验表明,在0.002 ~ 0.2 mg/L 范围内,19 种三唑类农药在茶饮料中均表现出很好的线性关系,相关系数均大于0.99,LOD 范围为0.000 12 ~ 0.008 9 mg/L,LOQ为0.002 mg/L。采用基质匹配标准溶液进行样品添加回收测定,结果表明,茶饮料样品中三唑类农药的回收率均可满足分析测试要求。本方法简单可行,能满足日常生活中茶饮料中三唑类农药的残留检测需求。此方法较常规法简单、操作便捷、可靠,且环境友好,因为在前处理中省略了国标法中的有机溶剂处理程序,故不产生相应的有机废弃物,同时也减少了很多一次性试验用品的消耗,值得继续完善并加以推广。
