新型冠状病毒标本采集全流程护理质量控制评价
2021-12-23苏真娇何锦文周琳莉
苏真娇,何锦文,叶 俏,周琳莉
(1. 珠海市人民医院 暨南大学附属珠海医院护理部;2. 珠海市人民医院 暨南大学附属珠海医院检验科;3. 珠海市人民医院 暨南大学附属珠海医院眼科,广东 珠海 519000)
2019 新型冠状病毒[1]是一种新型β 属冠状病毒,可引起人类呼吸道感染,已成为当今世界头号公敌,给人类社会带来了深重的灾难和影响。2019新型冠状病毒感染导致的肺炎称为新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)。使用RT-PCR 检测病毒RNA[2],为COVID-19 的诊断提供直接证据。为降低临床检测中的假阴性率,更新检测技术一直是研究者关注的热点[3-4],忽视新型冠状病毒标本采集的质量评价以及标本质量不合格,会导致核酸检测结果假阴性/假阳性,不合格标本的重新采样复查会导致核酸检测结果时效延长进而影响疫情评估和决策等。在应对COVID-19 疫情等重大突发公共卫生事件的过程中,新型冠状病毒的核酸检测结果的准确性和时效性对于疫情的防控决策非常重要,且我国对新型冠状病毒核酸检测的结果时效提出了明确要求[5]。为提高核酸检测标本采集质量,本文对核酸检测标本的不合格原因进行分析,并根据分析结果对临床进行标本采集质量的改进和监控,可以提高送检标本质量与合格率,保障时效性和结果的有效性,现报告如下。
1 资料与方法
1.1 一般资料 选择2020 年1 月26 日至2020 年2月14 日送检咽拭子和鼻拭子标本3 718 例(其中咽拭子标本3 715例,鼻拭子标本3例)及2020年6月1日至30日送检鼻咽拭子标本40 982例为研究对象。标本质量标准参照ISO15189 实验室标本认可准则[6],不合格类型有:①标本送检的保存条件不合格;②标本保存液泄露;③标本容器错误;④标本类型错误;⑤患者标识不清、信息不全。
1.2 方法
1.2.1 调查访谈 以质性研究现象学研究方法为指导[7],通过半结构式访谈,调查新型冠状病毒标本采集人员对相关知识需求。经过比较与归纳,从访谈中提炼出3 个主题概念:①因新型冠状病毒相关知识更新快,对该标本不同部位采集方法掌握欠缺,希望能增加标本采集流程及方法培训。②对新型冠状病毒标本采集后的处理不当,如折断无菌拭子杆和试管盖子处理等。③运送箱的处理和采样后环境的处理欠缺。
1.2.2 采集人员的需求 以ISO15189 实验室标本质量指标要求,建立新型冠状病毒标本采集流程指引。见图1、图2。
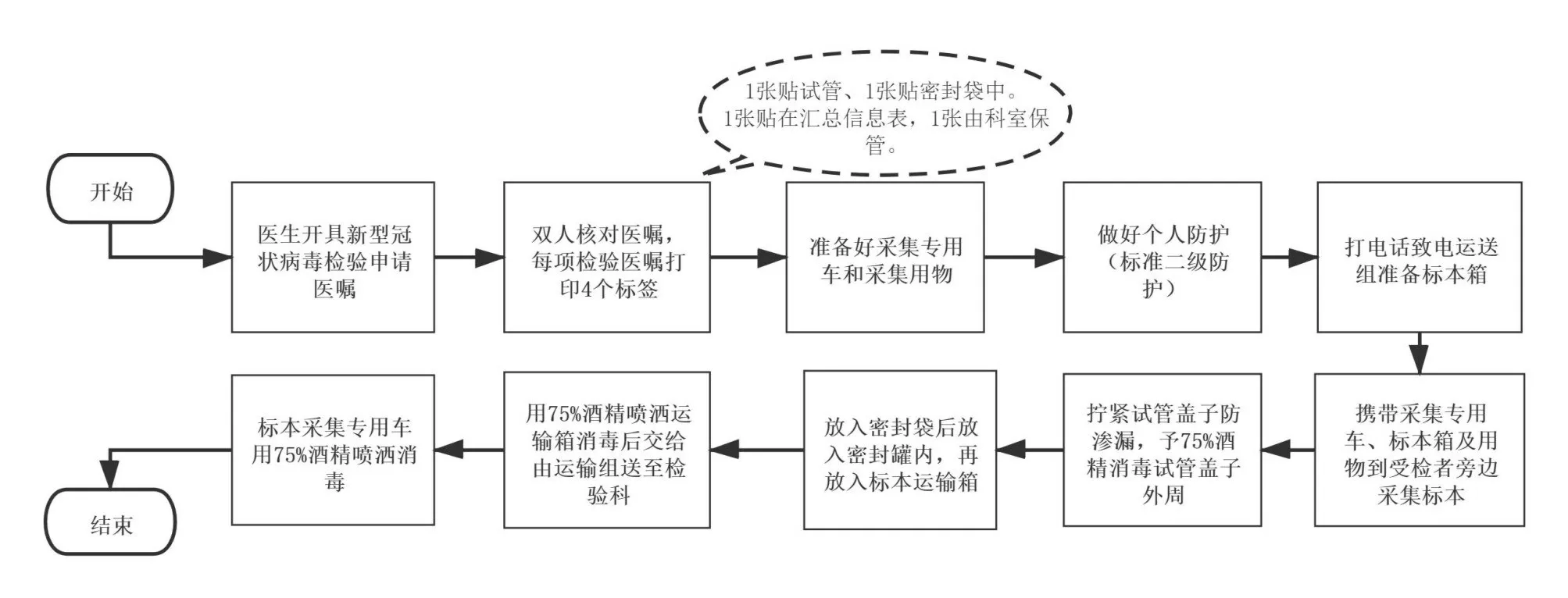
图1 新型冠状病毒院内标本采集流程图

图2 新型冠状病毒外出采集标本流程图
1.2.3 对新型冠状病毒标本采集全流程质量控制 ①标本采集准备工作的质量控制:重视标本采集技能培训,制定新型冠状病毒标本采样流程,采集人员掌握标本采集技术规范[8-10],认真学习采集操作规程,请院感专家指导安全防护。②采集过程中的质量控制:采集前做好患者宣教,告知标本采集的目的及配合方法,取得患者配合。准备采集用具和条形码。操作前双人核对,核对患者姓名、性别、采集部位、身份证号码等[11]。采集时观察患者生理变化,如有异常及时处理。③标本采集后管理的质控:标本密闭管理,标本装入密封袋,每袋限制装一份标本,直立放入密封罐中。用于标本保存运送的运送箱管理的质控,每批次对标本运送箱温度进行监控,全程环境管理与生物安全防控质控管理。
1.3 不合格标本分布及原因情况分析 对质量控制前2020 年1 月26 日至2020 年2 月14 日的3 718例标本按分布及不合格原因,以及经过质量控制后2020年6月1日至30日不合格标本分布及不合格原因进行分析。
1.4 统计学方法 数据采用SPSS 18.0 软件进行统计分析,计量资料以n(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 质控前后新型冠状病毒标本不合格标本的分布情况 质量控制前不合格标本分布在全院各科室及分院,其中分院、发热门诊及急危重症医学科不合格标本量较多,质量控制后不合格标本量下降。见表1。

表1 不合格标本的来源分布情况
2.2 质量控制前后新型冠状病毒标本不合格标本原因分类情况 质量控制前,不合格标本类型中以标本保存液泄露、标本送检的保存条件不合格以及标本容器错误多见,质量控制后,三种原因引起的不合格标本量均下降。见表2。
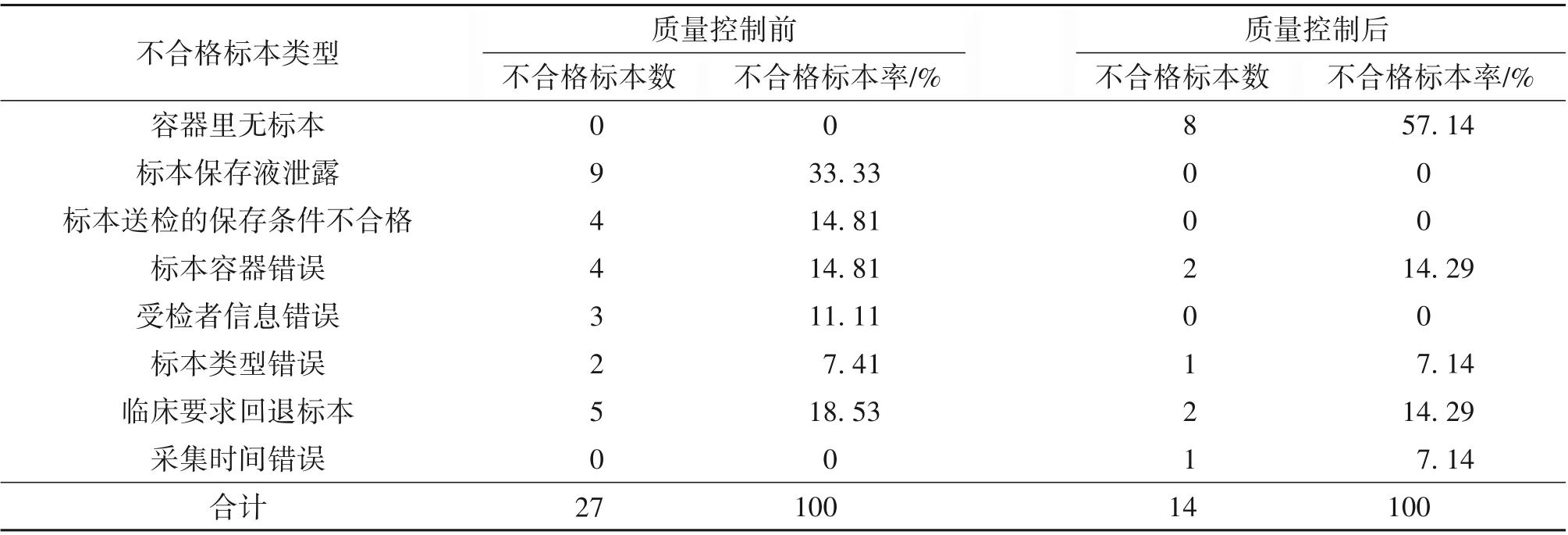
表2 不合格标本原因分类及所占不合格标本比例/n(%)
2.3 质量控制前后新型冠状病毒标本采集达标率与质量控制前相比,质量控制后标本达标率增加,差异有统计学意义(P<0.05)。见表3。
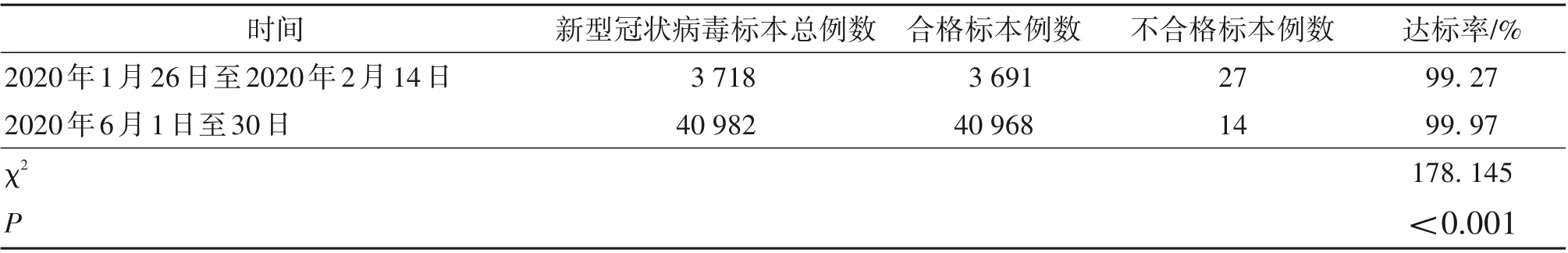
表3 新型冠状病毒标本采集达标率/n(%)
3 讨 论
3.1 分析标本来源,从源头分析标本不合格原因质量控制前,标本不合格的来源分布见表1。下级分院标本,同一种不合格原因反复出现,经过迅速反馈,下级分院标本的不合格率有所降低。在医院本部的各临床科室中,发热门诊和内科系统的不合格标本数比例最高,其中不合格原因的前3 位分别是“标本送检的保存条件不合格”“标本容器错误”“标本类型错误”,这与标本采集者责任心不强、未做好核对、采集前准备工作不充分有关。
3.2 分析原因,解决问题,提高标本合格率 标本采集是临床检验工作的第1 道程序,不规范的标本采集、储存和运送是导致检验报告误差的重要原因[12],从表2 可以看出,在质量控制前,新型冠状病毒核酸检测标本不合格原因分别有“标本保存液泄露”“标本送检的保存条件不合格”“标本容器错误”“受检者信息错误”“标本类型错误”等。①保存液泄露是标本不合格的最主要原因,大部分由于病毒采样管的管盖没有拧紧导致。标本采集过程中[13],刷采完后应当将拭子放进病毒采样管中,在靠近顶端处折断棉签杆,旋紧管盖。通过访谈调研一线采样人员发现,由于标本采集者对新型冠状病毒有一定的恐惧心理,在压断拭子刷尾部后,匆忙盖上盖子即装入封口的标本袋,未对病毒采样管进行核查。标本采集时,由于采集人防护多、触感降低、眼罩模糊而未及时发现盖子未拧紧,导致标本保存液泄露。②标本送检的保存条件不合格有以下两种原因:未使用标本袋封装病毒采样管;未在标本运送箱内放置冰袋。标本采集者在采集新型冠状病毒标本准备工作时,未提前准备充足数量的标本封口袋,未打开标本运送箱评估箱内情况等,导致标本送检保存条件不合格。③标本容器错误原因:新型冠状病毒标本误放在普通呼吸道病毒采样管,普通呼吸道病毒采样管内即无保护病毒RNA 的有效成分,也不含胍盐等病毒灭活剂。因此不正确使用病毒采集管容易导致病毒RNA 裂解破坏,也带来一定的生物安全隐患。同时,由于部分采集者责任心不强,没有及时核对标本信息和要求,医院培训不充分等原因导致。④受检者信息错误的原因:常见于临时性外出采集的标本,此类外采点人群的信息经常在多部门之间传递,尚无有效的机制校对或核准该信息的一致性;还见于患者提供错误的个人信息所导致,或临床对受检者的身份识别流程不规范等原因导致。⑤标本类型错误的原因:多见于受检者提供的其他部位体液或标本,临床申请或执行医嘱时没有仔细核对标本类型,习惯性地填写鼻咽拭子作为标本类型导致。
3.3 通过对标本采集全流程护理质量控制,标本不合格率降低,标本合格率升高 从表1、表2得出,进行标本采集流程的质控管理,分院标本不合格率降低,因保存措施不当、受检者信息错误导致标本不合格原因不再出现,这说明进行标本采集全流程护理质量控制有效。虽质量控制后,不合格标本原因出现新的类别,但不合格标本总的类别降低。新原因的出现因标本量的急剧增加出现,这需要我们进一步进行质量分析改进。
3.4 对新型冠状病毒标本采集流程质控管理 对采集者进行针对性的反馈培训,可减少采集过程导致的标本不规范。在核对阶段,加强对被采集者身份证号码识别记录,减少标本信息错误、漏输、错输等问题,确保标本相关信息可追溯。加强指导标本运输人员对运送箱的管理,规范使用过程要求和方法,对标本运送各个环节进行标准化,可以减少因标本运送箱原因导致的标本污染,减少因温度变化而导致的标本病毒RNA 裂解等问题。运用管理手段,在新型冠状病毒标本采集、保存、运输过程中进行质量控制,是一种简便安全、满足医疗需求的方法,同时满足生物安全的防控要求。
4 结 论
新型冠状病毒核酸检测花费时间长,约4~6 h才能出结果,对标本质量有明确的要求[14]。当标本不合格导致标本拒收后,需要对受检者重新采样,增加了标本采集者的感染风险。且受检者在接受第2次采集后,需再次花费时间等待核酸结果,受检者心理承受极大的压力。一旦需要重新采样,对患者、临床工作者、核酸检测人员均造成不利影响。故需要不断优化样本采集的操作和方法,加强质控管理[15],制定针对重点疫区和普通地区人群筛查新型冠状病毒标本采集护理操作详细指引和有效的采集标本质量评估体系,进一步提高高危人群、筛查人群的新型冠状病毒核酸检测阳性检出率和实时荧光RT-PCR 核酸诊断效能。为社会降低新型冠状病毒的防控诊治的成本,提高医院医疗资源的利用。
