MicroRNA-143-5p调控AMPK通路在颈椎间盘退行性变中的作用及机制研究
2021-12-23胡海权
胡海权,张 斌
(1. 瑞金市人民医院骨科,江西 瑞金 342500;2. 南昌大学第一附属医院骨科,江西 南昌 330006)
椎间盘退行性变(Interver-tebral Disc Degeneration,IDD)是一种普遍但复杂的脊柱疾病,患病率极高,给患者和家庭带来严重影响,增加社会经济负担[1]。IDD 发病目前认为与细胞外基质的丢失、正常椎间盘细胞改变、细胞代谢下降及炎症因子的释放相关[2]。miRNAs 在基因和蛋白表达的调控中起着重要作用,参与多种生理和病理过程,如增殖、侵袭、凋亡、衰老等。越来越多的研究显示,miRNA 在髓核细胞、纤维环细胞、软骨终板细胞的凋亡、增殖及细胞外基质代谢中发挥重要作用,但其具体机制仍不清楚[3]。椎间盘由周围的纤维环、中间的髓核及上下软骨终板组成。营养物质通过软骨终板选择性进入髓核,对其进行营养供应和代谢物质交换。软骨终板的退变在椎间盘退变过程中起着重要作用。本研究采用颈椎退变椎间盘和无退变椎间盘软骨终板组织样本,应用基因芯片筛查表达差异的miRNA,探索其发生发展调控机制,为临床上IDD防治提供新的方向和思路。
1 资料与方法
1.1 一般资料 选取2019 年2 月至2020 年5 月在南昌大学第一附属医院骨科就诊,依据临床症状和体征及经X 线片、CT 和MRI检查确诊为颈椎椎间盘退变行前路椎间盘切除术患者21例(退变组),男12例,女9 例,年龄46~73 岁,平均(61.6±5.6)岁;选择外伤导致颈椎椎体爆裂性骨折、需行前路减压椎间盘切除术的无椎间盘退变患者13例(对照组),男9 例,女4 例,年龄26~35 岁,平均(26.8±2.6)岁。排除标准:患结核、肿瘤、糖尿病、遗传代谢疾病以及先天性畸形患者;近3 个月进行免疫抑制剂治疗的患者。两组患者均对治疗知情及签署同意书。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
1.2.1 miRNA测序 椎间盘软骨终板组织送上海英拜生物医学科技有限公司进行基因芯片分析,芯片采用Agilent human miRNA,Microarrays 21.0(ID:080558)。提取每个样本的总RNA,经NanoDrop ND-2000(Thermo Scientific)定量并使用Agilent Bioanalyzer 2100 检测RNA 完整性。RNA 质检合格后,参照芯片标准流程进行样本的标记、芯片的杂交以及洗脱。总RNA 经过去磷酸化,变性,再进一步用Cyanine-3-CTP(Cy3)标记。标记好的RNA 纯化后和芯片杂交,洗脱后利用Agilent Scanner G2505C(Agilent Technologies)扫描得到原始图像,进行miRNA的生物信息学分析及靶基因预测。
1.2.2 miRNAs 的qRT-PCR 验证 取出椎间盘组织并解冻,Trizol(Invitrogen公司,美国)裂解组织,提取总RNA,逆转录成cDNA,设定PCR 反应条件:90 ℃10 min,95 ℃12 s,60 ℃2 min,共45 个循环。用SYBR Green Mater Mix 试剂(ABI 公司,美国)检测mRNA 水平,重复3 次。使用8500 Real-time PCR仪(ABI公司,美国),用ΔΔCT 法对qRT-PCR 结果进行定量分析,ΔCT 值为目的mRNA CT 值与内参mRNA CT 值的差值,ΔΔCT 为各退变组ΔCT 与空白正常组ΔCT 的差值,平均相对含量=2-ΔΔCT。引物序列见表1。

表1 qRT-PCR相关引物序列
1.2.3 免疫组化法 椎间盘软骨终板组织用4%多聚甲醛溶液固定48 h,常规石蜡切片。将切片常规脱蜡水化,枸橼酸盐修复液高压修复50 min,3%H2O2甲醇避光孵育10 min,10%山羊血清37 ℃孵育40 min,加入兔抗eEF-2一抗(1∶100),于4 ℃孵育过夜。辣根过氧化物酶标记的羊抗兔二抗37 ℃孵育35 min,DAB 显色。待细胞着色而背底颜色较淡时,蒸馏水终止显色。苏木素染色60 s,盐酸乙醇分化1~2 s,脱水封片。采用Image Pro Plus 6.0 图像分析软件计数。
1.2.4 Western blot 法 检测组织细胞中AMPK、p-AMPK、eEF-2、GAPDH 蛋白表达。两组组织裂解后,提取总蛋白,BCA 法检测样品蛋白含量,各组取40 μg 蛋白分别进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳进行分离,100 V 电压电泳约30 min,待Marker 条带跑开后120 V 电压继续电泳约l h,90 V 下PVDF 膜半干转60 min,5%脱脂牛奶/TBST 液封闭3 h,分别加入一抗(1∶1 000),4 ℃孵育过夜,TBST清洗后加入羊抗兔二抗(1∶500),室温孵育2 h,TBST 洗涤后加入发光液。图像处理软件对蛋白条带进行分析。
1.3 统计学方法 采用SPSS 19.0 统计学软件进行数据分析,采用均数±标准差表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 正常组与退变组的椎间盘组织的病理改变
正常组椎间盘组织镜检显示结构清晰正常,富含髓核细胞、软骨终板和富含蛋白多糖;退变组椎间盘组织镜检显示结构紊乱,圆形髓核细胞增加显著,占40%~50%,呈现空泡变性和集群分布(图1)。
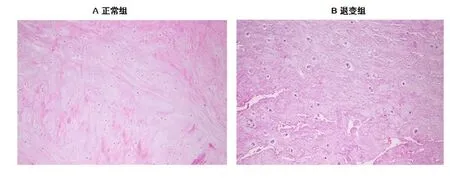
图1 正常组与退变组患者椎间盘病理改变(HE×100)
2.2 miRNAs数据分析结果
2.2.1 miRNA 基因芯片的差异表达分析 取3 例正常的椎间盘组织和3 例退行性变的椎间盘组织进行基因芯片测序。在正常组和退变组中共计发现1 162 个miRNAs,而在正常组和退变组间共筛选出35 个差异表达的miRNAs,其中上调22 个,下调13 个(图2A)。从聚类热图(图2B)中可以看出,正常组与退变组的椎间盘组织具有相似的聚类情况和表达谱,正常组的N1、N2 和N3 中差异表达的基因具有相似的聚类情况,退变组的D1、D2 和D3 差异表达的基因也具有相似的聚类情况,可见两组间的组织间差异不大,测序结果较好。
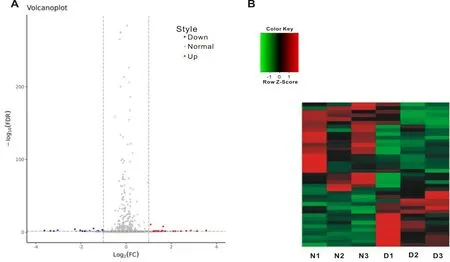
图2 基因芯片鉴定正常组和退变组之间差异表达的miRNAs
2.2.2 差异表达的miRNAs 的靶基因分析结果基于miRNA变化值>2或<0.5且P<0.01,筛选后进一步验证。hsa-miR-143-5p,hsa-miR-222-5p,hsamiR-140-5p,hsa-miR-199a-5p 和hsa-miR-132 在正常组和退变组中表达差异有统计学意义。通过qRTPCR 验证显示,与正常对照组相比,退变组hsamiR-143-5p 表达差异有统计学意义(P<0.01),hsamiR-222-5p、hsa-miR-140-5p、hsa-miR-199a-5p 和hsa-miR-132差异无统计学意义(P>0.05)(表2)。
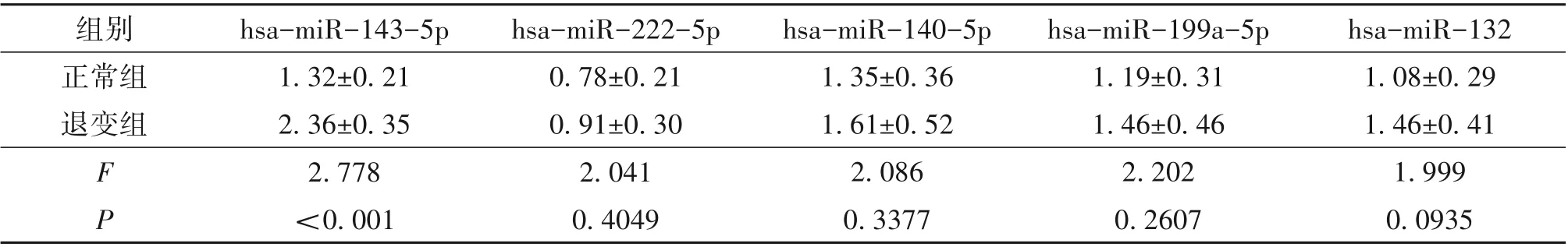
表2 qRT-PCR验证miRNAs的差异表达
2.3 免疫组化和蛋白免疫印迹实验结果
2.3.1 WB 与免疫组化显示退变组的eEF-2 蛋白含量显著降低 采用WB 和免疫荧光法检测eEF-2在正常组和退变组的蛋白表达变化。WB 结果显示,与正常组相比,退变组的eEF-2 含量显著降低,差异有统计学意义(P<0.05,)(图3);免疫组化结果显示eEF-2在退变组表达降低(图4)。
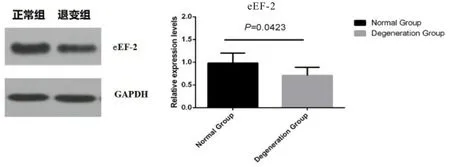
图3 WB显示抑制AMPK下游eEF-2
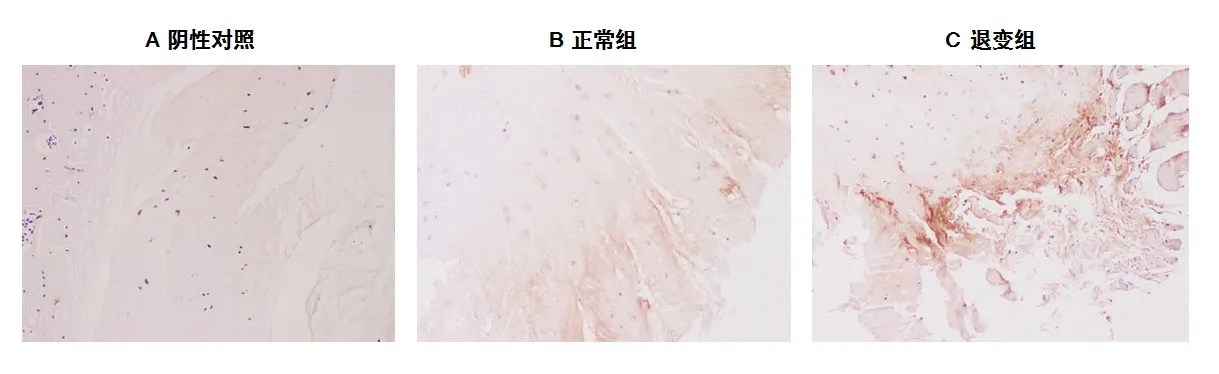
图4 免疫组化显示抑制AMPK下游eEF-2(SP×400)
2.3.2 WB 检测两组p-AMPK、AMPK 表达 采用WB 方法检测p-AMPK 和AMPK 在正常组和退变组的蛋白表达变化。结果显示,与正常组相比,退变组的p-AMPK 表达增加(P<0.01),AMPK 表达差异无统计学意义(P>0.05)(图5)。
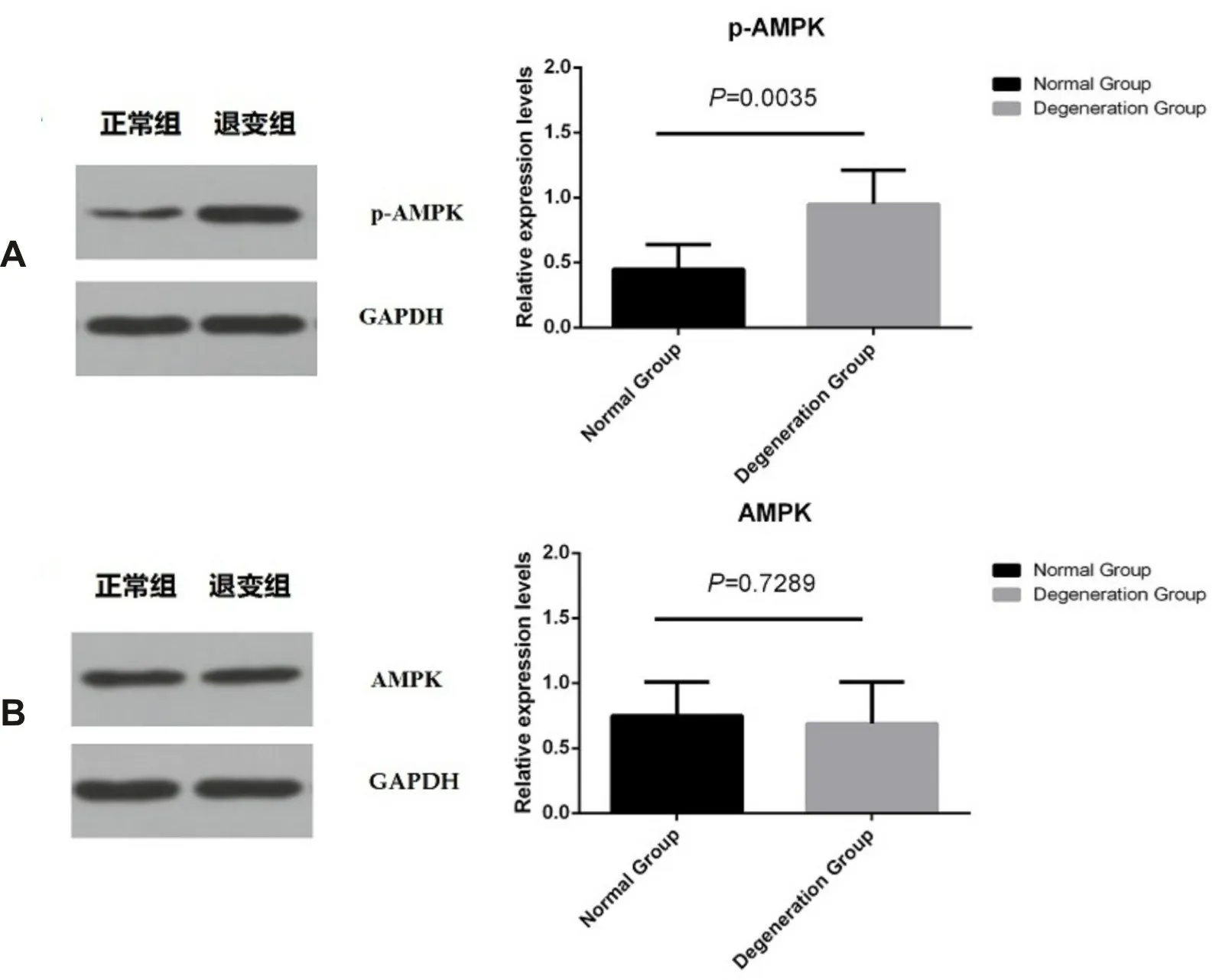
图5 WB检测两组p-AMPK和AMPK的表达
3 讨 论
在椎间盘退变过程中,椎间盘组织发生了复杂的生物化学以及分子水平的改变。目前认为椎间盘细胞的分化、增殖、凋亡、表观遗传和基因等是IDD 的风险因素[4]。我们的研究显示,正常组的椎间盘髓核的结构和细胞与退变组有显著差异,但其具体的机制不清楚。miRNA是由18~22个核苷酸组成的非编码单链RNA,高度保守,大部分miRNA 通过与靶基因3与靶基区互补结合,调控靶基因-蛋白质的过程,从而达到在细胞、组织,甚至个体水平上影响机体的生理病理[5]。目前有研究显示,miRNA与椎间盘退行性变密切相关[6]。多种miRNA 主要通过作用于细胞凋亡、炎症信号反应、细胞外基质成分等环节参与影响IDD 的发生发展[7]。miR-143-5p 参与多项疾病的进展,如细胞的分化、增殖、凋亡及细胞外基质降解等[8]。KARIMI L 等[9]研究显示,miR-143-5p 具有对肌肉分化和老化的作用;过表达miR-143-5p可导致黑色素瘤细胞的迁移、增殖和黑色素的生成,沉默表达miR-143-5p有助于促进牙髓干细胞的分化。在IDD 中研究显示,miR-143-5p可抑制髓核细胞的增殖、分化,促进细胞的凋亡和衰老。目前也有研究发现,miR-143-5p 在退行性变椎间盘中高表达,其通过负调控BCL-2促进IDD 的进展[10]。我们通过对退行性变的椎间盘组织进行基因筛查发现,退行性变患者的椎间盘组织miRNA 发生了系列变化。在退行性变患者颈椎间盘组织细胞中筛选出35个差异表达miRNAs,其中22个表达上调,13个表达下调,随后扩大样本量,运用qRT-PCR验证芯片结果,显示hsa-miR-222-5p,hsa-miR-140-5p,hsamiR-199a-5p 和hsa-miR-132 表达水平无显著差异,仅有hsa-miR-143-5p 表达显著增加。因此,本研究选取miR-143-5p进一步研究。
AMPK 是能量代谢的感受器,被称为能量代谢的调节器,能协调细胞的合成代谢和分解代谢[11]。主要受到细胞内的AMP/ATP 比例调控[12]。AMPK参与了众多的生理病理过程,如缺氧、缺血、低糖等各种应激反应[13]。AMPK 在参与软骨的形成和降解过程中发挥重要作用,与关节的活性和关节软骨的退行性变密切相关。AMPK 参与细胞的凋亡和炎症反应。YANG Q 等[14]对腰椎间盘的研究提示,发现AMPK 参与了腰椎间盘的退行性变。这与我们的研究较为一致。我们研究结果显示,退行性变的椎间盘中p-AMPK 高表达。eEF-2 在调控蛋白合成中起着重要作用[15]。miR-143-5p 可以靶向调节eEF-2 基因。通过模拟miR-143-5p 物可以激活AMPK,提示miR-143-5p通过作用eEF-2调控AMPK,我们在椎间盘退行性变中发现p-AMPK增加,eEF-2表达降低。
综上所述,miR-143-5p 在颈椎退行性变患者的椎间盘软骨终板组织中呈高表达,且其表达量与椎间盘退变密切相关。同时,miR-143-5p 可能通过AMPK通路介导椎间盘退行性变。
