嗜水气单胞菌RecA和Gap-2作为内参蛋白的评价
2021-12-22黄雁,李月,赵晶,陈明
黄 雁,李 月,赵 晶,陈 明
(1.大连工业大学 生物工程学院,辽宁 大连 116034;2.大连民族大学 生命科学学院,辽宁 大连 116600 )
0 引 言
嗜水气单胞菌(Aeromonashydrophila)为革兰氏阴性致病菌,在水体中广泛存在,能够感染多种鱼类并引发败血症,给水产养殖业造成经济损失[1-3]。嗜水气单胞菌的致病性与毒力因子的表达密切相关[4]。目前针对嗜水气单胞菌的毒力基因,多采用实时荧光定量PCR技术研究其转录水平,在蛋白表达水平上的研究分析较少。Western Blot技术可通过特异性抗体钓取目的蛋白,能够更直观准确的检测不同条件下毒力蛋白的表达变化,而选取稳定表达的内参蛋白是保障该技术分析准确的先决条件[5-6]。然而,目前尚无嗜水气单胞菌内参蛋白的研究报道,限制了对嗜水气单胞菌毒力蛋白表达及调控的深入研究。
已有报道recA和gap在某些微生物中可作为荧光定量PCR的内参基因[7-8]。嗜水气单胞菌基因组注释表明,recA编码具有DNA修复功能的重组酶RecA,gap-2编码催化3-磷酸甘油醛生成1,3-二磷酸甘油酸的3-磷酸甘油醛脱氢酶Gap-2[9-10]。有报道鸭疫里默氏杆菌的RecA和大肠杆菌GADPH可作为两种菌Western Blot的内参蛋白[11-13],同源性分析显示,嗜水气单胞菌与鸭疫里默氏杆菌RecA氨基酸序列同源性达到57.07%,Gap-2与大肠杆菌GADPH氨基酸序列同源性达到83.99%。因此,本实验选取嗜水气单胞菌RecA和Gap-2为研究对象,对两种蛋白进行异源表达及抗体制备,并对其作为Western Blot内参蛋白的表达稳定性进行了评价,以期为嗜水气单胞菌毒力蛋白表达及调控的深入研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌种及质粒
嗜水气单胞菌A.hydrophilaATCC 7966,中国普通微生物菌种保藏管理中心;大肠杆菌E.coliDH5α、BL21(DE3),北京全式金生物技术有限公司;质粒pET-28a,本实验室保存。
1.1.2 试 剂
细菌基因组DNA提取试剂盒,成都福际生物技术有限公司;AxyPrep Plasmid Miniprep Kit,康宁生命科学(吴江)有限公司;SanPrep柱式DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;DpnI酶,赛默飞世尔科技(中国)有限公司;IPTG、BSA封闭液、10×印迹膜转印缓冲液、2′2-联吡啶(Dip)、血红素(Hemin)、TMB显色液,生工生物工程(上海)股份有限公司;ECL化学发光底物,上海天能科技有限公司。
1.2 方 法
1.2.1 重组表达载体的构建
NCBI中检索A.hydrophilaATCC 7966的recA(AHA_3716)、gap-2(AHA_3618)基因序列,设计引物(表1)。提取A.hydrophilaATCC 7966基因组,以此为模板分别扩增1 065 bp的recA和996 bp的gap-2。经1%琼脂糖凝胶电泳检测扩增成功后,采用RF克隆法将扩增产物分别与pET-28a载体连接,DpnI酶处理后,化学转化E.coliDH5α感受态细胞,挑取阳性重组子,对重组质粒pET-28a-recA、pET-28a-gap-2进行电泳鉴定。选取大小正确的重组质粒送生工生物工程(上海)股份有限公司进行测序。
1.2.2 重组蛋白RecA和Gap-2的诱导表达
将测序正确的重组质粒pET-28a-recA、pET-28a-gap-2分别转化到E.coliBL21(DE3),接种于含有50 μg/mL卡那霉素的LB培养基中,37 ℃、180 r/min摇瓶培养12 h后,按1%的接种量转接于LB培养基,37 ℃、180 r/min条件下摇瓶培养,待菌体浓度OD600达到0.7左右,添加IPTG至终浓度0.5 mmol/L,将温度调至30 ℃诱导蛋白表达8 h。菌液于4 ℃、5 000 r/min离心10 min,收集菌体。
1.2.3 重组蛋白RecA和Gap-2的纯化
重组RecA和Gap-2蛋白设计带有组氨酸标签(His-tag),可进行镍离子亲和层析纯化。纯化过程全程冰浴,用缓冲液(20 mmol/L Tris-HCl,pH 8.0、150 mmol/L NaCl)重悬菌体,超声破碎,将细胞裂解液于4 ℃、12 000 r/min离心30 min,收集上清于亲和层析柱中结合30 min,用含有30 mmol/L 咪唑的缓冲液洗脱杂蛋白,再用含有250 mmol/L咪唑的缓冲液洗脱目的蛋白。将洗脱液于4 ℃、5 000 r/min离心浓缩至5 mL,用凝胶过滤层析纯化。
1.2.4 重组蛋白兔源多克隆抗体的制备及效价检测
将纯化的RecA和Gap-2蛋白对健康的4月龄雌性新西兰大白兔进行注射免疫制备多克隆抗体。采用间接ELISA法对亲和纯化后的抗体效价进行测定:用0.05 mol/L碳酸盐包被抗原(纯化的RecA或Gap-2),每孔0.2 μg,4 ℃孵育过夜。洗板后,用5%脱脂奶粉封闭。以纯化抗体为一抗,倍比稀释后孵育,以辣根酶标记山羊抗兔IgG为二抗,1∶8 000稀释后孵育,加入TMB显色液显色后,在450 nm波长下测定OD。
1.2.5 Western Blot分析嗜水气单胞菌RecA和Gap-2的表达稳定性
以培养时期、培养温度及培养环境中铁离子浓度作为评价RecA和Gap-2表达稳定性的影响因素。收集各培养条件下的菌体,加入5×蛋白上样缓冲液,沸水浴10 min,于12%的聚丙烯酰胺凝胶中进行电泳,以半干转方式在80 V、40 min 条件下将蛋白转于PVDF膜上,用1%牛血清蛋白封闭2 h,“1.2.4”中制备的抗体按1∶10 000 稀释后在4 ℃孵育过夜,辣根酶标记山羊抗兔 IgG以1∶10 000稀释在室温下孵育2 h,最后用ECL化学发光底物工作液进行显影。
2 结果与分析
2.1 重组表达载体的构建
从嗜水气单胞菌基因组上扩增recA和gap-2,基因片段,分别与pET-28a连接,化学转化至E.coliDH5α感受态细胞,挑取阳性重组子,提取重组质粒进行电泳分析。结果如图1所示,重组质粒大小与预期相符。对大小正确的pET-28a-recA、pET-28a-gap-2重组质粒进行进一步PCR验证,扩增出大小正确的基因片段(结果未显示),送质粒进行测序。
2.2 RecA和Gap-2重组蛋白分离纯化
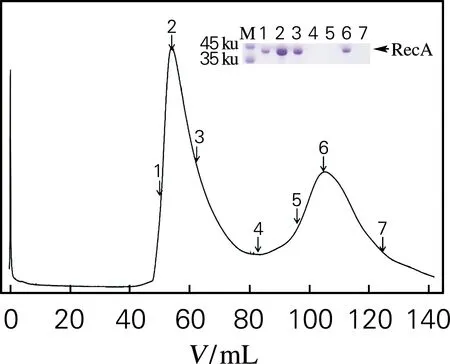
将测序正确的重组质粒转化至E.coliBL21(DE3)进行诱导表达,对目的蛋白进行层析纯化及SDS-PAGE鉴定。由图2可见,成功地诱导表达了两重组蛋白,均主要以细胞内可溶性蛋白的形式存在,亲和层析纯化后在观察到较为单一且明显的条带(条带6),与His标签融合重组蛋白RecA(39.7 ku)和Gap-2(37.4 ku)大小相符。
由图3可以看出,收集得到的RecA和Gap-2蛋白纯度较高。图3(a)中有2个洗脱峰经SDS-PAGE鉴定为目的蛋白,推测重组蛋白RecA在溶液中除单体外,还存在二聚体或多聚体的聚合形式。图3(b)中重组蛋白Gap-2的吸脱峰有些拖尾,SDS-PAGE结果表明均为Gap-2,可能是分子筛柱效不良所致。
2.3 RecA和Gap-2抗体效价测定
用纯化的RecA和Gap-2蛋白制备兔免疫血清,经亲和纯化后获得抗体。梯度稀释抗体,经酶联免疫吸附剂测定(ELISA),如表1所示,两重组蛋白制备的抗体梯度均达到1∶512 000。
(a)RecA蛋白
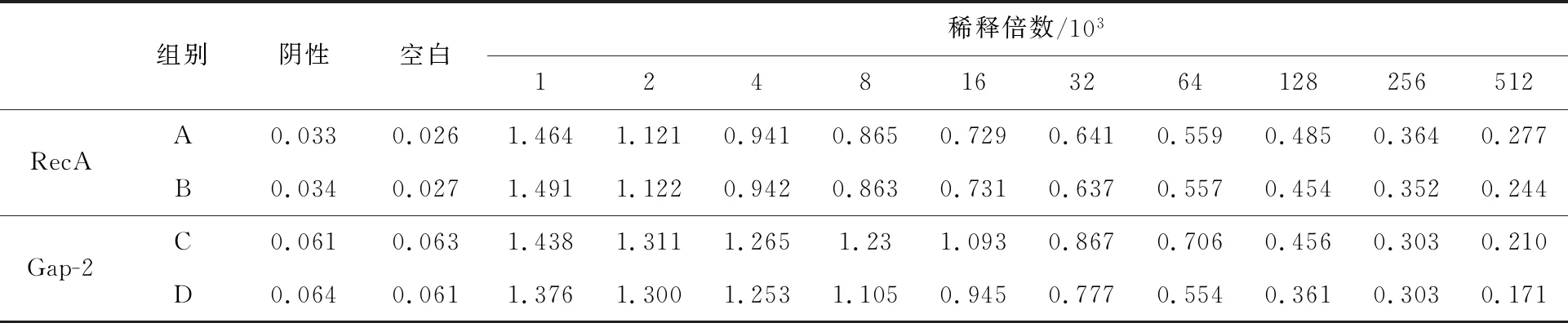
表2 RecA和Gap-2抗体效价分析(OD450)Tab.2 Titer analysis of RecA and Gap-2 antibodies
2.4 Western Blot检测RecA和Gap-2表达稳定性
收取不同生长时期、不同生长温度及铁离子浓度差异环境中培养的嗜水气单胞菌,在各组上样量一致的情况下进行Western Blot检测,如图4所示。RecA在不同温度培养条件下表达较为稳定;此外,RecA在OD600达到5时检测到目的条带明显减弱,推断是由于菌体处于生长稳定后期,胞内蛋白降解所导致的;另外有报道表明RecA在铁离子浓度差异条件下能恒定表达[11],但本研究中血红素丰富环境下,嗜水气单胞菌RecA表达略有降低,可能是血红素浓度过高对菌体生长限制导致的。相比而言,Gap-2在不培养条件下表达较为恒定,这可能是由于其参与糖代谢,是微生物生命活动必需的酶。

图4 Western Blot检测蛋白RecA和Gap-2的表达Fig.4 Western Blot results of RecA and Gap-2 expression
目前recA、gap多被报道在不同培养条件下用作荧光定量PCR的内参基因:如副溶血性弧菌中的recA在不同菌株和不同温度培养条件下表达较为稳定,萎缩果胶杆菌的recA在不同培养基、温度以及培养阶段表达均比较稳定,巴西固氮瘤菌的recA在正常生长和细胞分化的应激条件下,均被评价为表达最稳定的内参基因之一;而桦褐孔菌中gap在不同 pH、高温刺激和菌核发育阶段更适合作为内参基因[14-15]。目前,RecA作为Western Blot内参蛋白的报道仅见于鸭疫里默氏杆菌,而且仅在不同铁离子浓度下进行了其表达稳定性的分析。GADPH免疫抗体则仅用于不同源大肠杆菌的特异性识别,而缺乏该蛋白在不同条件下是否适合作为内参蛋白的进一步评估[11-13]。本研究则在更多样化的条件下评估了两种潜在内参蛋白的表达稳定性,为嗜水气单胞菌毒力蛋白的Western Blot检测提供了有效参考。
3 结 论
本研究成功地对嗜水气单胞菌中RecA和Gap-2蛋白进行了异源重组表达和分离纯化,并制备了效价较高的多克隆抗体。用于考察嗜水气单胞菌在不同培养时期、培养温度及铁离子浓度条件下RecA和Gap-2作为内参蛋白的表达情况,Western Blot检测结果表明,RecA在不同培养时期和铁离子浓度条件下表达并不恒定,而Gap-2在3种培养条件下表达均稳定表达,更适合作为嗜水气单胞菌的内参蛋白,也更有潜力作为广泛生长条件下的内参蛋白。
