发酵麦麸阿魏酰低聚糖的纯化工艺及其心脏保护作用研究
2021-12-21陈秋燕王瑞芳郝希然安晓萍齐景伟
陈秋燕 王 园 尹 娜 王瑞芳 郝希然 安晓萍 王 勤 齐景伟
(内蒙古农业大学动物科学学院1,呼和浩特 010018) (内蒙古自治区草食家畜饲料工程技术研究中心2,呼和浩特 010018) (内蒙古自治区药品检验研究院3,呼和浩特 010010)
齐景伟,男, 1966年出生,教授,生物饲料的研发与应用
小麦为禾本科的单子叶植物,是我国重要的经济农作物之一;麦麸是一种包裹在小麦颖果胚乳和胚芽中的复合植物体,麦黄色,呈片状或粉状,是小麦加工过程的主要副产品,年产量高达2 000万t以上[1,2]。研究表明麦麸的组成中大部分为非淀粉多糖,包括阿拉伯木聚糖、木葡聚糖和纤维素,其中木聚糖占干物质质量40%,此外还含有大量的酚醛酸、木质素和一些蛋白质等。存在于细胞壁中的酚酸被认为在多糖与木质素通过酯键和醚键的交联以及多糖链的交联中起着重要作用[3-5]。阿魏酸是谷物中含量最丰富的酚酸,也是麦麸中重要的功效成分之一。阿魏酰低聚糖 (Feruloylated oligosaccharides, FOs) 是由低聚糖中不同位置的糖羟基与阿魏酸羧基酯化形成的一类阿魏酰衍生物[6],兼具这两种物质的生理功能,且因其结构中特殊酯键的存在,FOs具有比游离阿魏酸更强的抗氧化作用[7,8],并具有较强的免疫调节、益生和减轻糖尿病综合症[8-10]等多种作用,对FOs的研究与利用越来越受到人们的重视。目前FOs主要采用酸水解法[11]、酶水解法[12]和生物发酵法[13]等进行提取,FOs粗提液中含有部分像色素和脂溶性成分等的杂质[14],致使FOs含量偏低,影响其功效的发挥,因此需对粗提液进行富集纯化,以提高FOs的纯度, 并评价其生理功能。
大孔吸附树脂由于其独特的多孔结构和较大的比表面积,已被广泛应用于天然产物有效成分的分离、纯化,是吸附性和分子筛性分离原理相结合的分离材料[15-17],具有选择性好、分离效果好、再生处理方便、吸附速度快等特点[18]。有研究表明,最适用于分离纯化FOs的大孔吸附树脂为Amberlite XAD-2[19-21],FOs是非极性的芳香族化合物,Amberlite XAD-2 对芳香族化合物有很强的吸附能力,能够吸附FOs中的阿魏酰基,达到分离纯化的效果。Sephadex LH-20是由葡聚糖 G-25羟丙基化加工而成,是基于被分离物质分子质量及其与酚酸的相互作用分离的技术[10]。因此,本实验在前期获得发酵麦麸FOs粗提物的基础上,以吸附率与解吸率为评价指标,利用Amberlite XAD-2型号大孔吸附树脂通过单因素筛选出发酵麦麸FOs的分离纯化工艺条件,用Sephadex LH-20 葡聚糖凝胶进一步纯化发酵麦麸 FOs的工艺条件,获得最佳的纯化条件,同时探讨了经分离纯化后的发酵麦麸 FOs对斑马鱼心脏损伤的保护作用,以期为麦麸FOs生物活性研究以及麦麸的高效利用提供参考。
1 材料与方法
1.1 材料与仪器
实验所用的麦麸均购于市场;实验用斑马鱼成鱼购于国家斑马鱼资源中心(中国,武汉);硼砂、甘氨酸、无水乙醇、氢氧化钠、二甲基亚砜(DMSO)和间氨基苯甲酸乙酯甲磺酸盐(MS222);大孔吸附树脂Amberlite XAD-2;SephadexLH-20过滤凝胶;特非那。
紫外可见光光度计,电热恒温水浴锅,旋转气浴恒温振荡器, SW-CJ 超净工作台, LRH-250F生化培养箱, QYC-200恒温培养摇床, IX51 奥林巴斯倒置显微镜,微孔板分光光度计。
1.2 实验方法
1.2.1 发酵麦麸FOs粗提液的制备
将发酵麦麸湿样置于45 ℃鼓风干燥箱中烘干48 h后进行粉碎,称取粉碎干燥发酵麦麸以料水比1∶10(g/mL)加入蒸馏水中,80 ℃热水浸提30 min,5 000 r/min离心10 min,取上清液,采用sevage法对上清液进行去蛋白,用80%乙醇进行沉淀,4 ℃静置12 h,离心取沉淀进行减压浓缩,浓缩液冷冻干燥,备用[22]。
1.2.2 发酵麦麸FOs的测定
利用双波长法[23]测定FOs浓度,准确称取发酵麦麸FOs 1 000 mg溶于100 mL蒸馏水中,将发酵麦麸FOs溶液与硼砂-甘氨酸缓冲溶液(0.1 mol/L,pH=10)按1∶9比例混合,分别于345 nm和375 nm处测定吸光度值。根据FA的摩尔吸光系数(M-1cm-1):ε′345=19 662,ε′375=7 630和FOs的摩尔吸光系数(M-1cm-1):ε345=23 064,ε375=31 430,计算FOs浓度。
C=[(ε′345×A375-ε′375×A345)b/(ε′345×ε375-ε345×ε′375 )]/C0
式中:C为发酵麦麸中FOs浓度/nmol/g;b为比色皿厚度/cm;A345为波长345 nm处OD值;A375为波长375 nm处OD值;C0为发酵麦麸FOs粗溶液质量浓度/mg/mL。
1.2.3 大孔吸附树脂Amberlite XAD-2的预处理
大孔吸附树脂预处理参照周俊良等[24]的方法并稍作修改,利用蒸馏水洗去大孔吸附树脂的破碎树脂和杂质,置于60 ℃鼓风干燥箱中烘干水分后用95%乙醇中浸泡24 h,使其充分溶胀,然后反复用蒸馏水将树脂洗至无白色浑浊且无乙醇味,置于60 ℃鼓风干燥箱中烘干4 h至质量恒定,取出大孔吸附树脂待用。
1.2.4 大孔吸附树脂Amberlite XAD-2吸附率和解吸率的测定
准确称量2.0 g预处理好的大孔吸附树脂Amberlite XAD-2置于锥形瓶中,加入30 mL发酵麦麸FOs粗提液,用封口膜将瓶口封紧,室温下置于120 r/min旋转气浴恒温振荡器中振荡12 h,待充分吸附后,将大孔吸附树脂过滤移除,取上清液,按照1.2.2测定吸附后溶液中FOs的浓度,按照式(1)计算大孔吸附树脂的吸附率。吸附实验结束后,将过滤后得到的大孔吸附树脂Amberlite XAD-2放入锥形瓶中,加入30 mL 50%乙醇解吸液,用封口膜将瓶口封紧,室温下置于120 r/min旋转气浴恒温振荡器中振荡12 h,振荡结束后将大孔吸附树脂过滤除去,取上清液,按照1.2.2测定解吸后溶液中FOs的浓度,按照公式(2)计算大孔吸附树脂的解吸率[25]。
A=(C0-C1)/C0×100%
(1)
D=(C2×V2)/(C0-C1)×V1×100%
(2)
公式中:A为吸附率/%;D为解吸率/%;C0为吸附前发酵麦麸FOs粗提液质量浓度/mg/mL;C1为吸附后发酵麦麸FOs质量浓度/mg/mL;C2为解吸后溶液中发酵麦麸FOs质量浓度/mg/mL;V2为解吸溶液体积/mL。
1.2.5 大孔吸附树脂Amberlite XAD-2静态吸附与洗脱条件优化
1.2.5.1 大孔吸附树脂Amberlite XAD-2静态吸附条件的优化
根据发酵麦麸FOs的纯化工艺,分别考察上样液浓度和上样液 pH对大孔吸附树脂Amberlite XAD-2静态吸附率的影响,当上样液 pH为5,上样液体积为30 mL时,上样液质量浓度分别为:3、3.5、4、4.5、5、5.5、6 mg/mL;当上样液质量浓度为4 mg/mL,上样液体积为30 mL 时,上样液pH分别为:1、2、3、4、5、6、7、8。
1.2.5.2 大孔吸附树脂Amberlite XAD-2静态解吸条件的优化
根据发酵麦麸FOs的纯化工艺,分别考察解吸液体积分数和解吸液 pH对大孔吸附树脂Amberlite XAD-2静态解吸率的影响,当解吸液 pH为4,解吸液体积为30 mL时,解吸液体积分数分别为: 10%、30%、50%、70%、80%、90%;当解吸液体积分数为50%,解吸液体积为30 mL 时,解吸液pH分别为:1、2、3、4、5、6、7、8。
1.2.6 大孔吸附树脂Amberlite XAD-2动态吸附与洗脱条件优化
1.2.6.1 大孔吸附树脂Amberlite XAD-2动态吸附条件的优化
大孔吸附树脂湿法装柱,准确称量处理后的树脂20 g装柱(2.25 cm×25 cm),加入质量浓度为4.0mg/mL、PH为4的发酵麦麸FOs上样液进行吸附,以每10 mL收集一次流出液,按照1.2.2测定流出液中FOs的浓度,按照式(1)计算大孔吸附树脂的吸附率。
1.2.6.2 大孔吸附树脂Amberlite XAD-2动态解吸条件的优化
大孔吸附树脂湿法装柱,准确称量处理后的树脂20 g装柱(2.25 cm×25 cm),用质量浓度为4.0 mg/mL、PH为4的FOs发酵麦麸FOs上样液40 mL上柱,流速为1.0 mL/min,用浓度为50%的乙醇水溶液进行解吸,每5 mL收集一次流出液,按照1.2.2测定流出液中FOs的浓度,按照式(2)计算大孔吸附树脂的解吸率。
1.2.7 发酵麦麸FOs凝胶层析分离纯化1.2.7.1 Sephadex LH-20凝胶预处理
参照曾彩凤[21]的方法并稍作修改,将Sephadex LH-20凝胶填料用质量分数25%乙醇溶液浸泡12 h,层析柱垂直装柱,柱中预留 2~3 cm的蒸馏水,缓慢搅动填料,并立即沿玻棒匀速缓慢的倒入洗脱管内约三分之一,使之在柱内自然沉降,待从柱底到上端慢慢积实且上面澄清、洗脱床稳定后,打开横流泵,用质量分数25%的乙醇溶液冲洗24 h,直至凝胶积实不再下降,最终离柱顶约5~6 cm。
1.2.7.2 洗脱剂的确定
将配制成1% FOs样液0.25 mL加入Sephadex LH-20 层析柱(2.25 cm×25 cm),分别用水溶液、15%乙醇、25%乙醇、35%乙醇作为洗脱剂洗脱,流速为0.5 mL/min,各收集40管,每管收集2 mL,在375 nm下检测吸光度。
1.2.7.3 上样体积的确定
将配制成1%质量浓度FOs样液各0.125、0.25、0.375、0.5 mL分别上Sephadex LH-20层析柱(2.25 cm×25 cm),采用25%乙醇溶液洗脱,流速为0.5 mL/min,各收集40管,每管收集2 mL,在375 nm下检测吸光度。
1.2.7.4 流速的确定
将配制成1%质量浓度FOs样液0.125 mL,分别上Sephadex LH-20 层析柱(2.25 cm×25 cm),采用25%乙醇溶液,分别在流速为0.3、0.4、0.5、0.6mL/min下进行洗脱,各收集40管,每管收集2 mL,在375 nm下检测吸光度。
1.2.8 紫外光谱分析
将发酵麦麸FOs配制成0.5 mg/mL溶液,利用紫外分光光度计在波长为200~400 nm范围内进行紫外吸收光谱扫描分析。
1.2.9 斑马鱼心脏保护作用实验1.2.9.1 斑马鱼胚胎培养
斑马鱼亲鱼饲养于玻璃水族缸中,水温为(28.5±1) ℃,光周期为14 h/10 h(光照/黑暗),每日以人工配合饲料和丰年虫交替饲喂四次,实验所用胚胎由健康雌雄鱼自然交配获得。实验前将体质健壮、产卵迹象明显的亲鱼按雌雄比例1∶2 分别置于孵化箱中,采用隔板将雌雄亲鱼隔开,于次日光照前移除隔板使雌雄亲鱼自由交配受精产卵,收集受精卵进行消毒和清洗,置于斑马鱼胚胎培养水中,放置于(28.5±1) ℃下培养,备用。
1.2.9.2 斑马鱼心率的测定
挑选受精且发育至24 hpf(hours post fertilization,受精后时间)的胚胎转移至24孔板中,实验分为5个处理组,分别为正常对照组、特非那定组(1.25 μg/mL)和给药治疗组 (1.25 μg/mL 特非那定+发酵麦麸FOs溶液),给药治疗组质量浓度分别为50、100、200 μg/mL,每组4个重复,每个重复10枚胚胎。所有孔中加入新的胚胎培养液至2 mL,置于(28.5±1)℃中继续孵育,每隔12 h更换1次新鲜药液。待胚胎发育至48 hpf,于倒置显微镜下观测斑马鱼心率。
1.2.9.3 斑马鱼静脉窦-动脉球(SV-BA)间距的测量
参照李智平等[25]的方法并稍作修改,将不同处理组的斑马鱼置于玻片上,加入少量麻醉剂对斑马鱼进行麻醉,使之呈侧卧状态(两侧眼、体节重合,尾部与身体处于同一水平面),用倒置显微镜将斑马鱼的心脏部位进行拍照,通过 Image pro-plus 软件测定 SV-BA 之间的间距。同时计算斑马鱼心脏损伤修复率:心脏损伤修复率=(给药治疗组斑马鱼心脏SV-BA间距-特非那定组斑马鱼心脏SV-BA间距)/(正常对照组斑马鱼SV-BA间距-模型组斑马鱼SV-BA间距)×100%。
1.3 数据分析
SAS 9.2 统计软件ANOVA 模型进行单因素方差分析,用 Duncan’s 检验进行多重比较,统计结果用“平均值±标准差”来表示,测定重复次数n=3,P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 大孔吸附树脂静态吸附和解吸结果
2.1.1 上样液浓度的确定
上样液浓度对大孔吸附树脂Amberlite XAD-2吸附的影响见图1。如图1所示,上样液质量浓度在3.0~4.0 mg/mL之间时,大孔吸附树脂AmberliteXAD-2对发酵麦麸FOs的吸附率呈现增加趋势,当上样液质量浓度在4.0 mg/mL时,此时有最大吸附率67.69%,显著高于上样液质量浓度3、3.5 mg/mL(P<0.05);在上样液质量浓度未达到4.0 mg/mL时,大孔吸附树脂上有足够的空间来吸附溶液中的FOs,所以随着上样液浓度的增加有利于增大FOs与树脂的接触面积,对发酵麦麸FOs的吸附率也增加。大于4.0 mg/mL时,大孔吸附树脂Amberlite XAD-2对发酵麦麸FOs的吸附率呈下降趋势,但与4.0 mg/mL时的吸附率差异不显著(P>0.05),可能是上样液浓度过高,树脂的黏度会比较大,杂质也会增加,易堵塞树脂,使得大孔吸附树脂吸附不充分[26],造成吸附率下降,故最佳的发酵麦麸FOs上样液质量浓度为4 mg/mL。

注:不同小写字母表示差异显著(P<0.05),含有相同字母表示差异不显著(P>0.05),下同。图1 不同静态吸附与解吸条件对Amberlite XAD-2 大孔吸附树脂吸附与解吸的影响
2.1.2 上样液pH的确定
上样液pH对大孔吸附树脂Amberlite XAD-2吸附率的影响见图1。如图1所示,上样液pH为1~4时,大孔吸附树脂Amberlite XAD-2对发酵麦麸FOs的吸附率差异不显著(P>0.05),发酵麦麸FOs上样液pH为5时的吸附率为76.17%,低于pH为4时的87.93%,但差异不显著(P>0.05);继续增大pH,大孔吸附树脂Amberlite XAD-2对发酵麦麸FOs的吸附率呈下降趋势,显著低于pH为4的吸附率(P<0.05);在酸性环境下,发酵麦麸FOs有利于保持分子形式,易于吸附;pH过小或过大都会影响大孔吸附树脂的吸附,降低吸附率[27],因此最佳的发酵麦麸FOs上样液pH选择4。
2.1.3 解吸液浓度的确定
解吸液浓度对Amberlite XAD-2大孔吸附树脂解吸率的影响见图1。如图1所示,随着乙醇溶液浓度的增加,发酵麦麸FOs的解吸率呈现先增加后减少的趋势,乙醇溶液体积分数在50%时,解吸率最大,可达96.20%,与乙醇溶液体积分数为70%时差异不显著(P>0.05),但显著高于其他组(P<0.05)。这可能是由于乙醇浓度较低难以破坏FOs与树脂形成的氢键,而浓度过高则与FOs的作用力降低,浓度过大过小都不利于解吸[27],考虑到成本节约和减少浪费,所以选择50%乙醇作为最佳的解吸液浓度。
2.1.4 解吸液pH的确定
解吸液pH对Amberlite XAD-2大孔吸附树脂解吸率的影响见图1。如图1所示,解吸液pH对发酵麦麸FOs解吸率的影响差异不显著(P>0.05),解吸率均在96%以上。因此选择不调节解吸液的pH。
2.2 动态吸附与解吸
2.2.1 上样液体积的确定
上样液体积对大孔吸附树脂Amberlite XAD-2吸附率的影响见图2。如图2所示,大孔吸附树脂Amberlite XAD-2对发酵麦麸FOs的吸附率随上样液体积的升高而降低,上样液体积为40 mL时,吸附率可达83.76%,当发酵麦麸FOs上样液体积为50 mL时,大孔吸附树脂Amberlite XAD-2吸附率显著下降(P<0.05),吸附率为80%,继续增加发酵麦麸皮FOs上样液体积,大孔吸附树脂Amberlite XAD-2吸附率低于80%;上样液体积为40 mL时,发酵麦麸FOs与树脂接触比较充分,使得FOs吸附率较高,因此,选择最佳的发酵麦麸FOs上样液体积为40 mL。
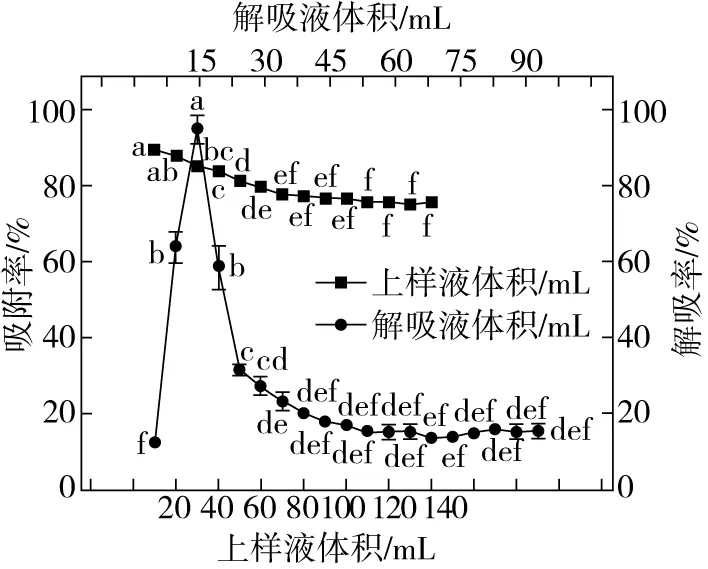
图2 动态吸附与解吸条件对Amberlite XAD-2 大孔吸附树脂吸附与解吸的影响
2.2.2 解吸液体积的确定
解吸液体积对Amberlite XAD-2大孔吸附树脂解吸率的影响见图2。如图2所示,解吸率随着解吸液体积的增加呈先增加后减少的趋势,解吸液体积在15 mL时解吸率最高,此时解吸率为94.80%,显著高于其他解吸液体积(P<0.05),因此,选择解吸液体积为15 mL。
2.3 FOS葡聚糖凝胶Sephadex LH-20分离纯化结果
2.3.1 洗脱剂的筛选
由图3可以看出,与蒸馏水洗脱相比,乙醇溶液洗脱出来的峰较多,即分离出来的组分较多;25%乙醇溶液在7-15管之间分离出两个峰,峰型具有更好的对称性和分离度,而其他两个乙醇溶液只分离

图3 洗脱剂洗脱曲线
出一个峰,分离效果不及25%乙醇溶液;所以,最终选择25%乙醇溶液作为洗脱剂。
2.3.2 上样液体积的确定
由图4可以看出,与其他三个上样液体积相比,0.125 mL上样量分离效果比较好,在7~15管之间分离出两个峰,分出的两个峰对称性和分离度较好;上样量过多,分离效果不好,所以,最终选择0.125 mL作为上样量。
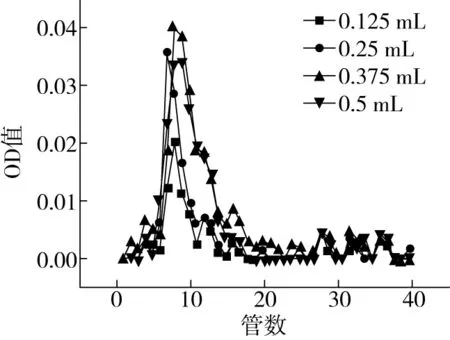
图4 上样液FOs体积的洗脱曲线
2.3.3 洗脱流速的确定
由图5可以看出,0.4、0.5、0.6 mL/min因流速太快,分离出来的组分较少,分离效果不好,峰形不太对称。在流速为0.3 mL/min分出的组分较多,且峰型的对称性好一些,分离效果比较好,因此,洗脱流速选择0.3 mL/min进行洗脱。
实验结果表明,Sephadex LH-20 葡聚糖凝胶纯化的最佳条件为:洗脱剂25%乙醇,上样量1.25 mL,洗脱流速 0.3 mL/min,在此条件下,分离出来的效果最好,分离出的组分最多,纯化后发酵麦麸 FOs含量由(1 107.796±52.18) nmol/g提高到(2 217.38±25.36) nmol/g,提高了2倍,纯化效果较佳。
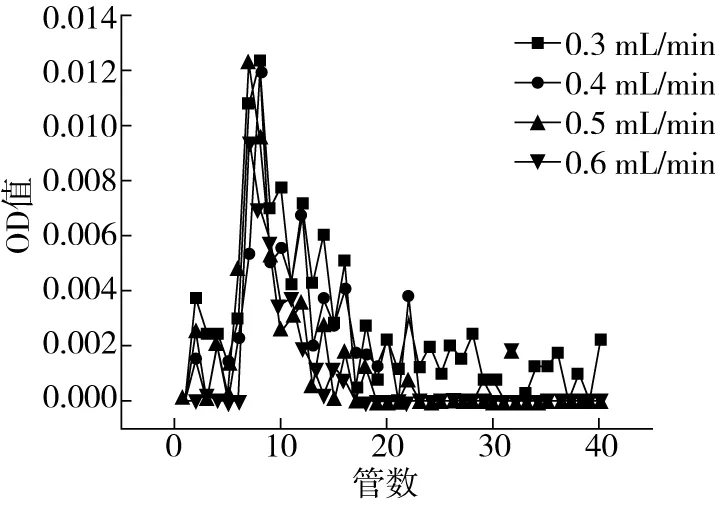
图5 洗脱流速的洗脱曲线
2.4 发酵麦麸FOs的紫外吸收光谱图
由图6可以看出,发酵麦麸FOs的紫外光谱在286 nm和325 nm处具有吸收峰,表明发酵麦麸FOs中有阿魏酸的存在[19]。
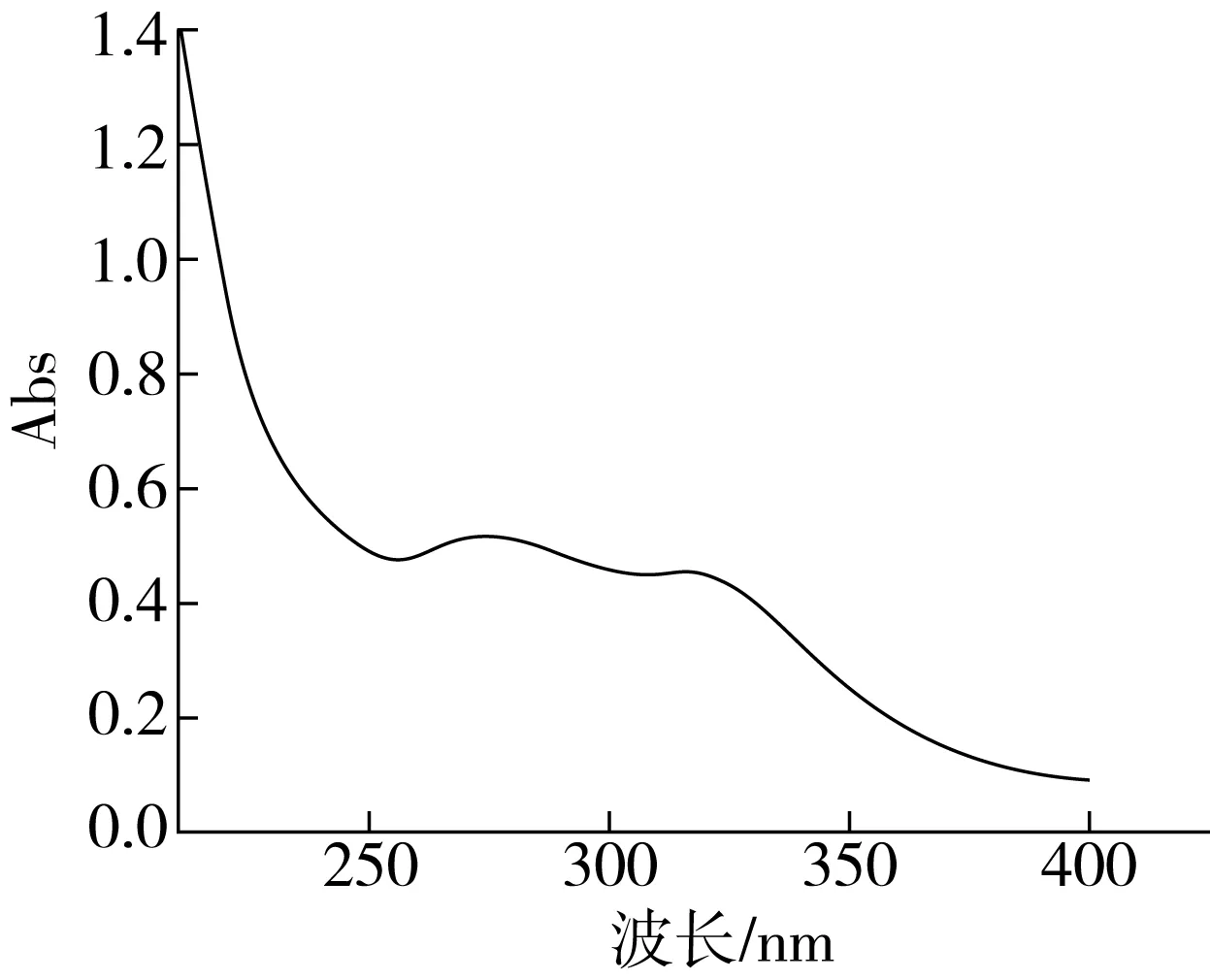
图6 发酵麦麸FOs紫外吸收光谱图
2.5 发酵麦麸FOs对斑马鱼心脏保护作用的影响
静脉窦是血液进入心室的部位,动脉球是血液流出心房的部位。SV-BA间距反映斑马鱼心脏的形态和功能[25],心率是体现心脏功能的重要指标之一。如图7和图8结果显示,特非那定诱导后斑马鱼出现了明显的心脏损伤,主要表现为心包水肿、血流速度减慢、心率不齐等症状。如图8所示,与正常对照

注:A:正常对照组;B:特非那定组;C:50 μg/mL发酵麦麸FOs;D:100 μg/mL发酵麦麸FOs;E:200 μg/mL发酵麦麸FOs图7 发酵麦麸FOs对特非那定诱导的 斑马鱼心脏心脏损伤的影响
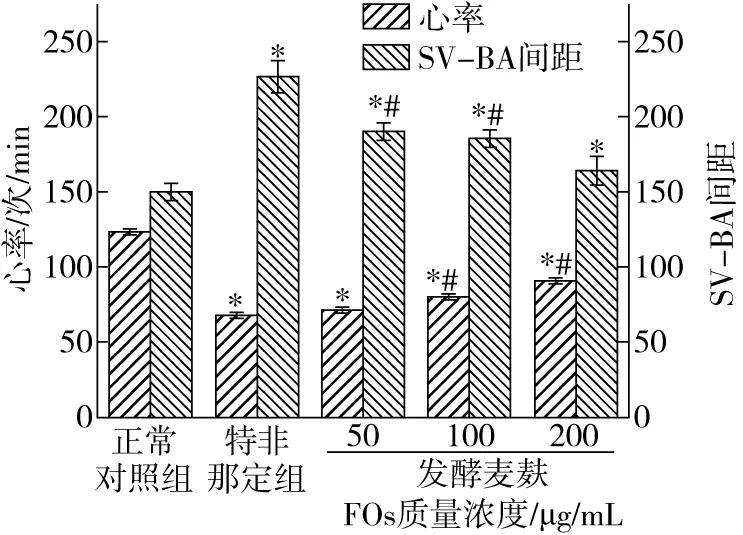
注:与正常对照组比较,*P<0.05;与特非那定组比较,#P<0.05。图8 分离纯化后发酵麦麸FOs对特非那定诱导的斑马鱼心率 和心脏SV-BA间距的影响
组相比,特非那定组斑马鱼心率显著降低(P<0.05),心脏SV-BA间距显著增大(P<0.05),表明特非那定诱导造成了斑马鱼心脏损伤;与特非那定组相比,100、200 μg/mL 分离纯化后发酵麦麸FOs组斑马鱼心率显著高于特非那定组(P<0.05),浓度为50 μg/mL时心率比特非那定组有所上升,但差异不显著(P>0.05);与特非那定组相比,添加50、100、200 μg/mL分离纯化后发酵麦麸FOs组的斑马鱼心脏SV-BA间距显著缩小(P<0.05),且在质量浓度为200 μg/mL时分离纯化后发酵麦麸FOs心脏保护作用最好,斑马鱼的心脏损伤修复率可达82.19%,与正常对照组差异不显著(P>0.05),表明经分离纯化后发酵麦麸FOs对特非那定诱导的斑马鱼心脏损伤起到缓解的作用,具有一定的心脏功能损伤保护作用。
3 结论
大孔吸附树脂被广泛应用于植物活性物质的分离纯化,本实验采用Amberlite XAD-2大孔吸附树脂纯化发酵麦麸FOs,考察各因素对吸附率与解吸率的影响,获得最佳工艺条件为上样液质量浓度4.0mg /mL,上样液pH 4.0,上样液体积40 mL,最佳的解吸条件为:乙醇体积分数50%、洗脱体积15 mL,在此条件下发酵麦麸FOs吸附率可达83.76%、解吸率可达94.80%。利用Sephadex LH-20 葡聚糖凝胶再进一步纯化发酵麦麸FOs的最佳条件为洗脱剂25%乙醇,上样量1.25 mL,洗脱流速 0.3 mL/min,在此条件下,分离出的组分最多,紫外光谱分析表明纯化发酵麦麸FOs中有阿魏酸的存在,发酵麦麸 FOs含量由(1 107.796±52.18) nmol/g提高到(2 217.38±25.36)nmol/g,提高了2倍,纯化效果较佳。添加50、100、200 μg/mL 分离纯化后发酵麦麸FOs对特非那定诱导的斑马鱼心脏损伤情况均不同程度地改善,其卵黄囊下淤血减轻、血流速度恢复正常、心脏SV-BA间距显著缩短和心率显著升高。该纯化工艺操作简单、纯化效果好,纯化后发酵麦麸FOs具有较强的心脏保护作用。
