SRT联合拉帕替尼治疗HER2阳性乳腺癌脑转移疗效及预后分析
2021-12-20罗波张曲郑红梅梁新军周小妹吴新红
罗波 张曲 郑红梅 梁新军 周小妹 吴新红
HER2阳性转移性乳腺癌患者具有较高的脑转移发生率,在其病程中约30%~50%的HER2阳性患者会出现脑转移[1]。放射治疗是脑转移发生后的主要治疗手段,其中立体定向放射治疗(SRT)技术目前是脑转移局部治疗的主要技术。有研究显示SRT能够获得和全脑放疗相当的效果,但是SRT联合小分子酪氨酸激酶抑制剂,是否能进一步提高疗效尚未见报道,本研究通过回顾性分析HER2阳性乳腺癌脑转移患者接受SRT放疗的临床资料,探讨SRT联合拉帕替尼治疗HER2阳性乳腺癌脑转移的疗效及预后,以助于此类患者选择治疗策略。
1 资料与方法
1.1 一般资料
回顾性分析湖北省肿瘤医院2015年1月—2018年12月期间91例HER2阳性乳腺癌脑转移患者接受拉帕替尼靶向治疗的同时接受全脑放疗或SRT的情况,乳腺癌诊断时的中位年龄是48岁,年龄范围28~67岁,平均年龄47±11岁。根据患者脑部病灶的放疗方式,将患者分为全脑放疗组和SRT组。预后评分采用GPA评分[2]。患者符合下列标准:均有乳腺浸润性导管癌的病理诊断,术后均接受了辅助化疗或放疗,并且接受抗HER2辅助治疗后出现颅内转移并经MRI证实,颅脑转移灶不超过5个,皆为可测量病灶(至少1个病灶的直径≥1.0 cm);激素受体状态和HER2状态明确,均为HER2过表达;诊断后均行脑部转移灶放射治疗。ER、PR及HER2阳性的诊断标准参考《乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)》和《乳腺癌HER2检测指南(2014版)》。如果ER或PR免疫组化染色显示≥1%的细胞核是阳性的,则肿瘤的ER或PR被认为是阳性。如果荧光原位杂交显示HER2基因扩增或免疫组化染色显示标本评分3+(>10%的浸润癌细胞呈现强而完整的细胞膜染色)则认为HER2阳性。
1.2 脑转移的治疗
放射治疗:面罩固定,仰卧位,CT模拟定位增强扫描,扫描层厚3 mm。范围从颅顶至颅底线以下5 cm。将定位CT图像传送至TPS系统,后勾画GTV;SRT治疗时GTV外放3 mm为PTV。SRT的剂量分割:处方剂量30~35 Gy,分次量为6~7 Gy,5次/周。每次放疗前行图像引导矫正摆位误差。将脑干、眼球等危及器官剂量控制在安全范围内(脑干、脊髓、眼球结构剂量限值分别小于30、30、20 Gy)。接受全脑放疗的患者全脑放疗的剂量:全脑放疗30 Gy,肿瘤灶推量至55~60 Gy,放疗后1月及3月复查MR,然后每2个月随访一次。近期疗效按实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)1.1[11-12]评价,颅内局部控制时间自颅脑放疗起计算,生存期自确诊脑转移起计算。放疗采用6MV高能X线,加速器采用VARIAN直线加速器。药物治疗:采用卡培他滨2000 mg/m2/d,d1~d14,每三周一次,拉帕替尼1 250 mg/d,每天一次。放疗期间同步使用2周期,后维持治疗至疾病进展或无法耐受。
1.3 随访
采用电话或门诊随访,随访截止时间2019年10月。总生存期定义为脑部病灶治疗开始日期至死亡日期或随访终止之间的时间;颅内受照射病灶无进展生存期定义为脑部病灶治疗开始日期至患者出现脑部病灶治疗后进展的时间;颅内无转移生存期定义为治疗开始日期至患者出现颅内新发病灶的时间。至患者死亡或随访结束,中位随访时间28个月(2~36个月)。
1.4 统计学分析
使用SPSS 23.0行统计学分析,采用χ2检验和Fisher精确检验比较组间分类变量。通过Kaplan-Meier法计算生存时间、生存率和局部控制率。Log-rank检验比较不同组患者的生存曲线差异。使用单因素和多因素Cox回归模型分析影响HER2阳性乳腺癌脑转移患者生存的独立预后因素,P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者临床特点比较
SRT组和全脑放疗组之间年龄、诊断时的TNM分期、脑部转移灶的数目、GPA评分、颅外是否转移、受体状态、患者治疗时的KPS和TNM分期无统计学差异(P>0.05)(表1)。
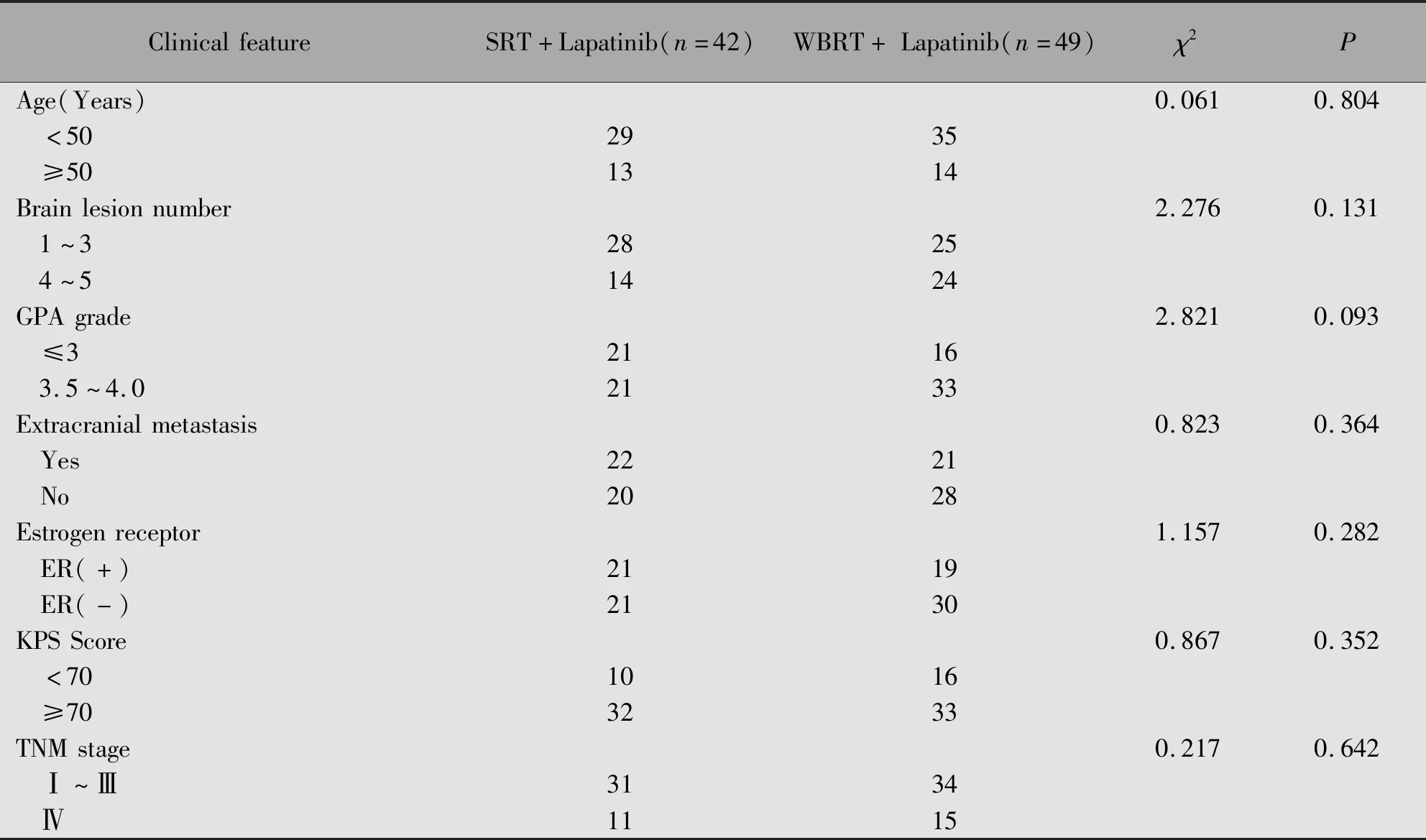
表1 HER2阳性乳腺癌脑转移患者的临床资料Table 1 Characteristics of patients with HER2-positive breast cancer brain metastasis
2.2 两组患者受照射肿瘤病灶无进展生存率的比较
SRT组与全脑放疗组客观缓解率比较有统计学差异(χ2=4.070,P<0.05)(表2)。SRT组和全脑组12个月受照射肿瘤病灶无进展生存率分别为95.20%及83.10%,相比较SRT组优于全脑放疗组(χ2=10.851,P=0.001)(图1)。
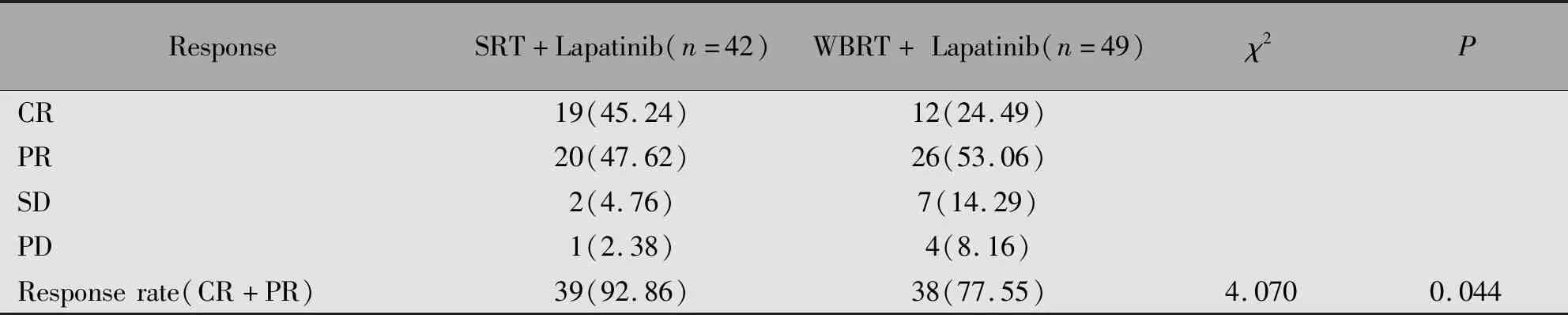
表2 SRT组和全脑放疗组客观缓解率的比较[n(%)]Table 2 Comparison of sbjective response rates between the SRT group and whole brain radiotherapy group[n(%)]
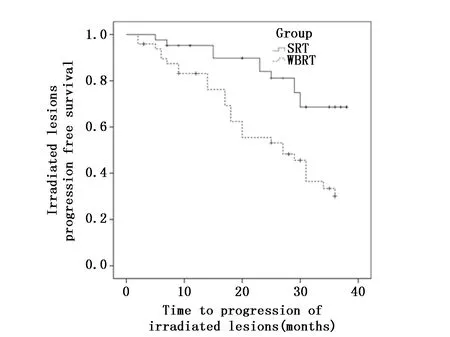
图1 SRT组和全脑放疗组受照射脑部病灶无进展生存率的比较Figure 1 Comparison of irradiated lesions progress free survival between the SRT group and whole brain radiotherapy group
2.3 两组患者治疗后无颅内转移生存率的差异
所有患者12个月无颅内转移生存率为73.73%,SRT组无颅内转移生存率为71.32%,全脑组无颅内转移生存率为79.57%,两组无统计学差异(χ2=3.056,P=0.081)(图2)。
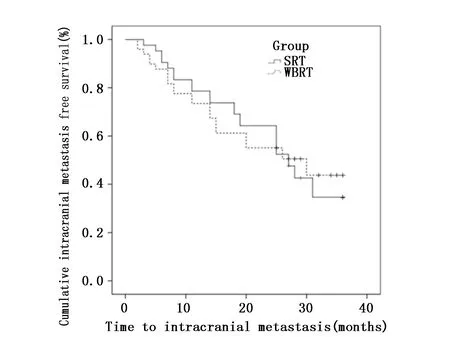
图2 SRT组和全脑放疗组无新发颅内转移生存率的比较Figure 2 Comparison of intracranial metastases free survival between the SRT group and whole brain radiotherapy group
2.4 两组患者治疗后生存率的比较
接受拉帕替尼联合放疗所有患者的1年生存率76.90%,2年生存率为58.20%,中位总生存期为28.00个月(95%CI:24.23~31.75个月),SRT组和全脑放疗组1、2年生存率分别为85.70%、66.70%和69.40%、55.10%,两组中位总生存期分别为31.00个月(95%CI:26.78~35.21)和25.00个月(95%CI:19.57~30.43), 存在统计学差异(χ2=10.039,P=0.002)(图 3)。
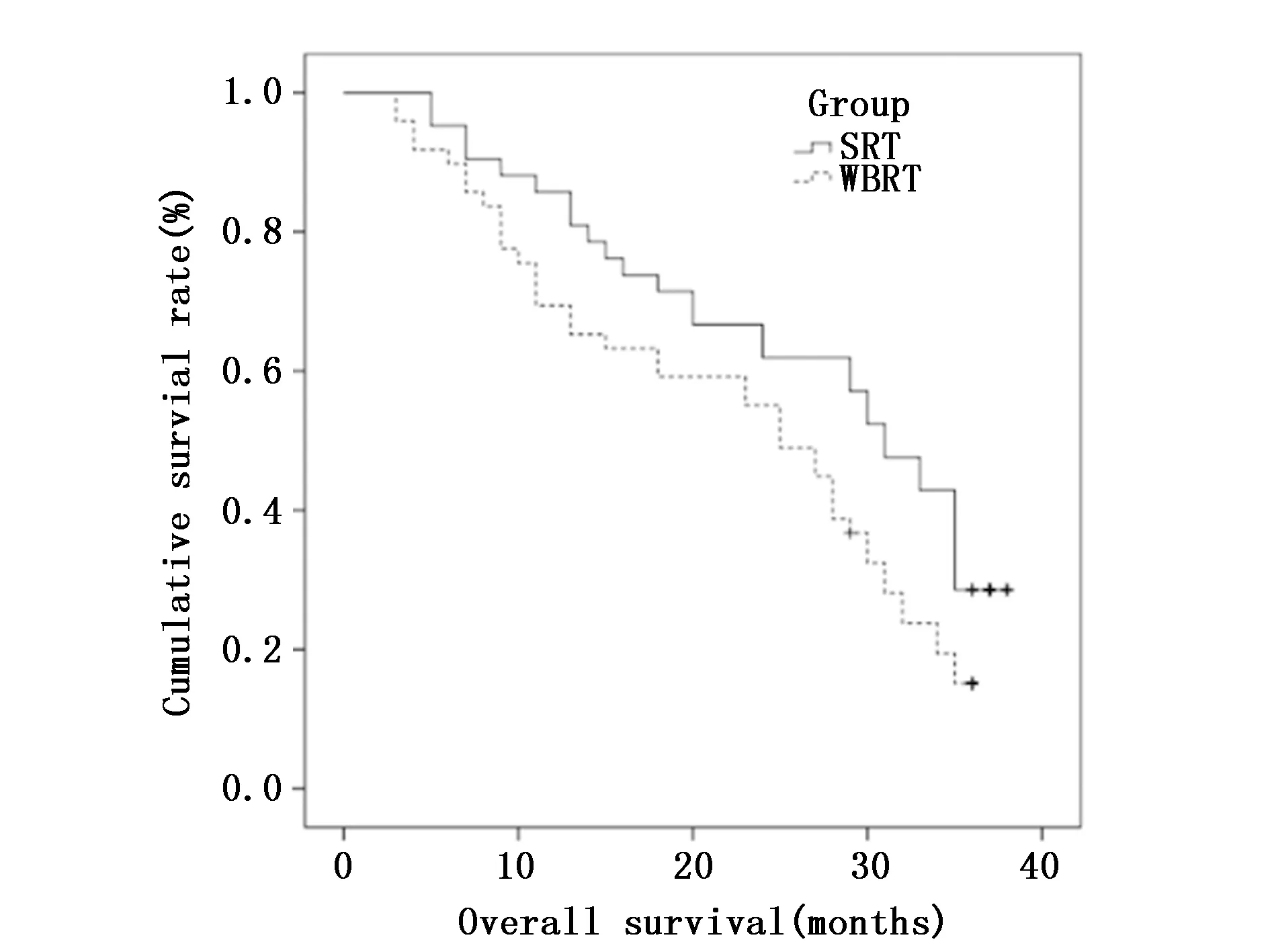
图3 SRT组和全脑放疗组生存曲线的比较Figure 3 Comparison of survival curves between the SRT group and whole brain radiotherapy group
2.5 HER2阳性乳腺癌脑转移预后影响因素分析
单因素分析显示脑转移瘤个数、颅外是否存在转移、KPS评分和GPA分级与生存预后相关(P<0.05)(表3)。多因素Cox回归分析结果表明其中的颅外是否存在转移、颅内病灶个数、放疗方式是脑转移瘤放疗后总生存的独立预后因素(P<0.05)(表4)。
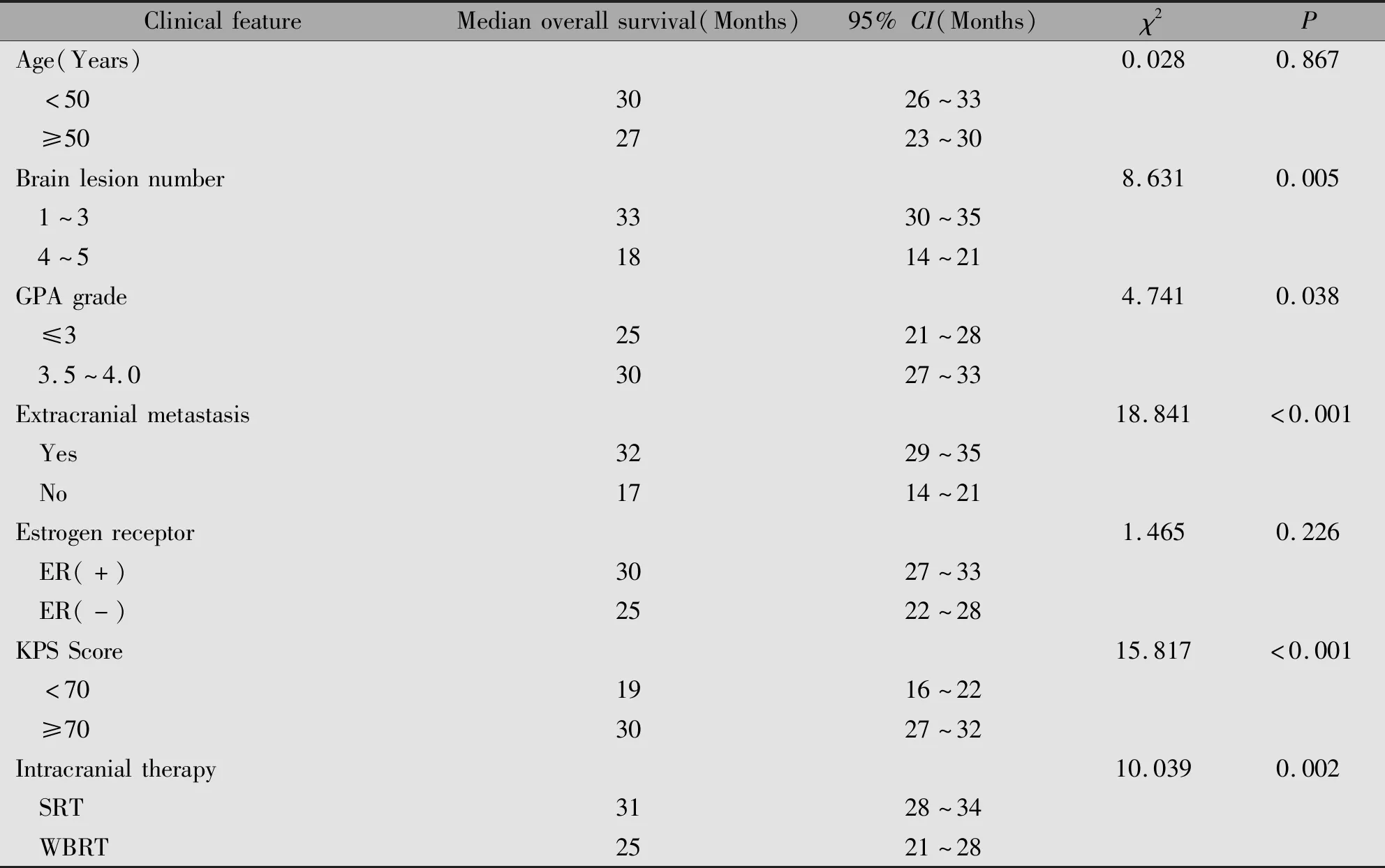
表3 脑转移患者总生存期影响因素的单因素分析Table 3 Univariate analysis of factors affecting the overall survival of patients with breast cancer brain metastasis
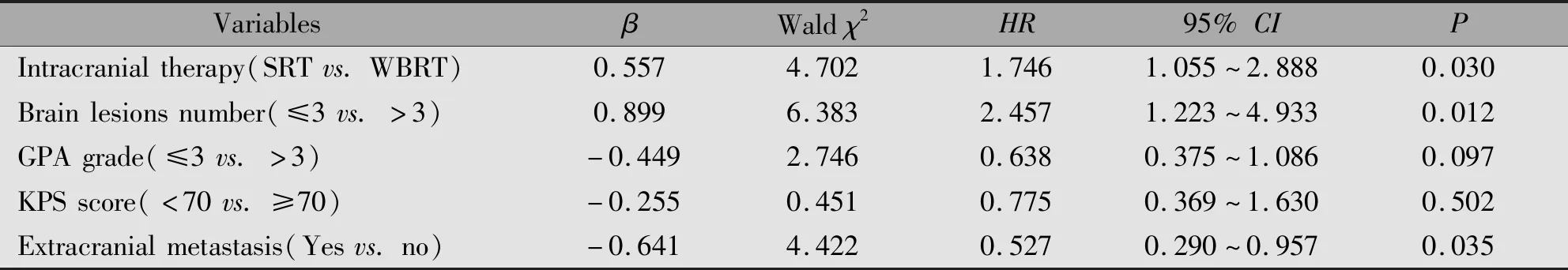
表4 脑转移患者总生存期影响因素的多因素分析Table 4 Multivariate analysis for patients with breast cancer brain metastasis
3 讨论
HER2阳性转移性乳腺癌出现脑转移的几率较其他分子亚型更高,有研究报道可达50%[1]。研究显示SRT能够控制脑部转移病灶的同时避免全脑放疗的神经毒性[3],而小分子抗HER2药物拉帕替尼治疗HER2阳性乳腺癌脑转移也能够获得一定疗效并改善脑转移患者的预后[4]。本研究试图探讨SRT联合拉帕替尼治疗HER2阳性乳腺癌脑转移的疗效,并与全脑放疗的疗效做对比。
本研究中,在同时应用拉帕替尼治疗的情况下,SRT组患者客观缓解率较全脑放疗组患者高(92.86%vs.77.55%)。说明即使在同时应用抗HER2治疗的情况下,SRT能显示出相比全脑放疗更优的局部客观缓解率。而在脑部病灶的局控方面,得到了类似的结果,SRT组失败率较低且存在统计学差异。
脑转移的部分患者在原病灶范围得到控制的同时,原病灶范围以外脑组织会出现新病灶而产生颅内转移[5]。在本研究中,所有患者接受脑部放疗并同时靶向治疗后12个月颅内转移的发生率接近1/4,与以往研究相比,本研究中颅内转移发生率较低[6],但需要进一步验证。本研究也显示SRT治疗的患者颅内转移几率并不高于全脑放疗。可能是因为本研究通过拉帕替尼的药物治疗降低SRT颅内转移发生率[5-7]。这显示即便在同时进行抗HER2治疗的条件下,SRT和全脑放疗相比,颅内转移也可得到同等的控制,但是需要进一步临床研究来验证。
生存分析显示两组中位生存期分别为31个月和25个月,1年及2年生存率SRT组较全脑放疗组更优。提示靶向治疗的同时两种不同的放疗方式相比较,SRT组体现出生存上的优势。由于以往的研究显示全脑放疗晚期的中枢神经毒性发生率较高[8],相比较之下采用SRT有可能获得更优的生存而避免相应的中枢神经毒性。
已有文献报道HER2阳性乳腺癌脑转移患者的生存受到多种因素的影响,其相关的预后因素主要包括GPA评分、颅外转移灶和受体状态等[9-10]。本研究中初步的单因素分析显示脑转移瘤主要预后相关因素可能为脑转移瘤个数、 颅外是否存在转移灶、KPS评分和GPA分级、放疗方式。其中脑转移瘤个数,颅外是否存在转移灶在多数研究中也被认为是影响脑转移患者生存的主要预后因素,而GPA分级是目前最常用的脑转移预后指标,但有其局限性。有研究者在其基础上也衍生出其他预后指标,正在进行临床验证。在前述研究结果中,不同的放疗方式患者近期疗效和生存有显著差别,SRT组有着明显的优势。进一步的多因素分析也验证了除了颅外是否存在转移和颅内病灶个数外,放疗方式也是脑转移瘤放疗疗效的独立预后因素,相对于全脑组,SRT组明显降低死亡风险。
综上所述,在本研究中SRT联合拉帕替尼与全脑放疗联合拉帕替尼相比,在局部控制率、脑内转移率以及生存上,前者优于后者。分析显示颅内病灶个数,颅外是否存在转移,放疗方式是HER2阳性乳腺癌脑转移瘤放疗疗效的独立预后因素。
