circRNA MYO1C对肺癌细胞自噬和肿瘤干细胞分化的影响
2021-12-20罗雯贾莉张佳文王冬杰孔英君
罗雯 贾莉 张佳文 王冬杰 孔英君
调查统计显示,2018年全球新发肺癌患者和死于肺癌的患者分别为2 093 876和1 761 007例,占所有恶性肿瘤的11.6%和18.4%,肺癌的发病率和死亡率均排在第一[1]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占所有肺癌的80%,临床上约65%的患者在确诊时已处于中晚期,NSCLC的5年生存率小于15%,但是关于NSCLC发生和发展的机制仍不清楚[2]。最新研究显示自噬和肿瘤干细胞(Cancer stem cells,CSCs)分化在肿瘤进展中起着重要调控作用,NSCLC细胞的自噬和CSCs会导致疾病进展和化疗敏感性降低[3-4],关于肿瘤细胞自噬和CSCs的机制是现阶段的研究热点。
环状RNA(circRNA)是一种新型的非编码RNA,由不带有5′端帽和3′聚腺苷酸尾的外显子mRNA或长非编码RNA反向剪接形成的[5]。circRNA可以使微小RNA(microRNA,miRNA)海绵化失活,从而在转录后水平上调控基因表达参与NSCLC的进展[6]。有研究显示,circABCB10在NSCLC细胞系中的表达增加,下调circABCB10可促进miR-1252表达并抑制FOXR2水平,从而抑制NSCLC细胞增殖和迁移[7]。还有研究表明,hsa_circ_0020123在NSCLC中表达上调,且被认为与NSCLC患者淋巴结转移、TNM分期及预后不良密切相关,hsa_circ_0020123可通过靶向结合miR-144上调ZEB1和EZH2,进而促进癌细胞生长和转移[8]。本研究通过基因测序选定hsa_circ_0041198,由于hsa_circ_0041198是由MYO1C基因的部分外显子环化而来,所以又称为circRNA MYO1C。本研究通过细胞实验分析circRNA MYO1C对NSCLC自噬、CSCs和迁移的影响。希望通过本研究为提高NSCLC化疗敏感性提供新的作用靶点,进而能让目前困扰临床的化疗耐药问题能有所突破。
1 材料与方法
1.1 主要实验材料
人肺上皮细胞BEAS-2B购自ATCC公司和肺癌细胞A549购自ATCC公司;96孔、24孔组织培养板购自康宁公司;DMEM培养基购自Gibco公司;Lipofectamine®2000(Invitrogen公司);TRIzol试剂购自Aidlab公司;实时荧光定量PCR仪;分光光度计;一抗anti-OCT4,anti-SOX2,anti-NANOG,anti-LC3,anti-P62,anti-GAPDH购自SANTA CRUZ公司;HRP标记羊抗兔二抗(武汉博士德生物工程有限公司,中国);PVDF膜。
1.2 细胞培养、分组和转染
BEAS-2B和A549细胞均培养在DMEM完全培养基中,培养基含有10%的胎牛血清、0.1 mg/mL的链霉素和100 U/mL的青霉素。将细胞在5%CO2培养箱中于37°C和95%湿度下培养。
将A549细胞分为对照组、NC组和siMYO1C组,NC组和si-MYO1C组细胞分别转染NC质粒和si-circRNA MYO1C质粒,根据试剂盒说明书利用LipofectamineTM 2000进行转染,转染条件为7℃和5%CO2,48 h后收集细胞进行后续研究。
1.3 检测方法
1.3.1 RT-qPCR实验 RNA提取和逆转录,实时定量PCR:使用TRIzol从细胞中提取总RNA。RNA浓度和纯度使用分光光度计进行测量。将RNA逆转录合成cDNA,cDNA为模板,荧光定量PCR仪扩增。通过比较循环阈值并以GAPDH作为内参,最终数据以2-△△CT法计算mRNA相对表达水平,实验重复3次。
1.3.2 CCK-8实验 将1×105个处理后细胞(150 μL)在96孔板中接种,分别在培养第24 h、48 h和72 h加入10 μL CCK-8试剂并在37℃下孵育显色,利用酶标仪检测在450nm下每孔吸光度(OD)值。
1.3.3 Transwell实验 在37℃下将细胞培养在无血清DMEM中,将细胞进行血清饥饿处理24 h。然后将细胞接种到24孔Transwell装置的上部腔室中,将含有10%胎牛血清的DMEM充满下部腔室。24 h后,清洗掉未侵入的细胞,并将渗透到下腔室中的细胞用4%多聚甲醛固定30 min,并在室温下用0.1%结晶紫染色5 min,光镜下观察并统计细胞数量。
1.3.4 Western blot实验 将细胞在放射免疫沉淀测定裂解缓冲液中在冰上裂解并收集总蛋白。通过SDS-PAGE分离每个样品中等量的蛋白质,并将其转移到PVDF膜上。通过在室温下将膜浸入5%脱脂牛奶中2 h来封闭非特异性抗原。随后,将膜与分别用封闭液稀释的一抗(1∶200)在4℃下孵育过夜,然后将膜与山羊抗免IgG二抗(1∶1000)在室温下孵育1 h。使用化学发光试剂显示,使用BandScan分析胶片灰度值计算蛋白相对于GAPDH的表达量。
1.4 统计学处理
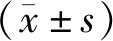
2 结果
2.1 circRNA MYO1C在肺癌中的表达特点
相对正常肺上皮细胞,circRNA MYO1C在A549细胞中表达明显上调(0.99±0.06vs.4.87±0.88,t=7.597,P=0.002)(图1)。
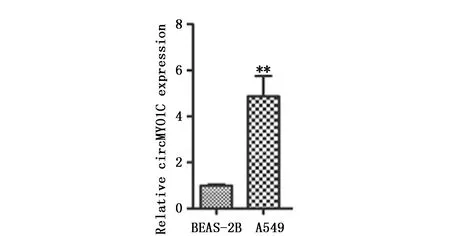
图1 RT-qPCR检测人肺上皮细胞BEAS-2B和肺癌细胞A549中circRNA MYO1C的表达水平Figure 1 The levels of circRNA MYO1C in BEAS-2B and lung cancer A549 cells were detected by RT-qPCRNote:**P<0.01,when compared with BEAS-2B cells.
2.2 各组细胞中circRNA MYO1C的水平
通过检测对照组、NC组和siMYO1C组中circRNA MYO1C水平验证转染效果,结果显示干扰circRNA MYO1C后,与对照组及NC组比较,circRNA MYO1C在A549中表达显著降低(1.07±0.12,1.05±0.25vs.0.22±0.04,F=27.238,P<0.001)(图2)。选取NC组和siMYO1C组进行后续实验。
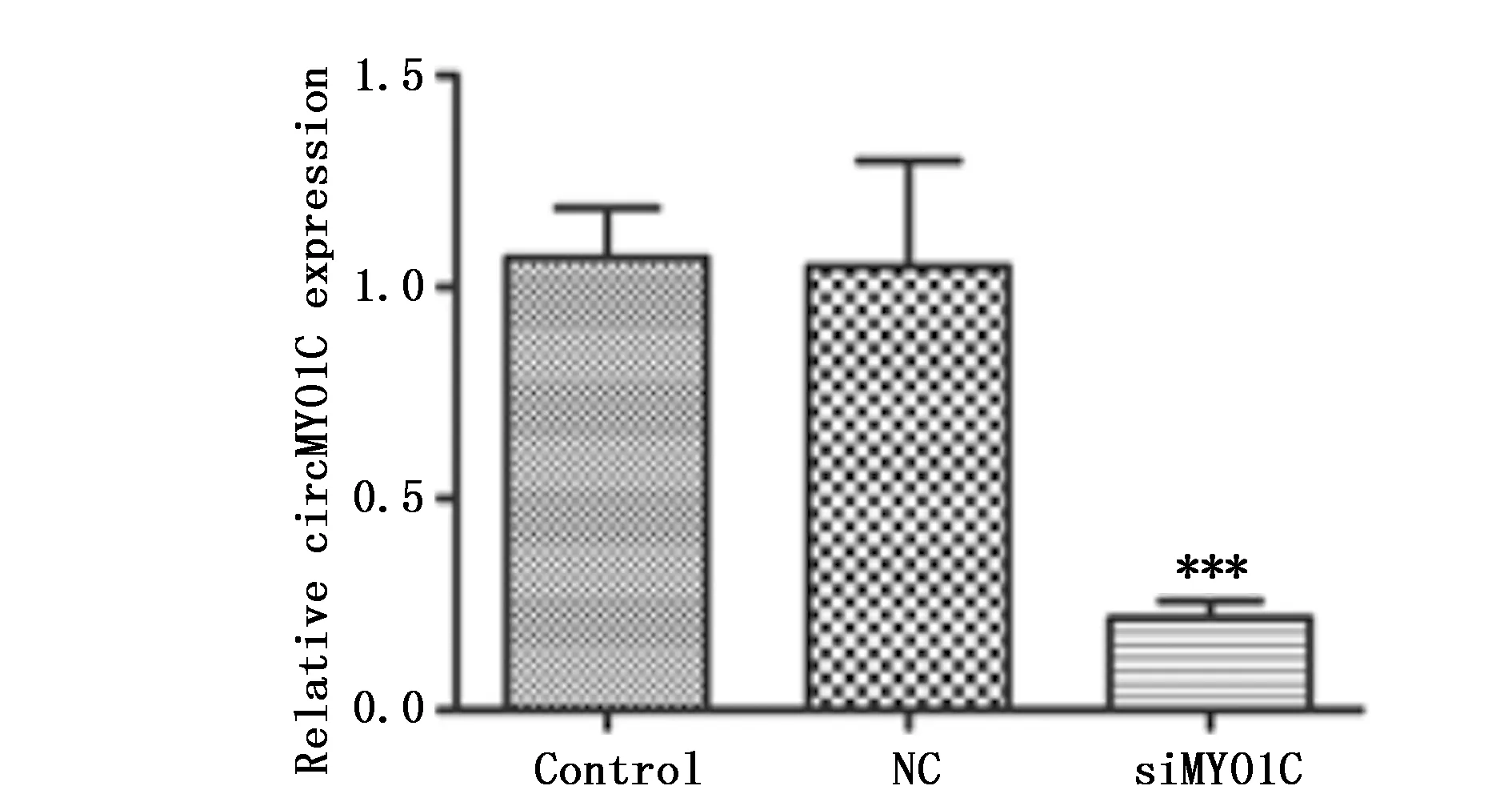
图2 RT-qPCR检测各组细胞中circRNA MYO1C的表达水平Figure 2 The levels of circRNA MYO1C in the control,NC and siMYO1C groups were detected by RT-qPCRNote:***P<0.001,when compared with the control and NC groups.
2.3 干扰circRNA MYO1C对肺癌细胞生长的影响
结果显示与NC组比较,siMYO1C组细胞培养第3天的OD值显著低于对照组(P<0.001)(图3)。
图3 CCK-8法检测干扰circRNA MYO1C对肺癌细胞生长的影响Figure 3 The effect of interfering circRNA MYO1C on lung cancer cell proliferationNote:***P<0.001,when compared with NC group.
2.4 干扰circRNA MYO1C对肺癌细胞迁移能力的影响
相对NC组,干扰circRNA MYO1C后显著抑制了A549细胞的迁移(t=-34.154,P<0.001)(图4)。

图4 Transwell检测干扰circRNA MYO1C对肺癌细胞迁移能力的影响(200×)Figure 4 The effect of interfering circRNA MYO1C on the migration ability of lung cancer cells(200×)Note:***P<0.001,when compared with the NC group.
2.5 干扰circRNA MYO1C对肺癌细胞CSC的影响
通过检测CSCs标志蛋白分析circRNA MYO1C对肺癌细胞CSCs的影响。相对NC组,干扰circRNA MYO1C后细胞中OCT4、SOX2和NANOG蛋白水平显著降低,siMYO1C组的CSCs显著低于NC组(t=-48.143,P<0.001;t=-31.846,P<0.001;t=-29.721,P<0.001)(图5)。
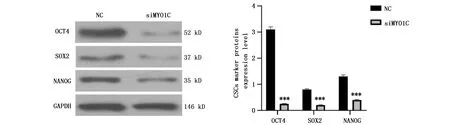
图5 Western blot检测干扰circRNA MYO1C对肺癌细胞CSC的影响Figure 5 The effect of interfering circRNA MYO1C on CSC in lung cancer cellsNote:***P<0.001,when compared with NC group.
2.6 干扰circRNA MYO1C对肺癌细胞自噬水平的影响
通过检测自噬底物标志蛋白P62和自噬小体形成标志蛋白IC3II/LC3I来评估细胞自噬水平。
结果显示与NC组比较,siMYO1C组的IC3II/LC3I水平明显降低,而P62水平升高(t=-39.240,P<0.001;t=51.385,P<0.001)(图6)。
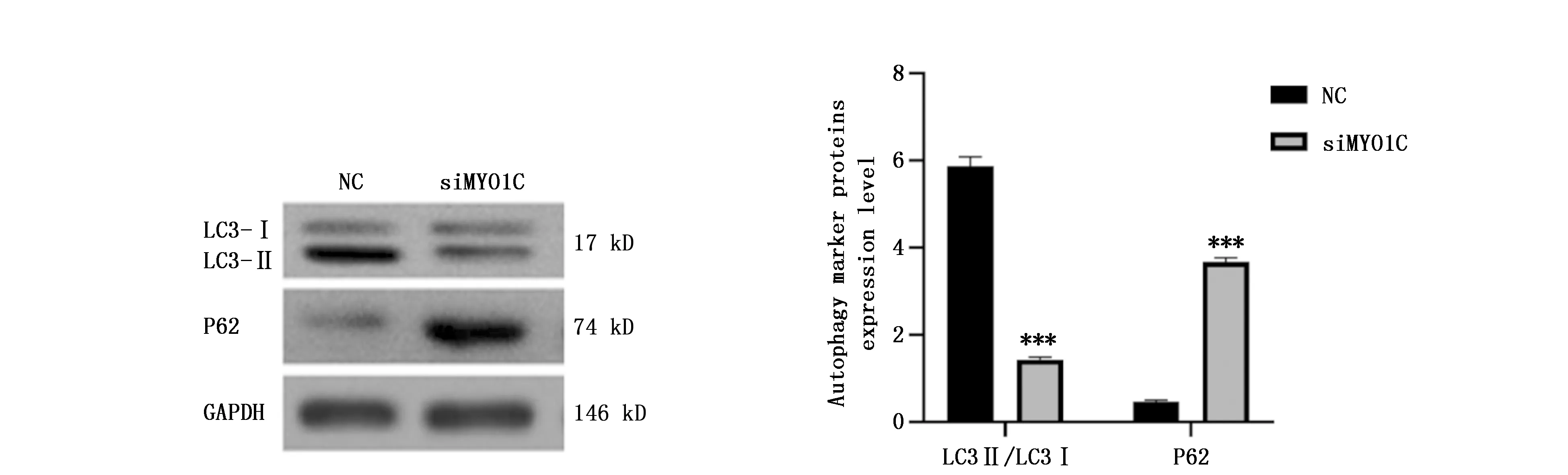
图6 Western blot检测干扰circRNA MYO1C对肺癌细胞自噬水平的影响Figure 6 The effect of interfering circRNA MYO1C on protein expression related to autophagy in lung cancer cellsNote:***P<0.001,when compared with NC group.
3 讨论
CSCs作为肿瘤细胞群体中一种异质性的细胞对肿瘤的生长和维持具有重要意义。CSCs除了具有和肿瘤细胞相似的特征,如细胞迁移、抗凋亡、放化疗抵抗外,CSCs还展现了和干细胞相似的自我更新和多向分化潜能,同时CSCs可表达特异性标记蛋白OCT3/4、Nestin、NANOG、CD44、CD24、CD133等[9]。其中作为转录因子的OCT4赋予了CSCs多向分化和自我更新的潜能[10];而CD44和CD133表达可增加肿瘤化疗耐药[11]。关于CSCs起源目前公认的有三种:CSCs起源于干细胞,CSCs起源于祖细胞,CSCs起源于细胞去分化。去分化理论认为原癌基因突变导致了细胞去分化,即在肿瘤组织中,肿瘤细胞去分化成CSCs,这一过程牵涉到对上皮间质转化(EMT)的诱导,导致干细胞样表型的获得和CSCs的形成。TGF-β、Wnt、Hedgehog(Hh)、β-catenin、Notch、NFκB和STAT3等信号通路参与到了对CSCs分化的调控[12]。除此之外,自噬对CSCs分化也起到了重要调控作用,但具体机制尚不清楚[13]。
自噬是一个高度保守的自我降解过程,在细胞应激反应和生存中起着关键作用。最近的研究已经开始探索自噬在癌症转移中的作用,鉴于目前缺乏有效的治疗方法来治疗转移性疾病,这一点尤其值得关注。已有研究证实自噬参与了肿瘤的侵袭和化疗耐药过程[14]。自噬作为维持正常组织干细胞和CSCs干性的必要条件,在过去几年中被广泛研究。自噬促进干细胞形成的机制以及为什么干细胞比非干细胞更依赖自噬是许多实验室正在研究的热点。在正常的组织干细胞中,自噬可通过控制氧化应激反应来向神经干细胞提供代谢物,进而促进神经发生[15];对于肿瘤,自噬随着肿瘤恶性程度增加而上调,抑制自噬激活在很大程度上可增加肿瘤化疗敏感性[16];抑制CSCs分化也同样可增加肿瘤化疗敏感性,提示自噬可通过CSCs来影响肿瘤患者预后。且很多文献也已经证实自噬对CSCs分化具有促进作用[17]。
除了自噬,越来越多的研究还发现非编码RNA对肿瘤化疗耐药起重要调控作用,circRNA是一种非编码RNA,在真核生物中的前体mRNA反向剪接过程中,通过3′和5′末端共价连接形成一个闭合的连续环[18]。circRNA上有miRNA结合位点,可通过吸附miRNA来调控mRNA表达并影响生物学功能,因此circRNA也被称为“miRNA分子海绵”[19]。相关研究显示,circABCB10在NSCLC细胞系中的表达增加,下调circABCB10可促进miR-1252表达并抑制FOXR2水平,从而抑制NSCLC细胞增殖和迁移[20]。最近一项研究表明,hsa_circ_0020123在NSCLC中表达上调,且被认为与NSCLC患者淋巴结转移、TNM分期及预后不良密切相关,hsa_circ_0020123可通过靶向结合miR-144上调ZEB1和EZH2,进而促进癌细胞生长和转移[21]。虽然circRNA在细胞增殖、凋亡、侵袭等恶性表型的多个方面发挥着重要作用,但是其在肿瘤耐药性调节方面的机制研究还不深入。本研究通过基因测序选定的hsa_circ_0041198,是由MYO1C基因的部分外显子环化而来,所以称为circRNA MYO1C。本次研究首先发现了circRNA MYO1C在NSCLC细胞系A549细胞中比正常肺上皮细胞明显升高。并且进一步的研究结果显示降低circRNA MYO1C的水平后,A549细胞的增殖和迁移的水平也显著降低。
miRNA是真核细胞中一类非编码的小RNA,在进化上具有保守性,通过结合靶mRNA的3′-UTR参与转录后负调控[22],在肿瘤生物学中扮演着重要的作用。研究显示在动脉粥样硬化中,miR-129-5p抑制上皮细胞自噬[23],同时,其他报道也显示miR-129-5p介导自噬[24]。另有研究显示,miR-30a可以通过降低beclin 1介导的自噬作用,增强癌细胞对化疗药物的敏感性[25],提示可通过上调miR-30a的表达水平提高癌症化疗的疗效。此外,miR-489在大多数乳腺癌细胞和几种耐药乳腺癌细胞系中下调,而miR-489直接靶向自噬激活激酶1(ULK1)和溶酶体蛋白跨膜4β(LAPTM4β),从而介导自噬抑制,是阿霉素致敏的主要机制[26]。
当前的研究显示miRNA的表达谱在耐药和不耐药肿瘤里表达不同。miRNA在肿瘤耐药方面发挥多种调控作用,因此,针对miRNA的新型治疗药物的发现有望为未来的癌症治疗带来希望。研究显示,过表达miR-195可显著降低抗凋亡蛋白Bcl-w的表达水平,提高肝癌对5-FU的敏感性[27]。项目组研究发现miR-296-3p可通过靶向抑制CX3CR1来提高NSCLC的化疗敏感性[28]。此外,miR-216b在肝癌中介导自噬,它的上调抑制自噬标志物LC3-II的表达,通过HIF-2α-MALAT1-miR-216b轴调控肝癌的多重耐药性[29]。
根据研究报道,miR-147b可逆转EMT,诱导细胞周期阻滞,且能逆转结肠癌细胞对抗癌药物吉非替尼的耐药性[30]。此外,miR-147b在结肠癌细胞中下调,过表达miR-147b降低了结肠癌细胞中肿瘤干细胞标记物OCT4、SOX2和NANOG的表达,进一步证实miR-147b通过Wnt/β-Catenin通路抑制EMT,进而抑制结肠癌干细胞化[31]。研究发现miR-147b在HCC细胞系和原发性肝癌组织中均下调,HOXC6是miR-147b的下游靶点,过表达miR-147b抑制了HOXC6表达,显著抑制肝癌在体外的增殖和迁移,并增加对5-FU化疗敏感性,降低体内致瘤性[32]。这表明miR-147b可以作为逆转和预防肺癌耐药性的潜在靶点[33]。下一步可对circRNA MYO1C与miR-147b间具有怎样的表达相关性进行研究证实。
本研究结果显示在干扰circRNA MYO1C后,细胞中OCT4、SOX2、NANOG和IC3II/LC3I水平蛋白水平显著降低,而P62水平升高。本研究首次揭示了circRNA MYO1C促进NSCLC细胞生长和迁移的功能,此外,circRNA MYO1C还参与了CSCs和自噬调控,这可能与NSCLC的转移和耐药密切相关。
综上所述,下调circRNA MYO1C能够抑制NSLCLC细胞的CSCs分化和自噬相关蛋白表达,并抑制肺癌细胞迁移。本研究为提高NSCLC化疗敏感性提供新的作用靶点,希望进而能让目前困扰临床的化疗耐药问题能有所突破。
