术前炎症相关指标与可切除胃癌患者预后的相关性
2021-12-20陈奕心孙轶华程洋洋何凯桐郭婷
陈奕心 孙轶华 程洋洋 何凯桐 郭婷
胃癌是我国发病率较高的恶性肿瘤,严重威胁居民健康。2015年发病率与死亡率分别位列癌谱第2位和第3位[1]。其疾病进展迅速,临床发现或诊断时多数已至进展期[2]。尽管多学科治疗取得了进展,包括手术、化疗和生物靶向治疗,但进展期胃癌患者的长期生存率仍然很低[3]。虽然已发现与胃癌患者预后不良相关的免疫学和组织学生物标志物,但这些生物标志物在很大程度上依赖于昂贵设备、复杂技术,且耗时。因此,寻找简单、经济、快速的评估胃癌患者预后的关键指标,对患者的治疗、提高生活质量、延长生存期,从而避免无效或过度治疗具有重要的临床意义[4]。
大量流行病学资料与分子生物学实验结果提示肿瘤患者体内炎症状态与肿瘤发生发展密切相关[5]。在对肿瘤患者预后研究中,中性粒细胞与淋巴细胞比值(Neutrophil to lymphocyte ratio,NLR)和血小板与淋巴细胞比值(Platelet to lymphocyte ratio,PLR)作为机体炎症反应最直观的生物标志物,在多种实体肿瘤中,如小细胞肺癌[6]、宫颈癌[7]、食管鳞状细胞癌[8]等已被用于预测生存率和复发率。系统性免疫炎症指数(Systemic immune-inflammation index,SII)是基于中性粒细胞(Neutrophil,N)、血小板(Platelet,P)和淋巴细胞(Lymphocyte,L)构建的一个新的炎症综合评估指标。本研究通过分析可切除胃癌患者术前SII、NLR、PLR水平与其临床病理特征之间的关系,结合随访结果评估其预后价值,并比较SII、NLR、PLR对可切除胃癌患者生存结局的预测能力,希望可以为后续临床诊治提供参考依据。
1 资料与方法
1.1 研究对象
本研究回顾性分析我院2013年10月—2015年2月收治的226例经手术治疗的胃癌患者临床资料。纳入标准:(1)经胃镜及病理确诊为原发性胃癌,并未经任何治疗;(2)无合并其他恶性肿瘤;(3)血常规及其他数据在手术前一周内获取;(4)所有相关的数据和信息都是在患者没有出现感染症状的情况下进行评估的。排除标准:(1)排除有疑似感染性症状;(2)病例资料不完整或失访患者。另选取同期在我院健康体检者130例为对照组,男性100例,女性30例,平均年龄(58.14±11.14)岁。
1.2 方法
1.2.1 术前外周血炎症相关指标的计算 收集患者术前七天内血常规数据,记录中性粒细胞、血小板、淋巴细胞的绝对值,分别计算SII、NLR、PLR;其中SII=P×N/L,NLR=N/L,PLR=P/L。
1.2.2 临床病理特征及生存指标 入组患者的临床病理特征包括年龄、性别、肿瘤最大径、TNM分期(根据AJCC/UICC第八版胃癌分期标准评定),临床资料均依据患者病程记录和病理报告进行收集。同时收集患者术前癌胚抗原(CEA)和糖类抗原199(CA199)。
本研究选用的生存期指标为总生存期(OS),定义为确诊日期至死亡日期或随访截止日期的时间。每3~6个月随访1次,所有患者完成5年随访后即停止随访,所有入组患者均随访至2019年12月30日,期间因胃癌死亡视为发生结局事件。
1.3 统计学方法
运用SPSS 26.0统计软件对数据进行统计分析,组间比较采用χ2检验或Mann-WhitneyU检验。采用受试者操作特征(Receiver operating characteristic,ROC)曲线方法确定SII、NLR、PLR预测可切除胃癌患者生存结局的最佳截断值,将患者分为高值组和低值组。采用Kaplan-Meier法绘制生存曲线,Log-rank检验用于分析生存曲线之间的差异。采用多因素Cox回归分析筛选影响胃癌患者OS的独立危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 健康组与胃癌组相关指标的比较
健康组与胃癌组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。胃癌组SII中位数(四分位数)为403.26(280.98~560.45)、NLR为1.71(1.34~2.43)、PLR为116.76(87.82~152.31),均明显高于健康组,差异均有统计学意义(P<0.05)(表1)。

表1 健康组与胃癌组术前SII、NLR、PLR的比较Table 1 Comparison of preoperative SII,NLR and PLR between the gastric cancer group and healthy group
2.2 SII、NLR、PLR值与临床病理参数之间的相关性
根据患者的生存结局情况绘制ROC曲线,取约登指数最大时对应的数值为最佳截断值,确定SII界值为406.80、NLR界值为1.82、PLR界值为130.80,以该值为依据,将患者分组:SII≥406.80为高SII组(108例),SII<406.80为低值组(118例);NLR≥1.82为高NLR组(99例),NLR<1.82为低NLR组(127例);PLR≥130.80为高PLR组(87例),PLR<130.80为低值组(139例)。SII、NLR、PLR与可切除胃癌患者的肿瘤最大径、分化程度、T分期、淋巴结转移状态、远处转移、临床分期、CA-199均有关(P<0.05)。SⅡ和NLR与肿瘤位置有关,而NLR还与患者性别、是否饮酒有关(P<0.05)。SII、NLR、PLR与可切除胃癌患者的年龄、是否吸烟、CEA均无关(P>0.05)(表2)。

表2 胃癌患者临床病理特征与术前炎症指标水平关系Table 2 Relationship between clinicopathological characteristics and preoperative inflammatory indexes in patients with gastric cancer
2.3 影响可切除胃癌术后OS的危险因素分析
单因素Cox回归分析结果显示,年龄、肿瘤位置、肿瘤最大径、分化程度、TNM、临床分期、SII、NLR、PLR、CEA、CA199可能与胃癌患者的OS有关。将单因素分析中所有可能影响预后的因素纳入多因素Cox回归分析,高SII、高NLR、高T分期、有远处转移是影响可切除胃癌患者的独立危险因素(表3)。

表3 胃癌患者预后影响因素的单因素及多因素Cox回归分析Table 3 Univariate and multivariate Cox analysis of prognostic factors of patients with gastric cancer
SII<406.80的患者5年累积生存率高于SII≥406.80的患者(88.7%vs.22.4%),差异有统计学意义(χ2=112.4,P<0.001)(图1)。
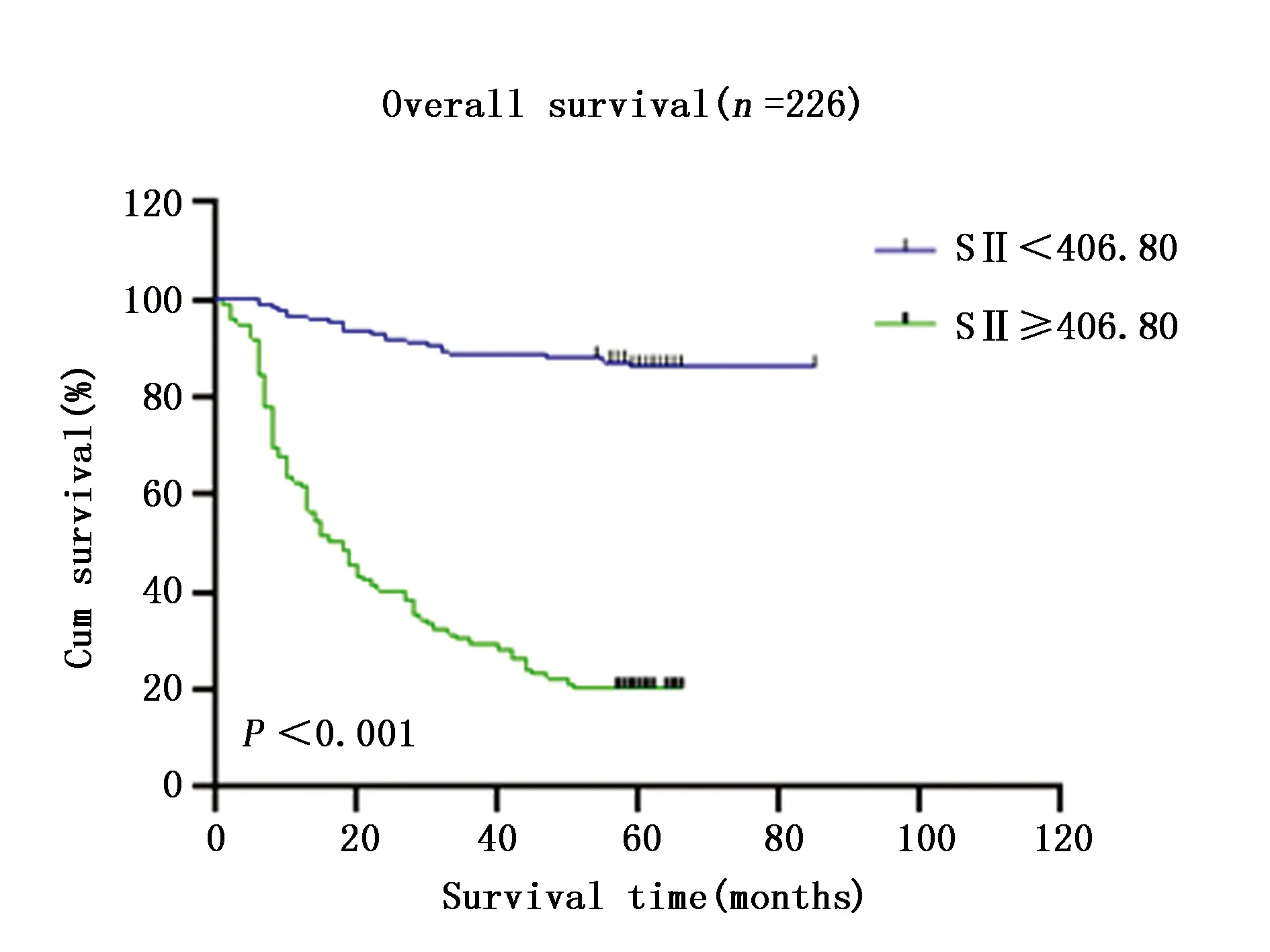
图1 SII<406.80和SII≥406.80患者的生存曲线Figure 1 Survival curve of patients with SII< 406.80 and SII≥406.80
2.4 SII、NLR、PLR及CEA199评估胃癌患者预后价值的比较
SII预测可切除胃癌患者结局的AUC值(AUC=0.840,95%CI:0.785~0.895),灵敏度(86.6%),特异度(68.0%)高于NLR、PLR及CA199,差异有统计学意义(P<0.001)(图2,表4)。

图2 SII、NLR、PLR及CA199对胃癌预后的预测作用Figure 2 ROC curve for SII,NLR,PLR and CA199 in predicting prognosis of gastric cancer patients

表4 SII、NLR、PLR及CA199在评估胃癌患者预后价值的比较Table 4 Comparison of SII,NLR,PLR and CA199 in evaluating the prognostic value of gastric cancer patients
3 讨论
在过去10年中,炎症和癌症之间的联系已经在流行病学、临床和分子水平上进行了深入研究和证实[9]。炎症促进肿瘤的发生发展,肿瘤为炎症的持续提供了条件,两者相互补充[10]。其中,来自外周血的炎症相关细胞(中性粒细胞、血小板和淋巴细胞)与肿瘤的进展显著相关[11]。中性粒细胞和血小板通过释放血管内皮生长因子(VEGF)、基质金属蛋白酶9、髓过氧化物酶(MPO)、细胞因子和趋化因子等来刺激肿瘤的发生和血管的生成[12]。肿瘤周围中性粒细胞数量增加可能抑制自然杀伤细胞和活化T细胞的抗肿瘤免疫反应。淋巴细胞数量减少可能削弱淋巴细胞介导的抗肿瘤细胞免疫应答[13]。炎症相关比值反映了外周血细胞的变化,中性粒细胞和血小板数量的相对增加或淋巴细胞计数的相对减少,这种趋势打破二者平衡状态,使机体的抗肿瘤能力下降,肿瘤抗原诱导的免疫耐受,导致抗原无法被抗原提呈细胞识别,致使肿瘤细胞逃逸,可以为肿瘤的转移与浸润提供条件[14]。
本研究通过分析单中心226例胃癌患者的临床病理资料,将既往研究中提到可能与胃癌相关的术前外周血系统性炎症相关指标(SII、NLR、PLR)纳入研究,探究炎症相关指标能否作为可切除胃癌的预后因素,结果得出胃癌组炎症相关指标SII、NLR、PLR水平显著高于健康组。SII、NLR、PLR的升高体现了在胃癌患者体内呈现一种慢性炎症状态,提示炎症相关指标可以为预测胃癌的发生提供参考依据。此外,高SII、NLR、PLR组患者在肿瘤最大径、分化程度、T分期、淋巴结转移、远处转移、临床分期与低SII、NLR、PLR组患者差异存在统计学意义,提示可切除胃癌患者SII、NLR、PLR越高,肿瘤直径越大,分化程度越低,肿瘤浸润程度越深,淋巴结转移越多,临床分期越晚,预后越差。
本研究结果示在单因素预后分析中术前SII、NLR、PLR均可影响可切除胃癌患者的预后,但在多因素分析中SII、NLR可作为独立危险因素,PLR并不是影响预后的独立危险因素。高SII、NLR组患者总生存率均低于低SII、NLR组患者。SII作为一个更为综合的炎症相关指标,其升高通常表明中性粒细胞、血小板数量增多或淋巴细胞减少,这反映了患者炎症反应升高和免疫功能障碍[15]。最近一项包含24篇完整文章的Meta分析[16],共纳入9 626 例患者,结果显示SII高值组胃癌患者的总体生存率显著低于SII低值组(HR=1.52,95%CI:1.29~1.74)。同样,在罕见的肺肉瘤样癌研究中[15],SII值≥430.8是肺肉瘤样癌的独立预后预测因子,其预测的灵敏度和特异度都优于NLR和PLR。这与本研究结果一致,SII作为一个更好的炎症相关指标来预测胃癌患者的预后,有助于为胃癌患者确定合适的治疗策略。
对NLR的研究近年来显著增多,其预后价值在多种实体肿瘤中得到了验证。在一项荟萃研究分析中,Kim等[17]分析了41项研究,包括18 348例患者,结果显示NLR大于临界值,生存率越低预后越差(HR=1.710,95%CI:1.481~1.975,P<0.001),与本研究单因素分析结果一致。
综上所述,炎症相关指标与可切除胃癌患者预后密切相关,且SII的评估效能优于NLR、PLR。炎症相关指标基于外周血检查,是入院时常规检测项目,具有收集方便、价格低廉、结果可靠等优势。然而,本实验也具有一定的局限性,SII、NLR、PLR的最佳截断值尚无标准且实验选取的样本数较少、选择偏倚或研究中纳入不同疾病阶段的患者,导致研究间的异质性,其临床价值仍需要前瞻性、大样本、多中心研究来证实及进一步探讨,以便更好评估肿瘤患者的预后风险,提供更有效地治疗指导。
