小白菊内酯调控自噬抑制食管癌细胞增殖和转移的作用研究*
2021-12-20吕娉婷
吕娉婷,付 瑶,宋 慧
(辽宁省辽阳市中心医院 1.药学部;2.药库;3.药局,辽阳 111000)
食管癌是一种常见的消化道恶性肿瘤,其发病率和病死率在全球恶性肿瘤中居第四位[1],在我国恶性肿瘤发病率中排第二,病死率排第三[2]。食管癌的危险因素包括遗传背景、吸烟、饮酒、胃食管反流病、饮食和肥胖等[3]。由于食管癌早期无症状,多数患者在初诊时已处于晚期,目前对于食管癌晚期患者的治疗手段有限,患者的预后仍然较差[4]。中药在食管癌的治疗中取得了较大的疗效,其作为临床化疗药物的补充治疗显著改善了食管癌患者的预后[5]。小白菊内酯(parthenolide,PTL)是传统药材芳香植物小白菊(tanacetum parthenium)的主要活性成分,具有较强的抗炎、抑菌、解痉作用。研究发现,PTL能明显抑制肺癌、结直肠癌及食管癌细胞的增殖、迁移和凋亡[6-8],表明PTL 具有抗肿瘤活性。自噬是不同于细胞凋亡的另一种程序性死亡现象,对于维持内环境的稳态起着重要作用。在肿瘤的发生发展过程中,自噬对于肿瘤的生长起到了负性调控作用[9]。本研究旨在探讨PTL调控自噬抑制食管癌细胞增殖和转移的作用机制。
1 材料与方法
1.1 药物、细胞和主要试剂 PTL、自噬抑制剂3-MA 和自噬诱导剂Rapamycin 均购自美国Selleckchem 公司;食管癌细胞系Eca109 购自中国上海科学院细胞库;DMEM 细胞培养基和胎牛血清(FBS)购自上海弘顺生物科技有限公司;MTS细胞增殖试剂盒购自中国北京百奥莱博科技有限公司;Transwell小室购自美国Coring公司;高效蛋白裂解液购自上海贝博生物科技公司;BCA蛋白浓度检测试剂购自上海碧云天生物技术有限公司;SDS-PAGE 凝胶配制试剂盒购自北京索莱宝试剂公司;PVDF 膜购自美国Millipore 公司;P62、Beclin1、LC3 Ⅱ和GAPDH 抗体购自英国Abcam 公司;ECL 化学发光试剂盒购自美国Thermo公司。
1.2 细胞培养 食管癌细胞Eca109 快速复苏后,用含10%FBS的DMEM完全培养基,置于5%CO2、37 ℃细胞培养箱中培养。每48 h更换细胞培养基,当细胞汇合度达到70%时,胰酶消化、传代,取生长状态良好的细胞进行实验。
1.3 MTS法检测细胞增殖 用DMEM完全培养基调整细胞浓度为1.5×104个/mL,以每孔100µL细胞悬液接种至96 孔板,分为不同浓度(2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L 和40 μmol/L)PTL组和对照组(NC 组、0 μmol/L PTL),每组6 个平行复孔。处理48 h 后,更换100 µL DMEM 完全培养基,每孔加入20 µL 的MTS 试剂,混匀,继续培养2 h。采用酶标仪检测490 nm波长处的吸光度(OD)值。细胞增殖抑制率=(1-OD 值PTL 组/OD 值NC 组)×100%。
采用DMEM完全培养基调整细胞浓度为1×105个/mL,以2 mL/孔细胞悬液接种于6 孔板,分为4组:NC 组、PTL 组、PTL+Rapamycin 组、PTL+3-MA组。PTL组加入10 μmol/L PTL,PTL+Rapamycin组加入10 μmol/L PTL 和10 μmol/L Rapamycin,PTL+3-MA 组加入10 μmol/L PTL 和5 μmol/L 3-MA,NC组加入等量二甲基亚砜(DMSO)。同以上方法检测各组细胞增殖抑制率。实验重复3次。
1.4 Transwell检测细胞迁移 用DMEM无血清培养基调整细胞浓度为1×106个/mL,以100 µL/孔细胞悬液接种于Transwell小室的上室聚碳酸酯膜上,Transwell 小室的下室加入500µL DMEM 完全培养基,置于5% CO2、37 ℃全湿度培养箱中培养12 h。穿膜细胞经PBS 洗涤3 次,置于甲醇溶液中固定10 min,吉姆萨染色30 min。显微镜下观察,计算穿膜细胞数。实验重复3次。
1.5 裸鼠皮下成瘤实验检测细胞体内生长能力 用PBS 调整细胞浓度为5×107个/mL,以100µL/只细胞悬液注射于裸鼠左侧腋下。给予动物充足的水和食物,并在适宜的环境中饲养。将成瘤裸鼠随机分为NC组和PTL组,每组6只。注射食管癌细胞1周后,PTL组灌胃给予2 mg/kg PTL,NC组灌胃给予等量DMSO,每隔一天灌胃1 次,连续21 d。每周观察成瘤情况,测量裸鼠成瘤的体积。给药结束时,将瘤体剥离出,对瘤体进行称重。
1.6 Western blotting法检测自噬相关蛋白表达
加入高效蛋白裂解液裂解细胞,4 ℃、14 000 r/min 离心30 min,取上清,BCA 法检测蛋白浓度,煮沸使蛋白变性;每组取50µg 蛋白,行SDS-PAGE 电泳(80 V、2 h),湿转法(350 mA、1.5 h)将蛋白转移至PVDF膜;8%脱脂牛奶室温孵育1 h,TBST洗膜3次;加入一抗P62、Beclin1、LC3Ⅱ(均1∶500)和GAPDH(1∶1 000),置于4 ℃冰箱孵育过夜,TBST洗膜3次;加入二抗(1∶8 000)室温孵育1 h,TBST 洗膜3 次。采用ECL 化学发光法凝胶成像系统Dolphin-View显示蛋白条带。Image J 软件分析蛋白条带灰度值。以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值作为目的蛋白表达量。实验重复3次。
1.7 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 PTL抑制食管癌细胞Eca109增殖 0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L 和40 μmol/L 组PTL 细胞增殖抑制率分别为(0.52±0.23)%、(14.16±3.04)%、(25.47±5.59)%、(42.25±2.36)%、(63.32±7.89)%和(75.18±5.34)%,PTL呈浓度依赖性地抑制食管癌细胞Eca109 的增殖(均P<0.05),PTL 作用Eca109 细胞IC50值为(9.53±1.28)μmol/L。
2.2 PTL调控自噬对食管癌细胞增殖能力的影响 与NC 组比较,PTL 组、PTL+Rapamycin 组和PTL+3-MA 组细胞增殖抑制率升高,即细胞增殖能力降低(均P<0.05);与PTL 组比较,PTL+Rapamycin 组细胞增殖抑制率升高,即细胞增殖能力降低(P<0.05),PTL+3-MA 组细胞增殖抑制率降低,即细胞增殖能力升高(P<0.05),见图1。

图1 4组食管癌细胞增殖能力比较
2.3 PTL调控自噬对食管癌细胞迁移能力的影响 与NC 组比较,PTL 组、PTL+Rapamycin 组和PTL+3-MA 组穿膜细胞数明显减少,即细胞迁移能力降低(均P<0.05);与PTL 组比较,PTL+Rapamycin 组穿膜细胞数明显减少,即细胞迁移能力降低(P<0.05),PTL+3-MA 组穿膜细胞数明显增加,即细胞迁移能力升高(P<0.05),见图2。
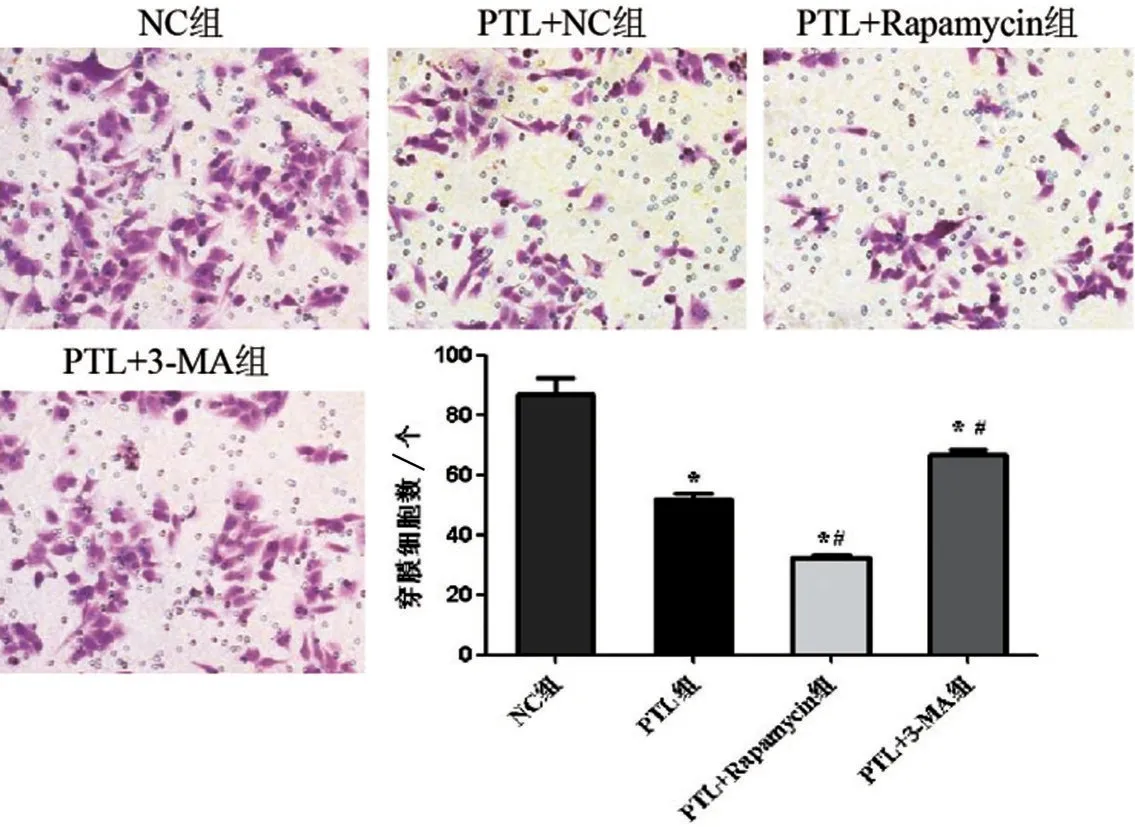
图2 4组食管癌细胞迁移能力比较
2.4 PTL 抑制食管癌细胞体内生长 裸鼠皮下成瘤实验结果显示,PTL 组成瘤体积为(140.57±13.54)mm3,明显低于NC 组的(328.38±13.76)mm3(t=23.830,P=0.006);PTL 组成瘤体重为(20.82±5.17)mg,明显低于NC 组的(37.65±8.36)mg(t=23.830,P=0.006),见图3。

图3 裸鼠皮下成瘤实验检测Eca109细胞体内生长能力
2.5 PTL 对食管癌细胞Eca109 自噬相关蛋白表达的影响 与NC 组比较,PTL 组、PTL+Rapamycin组和PTL+3-MA 组P62、Beclin1 和LC3Ⅱ蛋白表达量均显著升高(均P<0.05);与PTL 组比较,PTL+Rapamycin组P62、Beclin1和LC3Ⅱ蛋白表达量显著升高(P<0.05),PTL+3-MA 组P62、Beclin1 和LC3Ⅱ蛋白表达量明显降低(P<0.05),见图4。

图4 4组食管癌细胞自噬相关蛋白表达量比较
3 讨论
目前新辅助疗法、手术切除、放疗和化学疗法是食管癌患者的主要治疗方法,但是食管癌患者的预后仍然不理想[4]。与肺癌、乳腺癌和结肠癌等恶性肿瘤不同,分子靶向治疗已广泛应用于临床治疗,目前尚未开发出专门针对食管癌的靶向疗法[4]。中草药在亚洲已经使用了数千年,不仅具有抗炎活性,并含有丰富的抗癌化合物,已长期用作抗肿瘤药物,可在肿瘤微环境和肿瘤免疫中发挥直接的细胞毒性作用和间接调控作用,并改善化疗药物的副作用[10]。双氢青蒿素等中草药具有较低的毒性,能提高患者的生活质量,延长生存期[5,10]。
PTL属于天然倍半萜内酯,包含α-亚甲基-γ-内酯环和环氧基团,使得其能够与生物分子的亲核位点相互作用,PTL一直被用作消炎和抗偏头痛的特性草药,最近其抗癌活性被逐渐发现[11]。PTL 可通过调控增殖和凋亡相关蛋白,用于抑制和治疗尼古丁相关的肺癌[6]。在结直肠癌中,PTL 通过抑制间充质蛋白的表达抑制转化生长因子-β1诱导的上皮间质转化,最终导致肿瘤细胞的转移和侵袭能力降低[7]。另有文献报道,PTL 可减弱食管癌Eca109 和KYSE-510 细胞在体外的增殖、迁移和血管生成能力,以及抑制小鼠异种移植瘤生长[8];并通过抑制NF-κB 信号通路,调控肿瘤生长、血管生成等相关基因的表达[11-12]。本研究发现,PTL呈浓度依赖性地抑制食管癌细胞Eca109增殖、迁移及裸鼠体内生长(P<0.05)。
自噬是维持真核细胞内稳态的进化保守过程,在蛋白质和细胞器的降解和代谢中起主要作用。自噬是一把“双刃剑”,在某些情况下会触发肿瘤细胞的死亡,而有些研究显示自噬增强肿瘤细胞生长能力[9]。中药通过诱导自噬抑制恶性肿瘤的进展是其发挥抗癌作用的重要机制,研究报道,PTL 呈浓度依赖性地增加胰腺癌细胞自噬,诱导细胞凋亡[13]。PTL 通过诱导自噬在体内、外抑制乳头状甲状腺癌细胞的生长和迁移能力[14]。而自噬相关蛋白的改变是细胞自噬的关键,Beclin1基因是自噬必需的,其缺失等位基因在食管癌中被报道[15]。而自噬受体蛋白P62及自噬发生的执行者LC3II表达增加均促进细胞自噬[16-17]。本研究发现,PTL 促进P62、Beclin1 和LC3Ⅱ蛋白表达(P<0.05),表明PTL 促进食管癌细胞的自噬。那么,PTL 是否通过调控细胞自噬抑制食管癌细胞的增殖和转移能力?本组进一步采用自噬诱导剂Rapamycin及自噬抑制剂3-MA 与PTL 共同处理食管癌细胞,结果显示,与Rapamycin 联合干预细胞后,PTL 对食管癌细胞增殖和迁移能力的抑制作用增强;而与3-MA 共同干预细胞,PTL 对食管癌细胞增殖和迁移能力的抑制作用减弱(P<0.05),表明PTL通过促进细胞自噬在食管癌中发挥抗癌作用。
综上所述,PTL 通过促进细胞自噬抑制食管癌细胞的增殖和迁移及体内移植瘤生长,有望成为治疗食管癌的新型药物。
