CDH13基因在转移性肾透明细胞癌中的研究*
2021-12-20周晓慧王怡方周晓莹
郑 倩,周晓慧,王怡方,周晓莹
(广西医科大学生命科学研究院,南宁 530021)
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统中最常见的恶性肿瘤之一[1]。RCC可分为肾透明细胞癌(kidney clear cell carcinoma,KIRC)、肾乳头状细胞癌(kidney papillary cell carcinoma,KICH)和肾嫌色细胞癌(kidney chromophobe,KIRP)等亚型,其中以KIRC 最为常见,占肾细胞癌死亡人数75%[2]。局部肾细胞癌可以通过肾切除和立体定向消融放疗来治疗,但是仍有30%的患者最终发生转移,其中KIRC 在转移性肾癌中占83%~88%。尽管基 于VEGF(vascular endothelial growth factor,VEGF)和雷帕霉素(mamalian target of rapamycin,MTOR)等分子靶向药物已经应用于肾细胞癌的临床治疗,但是对于大多数具有远处转移患者的效果却微乎其微[3-4]。因此,找寻新的肾细胞癌生物分子标志物对于疾病诊断、预后的判断、制定精准的治疗方案具有重要的意义。
CDH13基因位于染色体16q14.2-3,编码T-钙粘蛋白(T-cadherin,T-cad),是钙粘蛋白家族的成员之一。越来越多的研究表明,T-cad的下调与肿瘤的侵袭和转移有关,如胃癌、膀胱癌、前列腺癌等,推测T-cad 可能是一种肿瘤转移抑制因子[5-7],但在KIRC中的研究尚未见报道。本文主要探索CDH13 在KIRC中的转录、蛋白表达改变和调控机制,及其作为预后标志物的价值,以期为临床治疗KIRC 提供实验依据。
1 材料与方法
1.1 TCGA 数据库 利用UCSC Xena 数据库(https://xena.ucsc.edu/)下载TCGA 数据库分析533例KIRC组织和72例正常肾组织RNA-Seq数据,分析CDH13 在KIRC 中的转录水平及与患者临床病例特征之间的相关性。
1.2 GEO数据库 从NCBI中的GEO数据库(https://www.ncbi.nlm.nih.gov/gds/)搜索KIRC 相关的表达谱芯片,纳入标准:(1)至少包含KIRC 组织和非癌组织各3 例;(2)来源物种为人类;(3)包含CDH13的数据,由此共纳入13套表达谱芯片,包含476 例KIRC 组织和312 例正常肾组织,对CDH13 mRNA转录水平进行Meta分析。
1.3 分析CDH13 在KIRC 启动子区甲基化水平与患者生存时间之间的关联 使用UALCAN 网页(http://ualcan.path.uab.edu/index.html)分别对CDH13蛋白表达和DNA 甲基化水平进行分析。利用SMART 在线分析网页(http://www.bioinfo-zs.com/smartapp),确定CDH13启动子区CpG岛在KIRC中的甲基化修饰水平。通过MethSurv 在线甲基化分析网页(https://biit.cs.ut.ee/methsurv/)分析CDH13在KIRC启动子区甲基化水平与患者生存时间之间的关联。
1.4 细胞及培养
人肾癌细胞系A498(货号CL-0254)购于武汉普诺赛生命科技有限公司,Caki-2 置于液氮中长期保存,分别使用DMEM和5A培养基(均含有10%的澳洲胎牛血清和1%的青链霉素混合液)中进行培养。利用甲基转移酶抑制剂5-氮杂-2’-脱氧胞苷(5-aza-dC)处理肾癌细胞系,将处于对数生长期的A498和Caki-2细胞接种与6孔板中,使用DMSO配制5-aza-dC 工作液浓度为5 μmol/L,连续处理4 d,对照组细胞则用DMSO处理。
1.5 实时荧光定量PCR检测CDH13转录水平
肾癌cDNA芯片购自上海芯超生物科技有限公司,其cDNA 芯片(cDNA-HKidE030CS01)包含15例KIRC组织和匹配的邻近组织。通过实时荧光定量PCR 对15 例KIRC 组织样本与15 例匹配的癌旁组织样本,利用SYBR Green 定量试剂盒,在Quant-Studio 5 Flex Real-time PCR系统使用Q-PCR反应检测CDH13 mRNA 表达水平,实验采用20 μL 体系,包括SYBR 10 μL,去离子水7 μL,正反向引物和cDNA各1 μL构成。PCR扩增程序:95 ℃(预变性)10 min;95 ℃10 s,60 ℃1 min 共40 个循环。采用Ct(2-ΔΔCt)法方法计算CDH13 的mRNA 转录水平。引物序列(5'~3'):CDH13-Forward:AGAAAGGTCCAAGTTCCGGC,CDH13-Reverse:ACTTCTCTGTCCAAGGTCCGT;GAPDH-Forward:AAGCTCACTGGCATGGCCTT,GAPDH-Reverse:CTCTCTTCCTCTTGTGCTCTTG。
1.6 统计学方法
采用SPSS 23.0 统计软件进行数据分析,数据均为计量资料,数据间使用两两独立样本t检验进行分析,数据采用均数±标准差()表示,利用stataSE-64 12.0统计软件进行Meta分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 CDH13 在KIRC 中的mRNA 转录和蛋白表达改变 CDH13在KIRC患者中的转录水平较正常对照组织上调(P<0.05),见表1。Meta 分析显示KIRC 组织CDH13 mRNA 水平高于正常组织(P<0.05),与TCGA 数据分析结果一致。森林图显示CDH13 在KIRC 中的表达研究存在异质性(I2=85.6%,P=0.000)(图1 A),使用随机效应模型进行分析,95%置信区间CI:1.57~2.51(P=0.000)(图1B),Beggar’s 漏斗图法显示发表性存在发表偏倚(P<0.05)(图1C)。
KIRC组织中CDH13转录水平较正常组织明显升高(P=0.012)(图1D),与生物信息分析结果一致。利用UALCAN网页中CPTAC数据库分析发现CDH13 蛋白表达水平在KIRC 组织(n=110)较正常组织(n=84)中明显上调(P<0.05,图1E)。
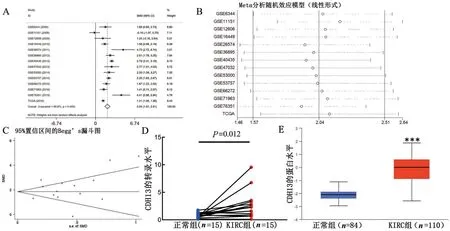
图1 CDH13在KIRC中的mRNA转录和蛋白表达改变
2.2 CDH13 在KIRC 中的mRNA 和蛋白表达与临床特征的相关性 CDH13的转录水平在伴有淋巴、远处器官转移的KIRC患者中显著低于无转移的患者(P<0.05),见表1。表1 结果提示CDH13 mRNA表达水平与KIRC 的疾病进程密切相关。此外,CDH13 的蛋白水平在Ⅰ~Ⅳ期的KIRC 中均显著高于正常组织(P<0.05),但随着分期越高,CDH13表达则有下降趋势(图2A),CDH13 的蛋白水平虽然较正常组织升高,但随着临床分级的不断发展,其蛋白变化不明显(图2A),却随着肿瘤分级的程度的不断恶化而逐渐降低(P<0.05)(图2B)。

图2 CDH13在KIRC中蛋白表达水平与临床特征之间的关系
表1 CDH13 在KIRC 中mRNA 表达水平及其与临床病特征的关系

表1 CDH13 在KIRC 中mRNA 表达水平及其与临床病特征的关系
2.3 KIRC中CDH13启动子区甲基化水平
KIRC组织中CDH13启动子区甲基化水平较正常组织升高(P<0.001);通过SMART网页对CDH13 在KIRC 中启动子区含有CpG 岛的位点进行筛选,得到6 个cg 位点,分别是cg08747377、cg05374412、cg00806490、cg08856946、cg09189772、cg09369556。通过对cg位点甲基化修饰分析,发现不同位点中CDH13 甲基化水平均在KIRC 中上调。为了验证CDH13 启动子区确实受到甲基化修饰的调控,使用甲基转移酶抑制剂5-aza-dC 处理A498 与caki-2 两株肾癌细胞系,发现经过5-aza-dC处理4 d 后,CDH13 的转录水平高于未经处理组(P<0.05),说明CDH13 的启动子区确实受甲基化的调控,见图3。
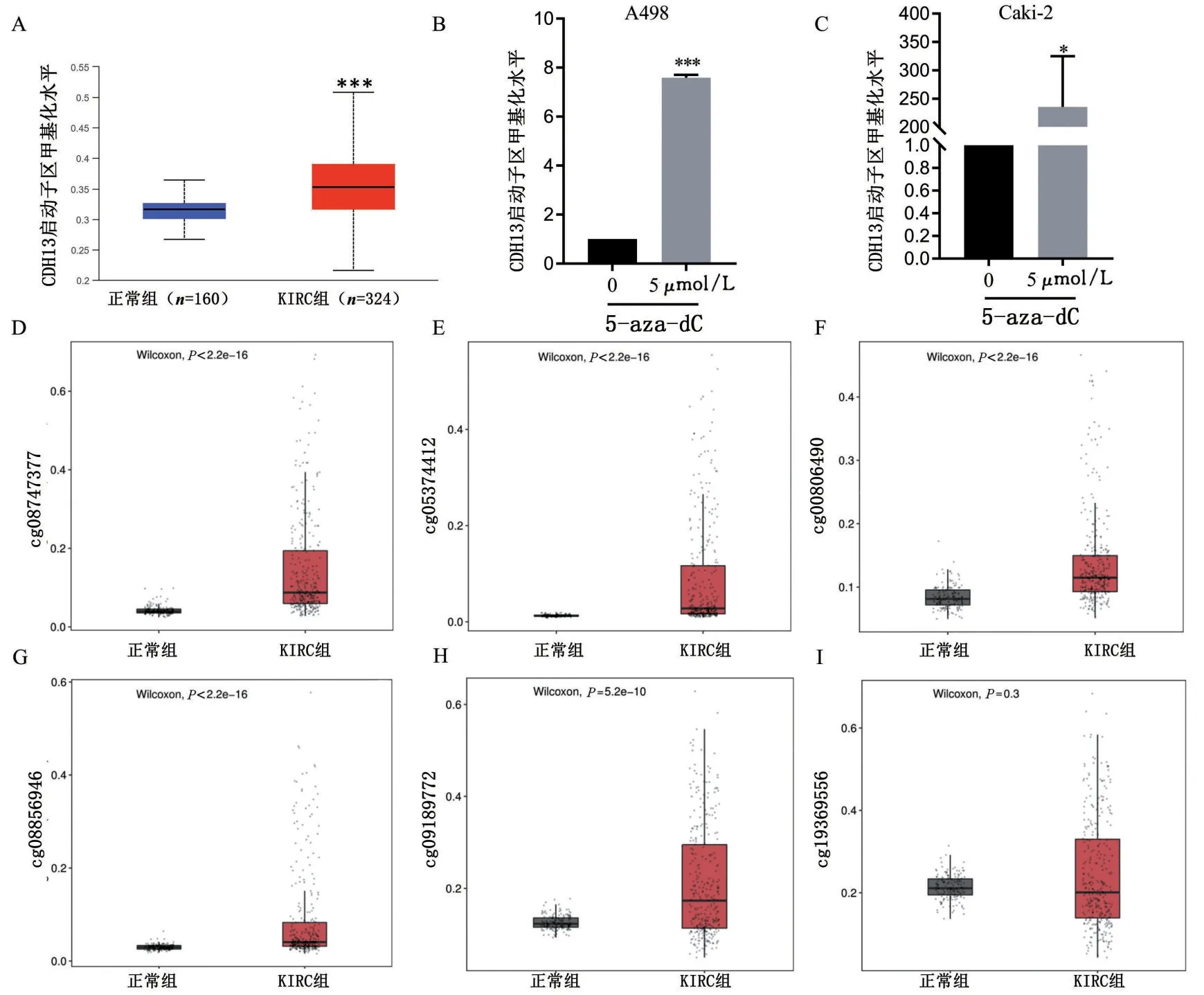
图3 KIRC中CDH13启动子区甲基化水平
2.4 CDH13甲基化水平与KIRC临床特征的相关性
CDH13随着临床分期的升高,甲基化水平逐渐升高(P<0.05);此外,利用SMART 在线分析工具,对不同cg位点的甲基化水平进行分析,发现不同位点均随着肿瘤分期的发展逐渐而升高(P<0.05),见图4。

图4 CDH13启动子区甲基化修饰水平与KIRC临床特征之间的关系
2.5 CDH13 mRNA和甲基化的预后分析 为进一步验证其预后,利用TCGA 数据库中KIRC 患者的生存时间与CDH13的转录和甲基化水平进行分析,发现mRNA 转录水平中随着CDH13 低表达患者生存时间明显下降(图5A),差异具有统计学意义(P<0.05)。同时对启动子区cg 位点的甲基化水平进行生存分析,发现5个cg位点随着甲基化水平的升高,患者的生存时间明显下降(P<0.05)(图5B~图5F)。因此,CDH13可以作为转移性KIRC预后的有效分子标志物。
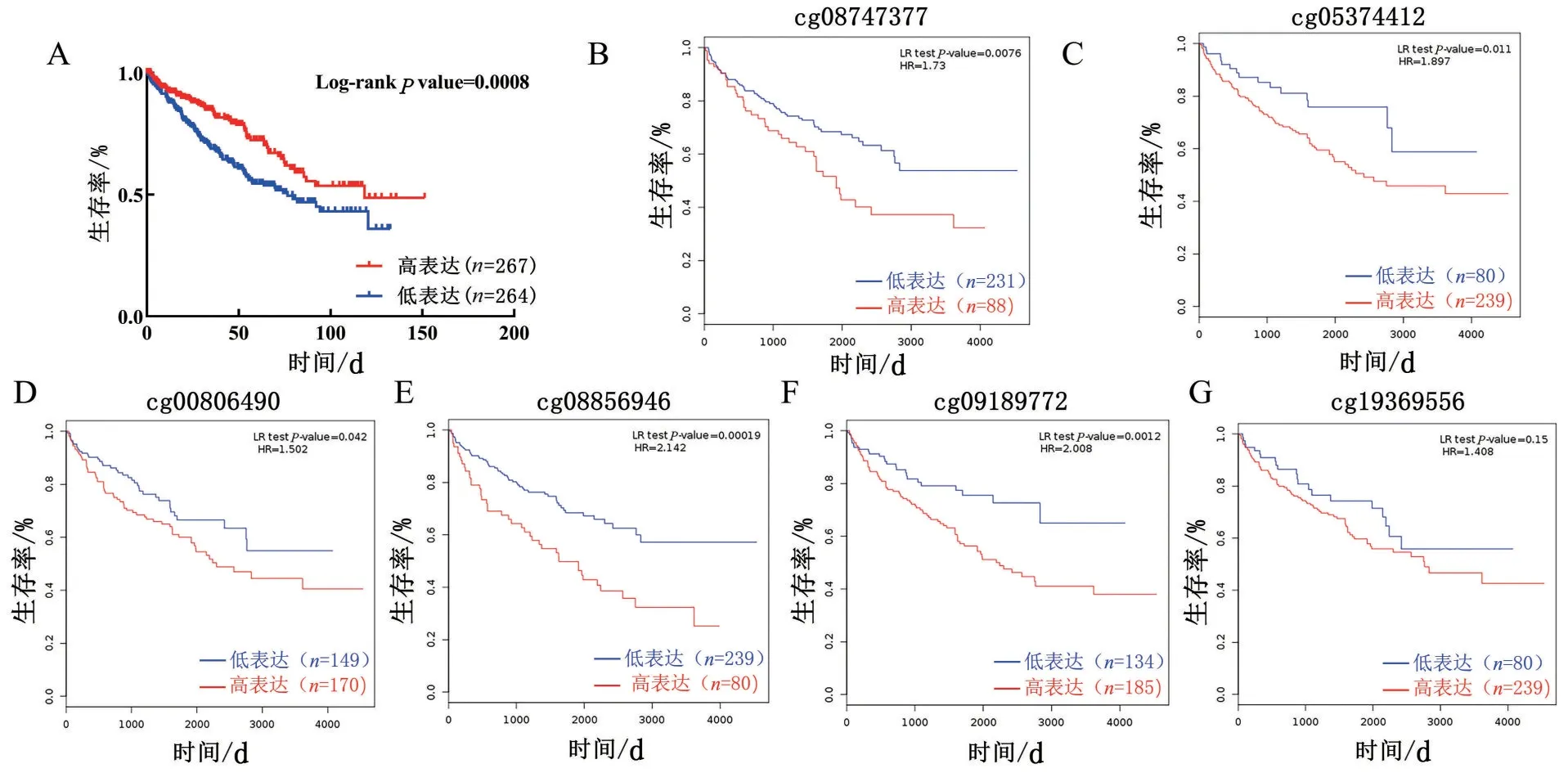
图5 CDH13表达和甲基化在KIRC中的预后相关性分析
3 讨论
研究表明,CDH13通过细胞—细胞黏附和整合素介导的细胞—基质接触之间的交叉作用调控肿瘤的侵袭和转移[8]。其与肿瘤的发展,尤其是在侵袭与转移过程可以作为重要的抑制因子[5],CDH13的高表达可逆转上皮—间质转化通路,通过上调CDH1、下调VIM、MMP-2 的表达影响胃癌细胞的迁移和侵袭[9]。此外,在口腔癌中CDH13表达下调可激活PI3K/AKT/mTOR 途径促进癌细胞的增殖[10]。本研究发现,CDH13 随着KIRC 患者病程的发展逐步表达下调,有淋巴转移、远处器官转移的患者较无转移的患者,其转录水平和蛋白水平均降低,提示CDH13的下调可能参与KIRC的转移。
本研究还发现,CDH13 基因DNA 启动子区在KIRC 中呈高甲基化,同时启动子区含有CpG 岛的cg位点也呈现高甲基化,并随着肿瘤发展而逐步增高,利用去甲基化药物5-aza-dC 处理后可恢复CDH13的表达,进一步验证了CDH13在KIRC中受DNA 甲基化修饰的调控。表观遗传学在肿瘤中的作用一直是研究的热点,尤其是启动子区的高甲基化导致基因的转录沉默。在许多研究中,CDH13高甲基化在许多肿瘤中被报道,如乳腺癌、肺癌、前列腺癌等[5,7,11]。作为一种肿瘤生长和转移中的抑制因子,CDH13 异常高甲基化导致mRNA 水平明显降低,与肿瘤的发生、增殖、浸润和转移密切相关[12],而调控肿瘤基因功能的主要机制之一是启动子区域的异常甲基化,导致基因表达下调。Shenog 等[4]发现,CDH13启动子异常甲基化在结直肠癌中通过下调其表达在发病机制中起重要作用。在乳腺癌和肺癌中,Polβ(DNA polymerase β)的过表达可抑制肿瘤,而DNA 去甲基化可促进CDH13 转录表达上调从而诱导Polβ 的表达,进而抑制肿瘤的发展[13]。而本研究也证实CDH13 受DNA 甲基化调控,并可能参与KIRC的转移,与上述研究结论相符。
CDH家族有较多成员在KIRC中转录和表达异常,与肿瘤的分期和分级密切相关,并可以预测KIRC患者的预后情况[14]。本课题组前期研究发现,CDH4 的mRNA 转录水平在KIRC 的发展进程中逐渐下调,并且与晚期转移的KIRC 患者的CDH4 的转录水平呈负相关,提示CDH4 可作为KIRC 的潜在诊断和预后标志物[15]。此外,miR-27a-3p 靶向调控CDH5 的表达,使其在KIRC 的肿瘤分期和转移中转录水平下降,并且CDH5 低表达与KIRC 患者的生存及预后呈正相关关系,说明miR-27a-3p作为KIRC 的诊断标志物[16]。在本研究中,CDH13 在肿瘤发展进程其甲基化水平逐渐升高,导致KIRC 中CDH13 的转录和表达水平逐渐降低,提示其在KIRC 中的分期、分级和远处转移中可能受到广泛的甲基化修饰,且低表达CDH13的肾细胞癌患者生存时间降低,预后效果差。因此,CDH13 的表达在转移性KIRC的发生发展中起重要作用。
综上所述,本研究的结果初步发现CDH13 在KIRC 中由于受到DNA 高甲基化调控,随着疾病的进展,其转录和表达水平进一步失活,且通过转移性KIRC 患者的CDH13 转录水平可评估其预后效果。因此,CDH13 可能是转移性KIRC 潜在的预后标志物,为肾细胞癌的预后评价提供新研究的方向。
