牡蛎葛根固体饮料对实验性高血脂症小鼠的血脂调节及肝脏保护作用研究*
2021-12-20林桂宇成芳梅王翠荣韦锦斌黄仁彬赵劲民
林桂宇,黄 斌,成芳梅,王翠荣,韦锦斌,黄仁彬,赵劲民
(广西医科大学,南宁 530021)
高血脂症(hyperlipemia,HLP)是指体内脂质代谢紊乱、升高的状态,进而造成血脂成分含量增高[1],在临床上主要表现为总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)的异常升高[2]。HLP 是诱发动脉粥样硬化的直接因素,而动脉粥样硬化是诱发心脑血管疾病的直接因素。临床常用于调节血脂的药物有他汀类和贝特类药物。然而,这两种药物存在诸多的不良反应,且可能导致老年患者肝功能异常[3]。
中医认为HLP 是血浊病、“膏”病等,病机为肝失疏泄、脾失健运、痰瘀内阻,治疗方法主要为理肝调脾、化痰湿浊、活血化瘀[4]。牡蛎葛根固体饮料(OKPD)是由牡蛎、葛根、山楂、苦瓜4 味中药组成。牡蛎富含丰富的蛋白质和锌,具有保肝、降血糖、抗肿瘤等药用价值[5]。葛根具有解肌退热、升阳举陷的功效,常用于阴虚消渴、脾虚泄泻等[6]。研究发现,葛根素具有降血脂的作用[7]。目前尚无文献报道OKPD 治疗HLP 的相关研究。本研究用Triton WR-1339 诱导小鼠HLP,探讨OKPD 对HLP 小鼠的疗效及其机制。
1 材料与方法
1.1 实验动物 昆明种小鼠,SPF级,雌雄各半,体重(20±2)g,购自广西医科大学实验动物中心,动物生产许可证号:SCXK 桂2014-0002,动物使用许可证号:SYXK桂2014-0003。动物饲养于通风条件良好,温度在18~25 ℃,相对湿度在40%~70%,12 h 光照昼夜循环的环境。
1.2 药物的制备 OKPD(批号:20190616)是由葛根、山楂、苦瓜、牡蛎4 味药物按一定比例组成。其中葛根、山楂、苦瓜各2 kg,牡蛎粉1.2 kg。葛根、山楂、苦瓜3味药,先干燥后粉碎为80目,加水煎煮(2次,第1 次10 倍量,第2 次8 倍量,2 h/次),浓缩,得到浓缩膏。向浓缩膏中加入牡蛎粉1.2 kg(90 ℃烘烤30 min,超细粉),淀粉0.35 kg,糊精50 g,混匀,制成颗粒,备用。1 g OKPD相当于12 g生药材。成人每日用量为20~30 g(颗粒剂)/60 kg体重。
1.3 主要试剂 非诺贝特购自法国利博福尼制药公司。Triton WR-1339 购自Sigma 公司。LDL-C、高密度脂蛋白胆固醇(HDL-C)、TC、TG、丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)、一氧化氮(NO)、总NO 合成酶(T-NOS)试剂盒购自南京建成生物工程研究;通用SP试剂盒购自上海雅吉生物技术有限公司;兔抗核转录因子κB(NF-κB)、白细胞介素6(IL-6)及肿瘤坏死因子α(TNF-α)抗体购自Cell Signaling Technology公司;通用二抗购自Thermo Fisher Scientific公司。
1.4 动物分组、给药及模型建立 将60 只小鼠随机分为6 组,即正常对照组、模型组、非诺贝特阳性对照组及OKPD高、中、低剂量组,每组10只。非诺贝特阳性对照组灌胃给予0.03 g/kg 非诺贝特,OKPD 高、中、低剂量组分别灌胃给予10 g/kg、5 g/kg、2.5 g/kg的OKPD。给药体积为20 mL/kg,连续给药14 d,1次/d。正常对照组和模型组给予等量生理盐水。末次给药后1 h,除正常对照组外,其余各组小鼠腹腔注射600 mg/kg Triton WR-1339 构建HLP 模型[8-9]。
1.5 动物处置及标本制备 造模24 h 后,麻醉小鼠,眼眶取血,静置、离心、取血清,超低温冰箱保存备用。处死后取小鼠肝脏,一部分浸泡于4%甲醛溶液中,用于病理检查和免疫组化。另一部分存放于液氮中,用于检测肝功能指标。
1.6 血清生化指标的检测 收集小鼠血清,严格按照试剂盒说明检测血清中TC、TG、LDL-C、HDL-C、AST、ALT、T-NOS水平。
1.7 肝组织病理学检查 取4%甲醛固定24 h后的肝脏组织,行苏木精—伊红(HE)染色,于低倍镜下观察肝组织病理学变化。
1.8 免疫组化法检测肝脏组织中TNF-α、NF-κB、IL-6 蛋白表达 取出肝组织,常规石蜡包埋、切片。检测过程严格按照免疫组化试剂盒说明书进行操作,滴加一抗TNF-α(1∶800)、NF-κB(1∶1 000)、IL-6(1∶600),4 ℃孵育过夜,二抗(1∶10 000)孵育2 h,PBS 冲洗5 次后,染色、封片、阅片。细胞质内黄棕色颗粒为蛋白阳性表达。用Image Pro plus 6.0软件分析NF-κB、TNF-α及IL-6蛋白表达量,以平均光密度值表示蛋白的相对定量(平均光密度值=累积光密度值/阳性面积)。
1.9 统计学方法 采用SPSS 21.0软件对数据进行统计分析。计量资料以均数±标准差()表示,多组间比较用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 OKPD 对HLP 小鼠血清中TC、TG、HDL-C、LDL-C 水平的影响 模型组小鼠血清中TC、TG、LDL-C水平较正常对照组显著升高,HDL-C水平较正常对照组显著下降(P<0.05);与模型组比较,OKPD 高、中剂量组TC、TG 水平显著下降,OKPD各剂量组HDL-C 水平显著升高,LDL-C 显著下降(P<0.05),OKPD 低剂量组TC、TG 水平与模型组比较,差异无统计学意义(P>0.05);OKPD 高剂量组TC 水平显著低于OKPD 低剂量组(P<0.05),见表1。
表1 OKPD对HLP小鼠血清中TC、TG、LDL-C、HDL-C水平的影响mmol/L,,n=10

表1 OKPD对HLP小鼠血清中TC、TG、LDL-C、HDL-C水平的影响mmol/L,,n=10
与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与OKPD低剂量组比较,&P<0.05。
2.2 OKPD 对HLP 小鼠血清中AST、ALT、T-NOS水平的影响 模型组小鼠血清中AST、ALT、T-NOS水平较正常对照组显著升高(P<0.05),与模型组比较,非诺贝特阳性对照组及OKPD高、中剂量组小鼠血清AST、ALT水平显著下降,OKPD各剂量组T-NOS水平显著降低(P<0.05),OKPD高剂量组AST 水平显著低于OKPD 低剂量组(P<0.05),见表2。
表2 OKPD对HLP小鼠血清中ALT、AST、T-NOS水平的影响,n=10
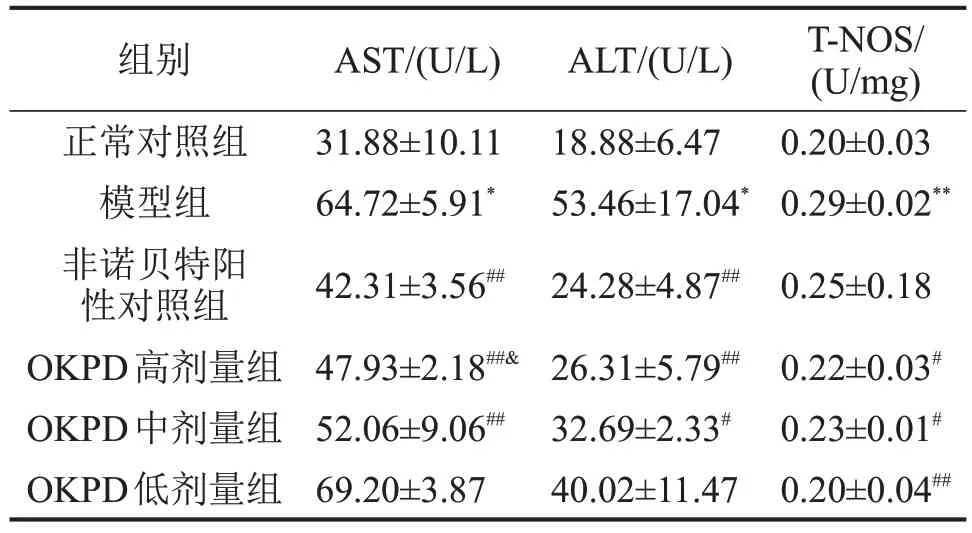
表2 OKPD对HLP小鼠血清中ALT、AST、T-NOS水平的影响,n=10
与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与OKPD低剂量组比较,&P<0.05。
2.3 OKPD对HLP小鼠肝脏病理形态学的影响 光镜下可见,正常对照组小鼠肝细胞结构正常,肝细胞核清晰可见,核大而圆,肝小叶结构完整,清晰,肝索呈放射状分布,肝间质无明显炎症浸润,整体无气球样变、点状坏死及灶性坏死,未见病理改变。模型组小鼠肝细胞出现明显肿胀,排列混乱,变形,部分胞质溶解,呈空泡状;肝小叶模糊不清,肝细胞核浓缩变小,呈点状坏死;肝细胞之间边际不清,中央静脉区和汇管区分布有大量炎性细胞,同时可见明显脂滴。OKPD高、中剂量组肝细胞结构完整、清晰,呈放射状排列,少见肝细胞肿胀、坏死及炎症浸润,OKPD低剂量组肝细胞虽较模型组有所改善,但依然可见肝细胞排序混乱、变形,肿胀,部分肝细胞呈空泡样,见图1。

图1 小鼠肝脏组织HE染色图(×200)
2.4 各组小鼠肝组织NF-κB、TNF-α 及IL-6 蛋白表达比较 NF-κB、TNF-α、IL-6 阳性表达分别定位于肝细胞膜、细胞质和细胞膜、细胞膜和细胞间隙中。与正常对照组比较,模型组肝组织NF-κB、TNF-α及IL-6蛋白表达明显升高(P<0.01);非诺贝特阳性对照组及OKPD各剂量组肝组织NF-κB、TNF-α及IL-6 蛋白表达较模型组明显降低(P<0.01),见图2、图3。OKPD高、中、低剂量组之间比较,差异无统计学意义(均P>0.05)。

图2 肝组织NF-κB、TNF-α及IL-6蛋白表达的免疫组化染色图(×400)

图3 6组小鼠肝组织NF-κB、TNF-α、IL-6蛋白表达比较
3 讨论
Triton WR-1339,又称四酚丁醛,是一种非离子型表面活性剂,现常作为实验性HLP 的诱导剂,广泛应用于降脂药物的筛选。Triton WR-1339通过抑制脂蛋白脂肪酶的活性,可在短时间内引起机体血清TC及TG异常,具有操作简便,迅速的优点[10]。文献报道Triton WR-1339 诱导HLP 模型受剂量及造模时间的影响[11]。综合文献的研究报道及预实验的结果,本研究的造模方案为一次性腹腔注射600 mg/kg Triton WR-1339,造模时间为24 h。
HLP 时机体内脂类物质发生显著改变,TC、TG、LDL-C 水平异常升高,HDL-C 水平异常降低,以上指标常作为评价HLP 的“金标准”。在诸多危险因素中,LDL-C 的升高被认为是最危险的因素。LDL-C 积蓄于血管内皮上,在氧化因子的作用下,进一步氧化形成氧化型LDL(ox-LDL)。ox-LDL可触发血管内皮上的系列炎症反应及细胞凋亡,加重机体的炎症状态[12]。因此,LDL-C 升高被认为是不利因素。而HDL-C 则与之相反,在HLP 时,其呈现低表达状态,被认为是有利因素。肝脏、小肠等机体多数器官参与TG 的合成与代谢,其中以肝脏合成能力最强。因此,通过检测肝脏功能了解HLP的进程是必要的。Triton WR-1339 作为化学物质,可增加肝细胞膜的通透性,使得肝细胞内重要的酶如ALT、AST外漏。同时,异常升高的脂质可反向加重肝脏的脂代谢负担,进一步加剧肝脏细胞的损伤,阻碍脂代谢。二者相互作用,使得HLP和肝损伤恶性循环。本研究发现,经Triton WR-1339 诱导的小鼠血清ALT及AST水平较正常对照组升高,表明在HLP 发生的同时伴随着肝脏的损害。而OKPD 给药组小鼠血清ALT、AST 水平较模型组显著降低,说明OKPD 具有护肝的功效。以上结果提示,在降脂药的研发过程及在临床工作中,应该关注HLP引发或合并肝脏损害的情况,以便更好地指导临床工作。
炎症反应是机体抵御外界有害物质侵入机体的常见病理过程,控制炎症对于维持机体的正常代谢功能及抑制疾病的进展具有重要意义。研究表明,TNF-α 的激活与肝脏病变存在密切联系。NFκB 是炎症反应、免疫调节等过程的重要介质,是调节细胞增殖、凋亡过程的重要因子。促炎因子的激活导致炎症因子如NF-κB及其下游因子的释放,引发机体炎症级联反应[13]。TNF-α是由多种细胞产生的中枢炎症促进细胞因子,是控制炎症过程的关键。IL-6主要由巨噬细胞、T淋巴细胞、B淋巴细胞产生,具有多种复杂生理功能,在机体发生炎症反应或感染时,TNF-α 等多种细胞因子可诱导机体产生IL-6[14]。当上游刺激因子如TNF-α被激活时,IκB发生磷酸化反应,激活NF-κB。活化的NF-κB 因子核定位序列被暴露,转录到核内特定位点,启动基因转录程序,产生或激活下游的其他因子。下游其他因子又可以反向激活NF-κB因子,形成反馈调节模式,从而使炎症级联反应扩大,加剧疾病的进展。Triton WR-1339诱导剂作为外源性物质注射到小鼠体内,激活TNF-α、IL-6等促炎因子及NF-κB炎症因子。因此,有效抑制TNF-α、IL-6、NF-κB 的活化可以有效抑制机体的炎症反应,进而缓解疾病的进展。本研究中,模型组小鼠肝索周围可见大量炎症细胞侵润,肝细胞变性、坏死,OKPD 高、中、低剂量组少见炎症细胞侵润;免疫组化结果显示,模型组小鼠肝组织NF-κB、TNF-α、IL-6蛋白表达较正常对照组明显升高,而OKPD 给药组较模型组明显降低。提示OKPD 能有效抑制HLP 小鼠肝组织炎症反应。
综上,OKPD通过抑制TNF-α、NF-κB、IL-6等炎症因子的释放,调节血脂,对实验性高血脂症小鼠发挥保护肝脏的作用。
