TMPRSS11B在口腔鳞状细胞癌中的表达及其临床意义*
2021-12-20李丹苹莫颖禧韩培培李丽媚张海山
李丹苹,莫颖禧,吴 姝,韩培培,李丽媚,赵 军,张海山,李 萍
[1.广西医科大学附属口腔医院,南宁 530021;2.广西口腔颌面修复与重建研究自治区级重点实验室,南宁 530021;3.广西颅颌面畸形临床医学研究中心,南宁 530021;4.颌面外科疾病诊治研究重点实验室(广西高校重点实验室),南宁 530021;5.广西壮族自治区卫生健康委员会口腔感染性疾病防治重点实验室,南宁 530021;6.广西医科大学附属肿瘤医院,南宁 530021;7.广西医科大学第一附属医院,南宁 530021]
口腔癌是多见的头颈部肿瘤,侵袭性高,易于复发和转移,临床上以口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)最为多发,占其发病率的90%。OSCC 通常发生在舌前2/3、牙龈、口腔底部、唇颊黏膜、牙槽嵴、硬腭以及磨牙后三角区[1]。尽管手术、化疗、放疗、造血细胞移植和靶向治疗已经取得良好的效果[2],但肿瘤侵袭、颌面部破坏、颈部淋巴结转移和血源性传播,仍使OSCC 成为一种致命的畸形性疾病[3]。因此,寻找有效的OSCC 诊断和预后的生物标志物,探究存在的信号通路及可能机制,能大幅提升OSCC患者的预后和生活质量。Ⅱ型跨膜丝氨酸蛋白酶(TypeⅡtransmembrane serine protease,TTSP)家族是本世纪初新揭示的一种蛋白酶家族[4],早期研究表明,TTSPs在上皮组织中广泛表达[5],并在上皮分化、铁代谢等多种生理过程中起关键作用[6]。近年来有关TTSPs致癌作用的研究不断进展,已证明TTSPs 参与了上皮癌变,与癌症复发、远处转移和死亡率密切相关[7],还具有靶向治疗癌症的潜力[8-10]。跨膜丝氨酸蛋白酶11B(transmembrane serine protease 11B,TMPRSS11B)属于TTSP 家族。TMPRSS11B 蛋白由一个跨膜结构域和一个丝氨酸蛋白酶结构域组成,具有催化三联体及结合底物的残基。主要位于上皮细胞表面,在子宫颈癌、食道癌和头颈癌中明显下调[11]。有研究表明,TMPRSS11B 可能在调节肿瘤进展上发挥作用[12]。然而,TMPRSS11B 在OSCC 中的研究甚少,为探究与OSCC 发生、发展相关的分子生物学标志物,本文重点探索了TMPRSS11B 基因在OSCC 中的表达变化,及其与OSCC 患者临床病理指标的相关性。
1 资料与方法
1.1 TCGA 数据库 从癌症基因组学数据分析平台(UCSC Xena,http://xena.ucsc.edu/)中检索并下载头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,HNSC) 的TCGA数据集,包括mRNA信息和相应的临床参数。筛选出牙槽嵴、颊粘膜、口底、舌、唇和硬腭等口腔各部位的数据[13],并剔除掉mRNA表达及临床参数不完全的数据,分析TMPRSS11B在OSCC 患者组织和口腔正常组织中的转录水平。
1.2 生存分析和诊断价值分析 提取TCGA 样本中OSCC 患者的生存数据,以TMPRSS11BmRNA水平的中位数作为截断值。将OSCC 患者分为两组,TMPRSS11B 高表达组和低表达组,以OSCC 所致死亡作为所有患者的预后标准,利用Kaplan-Meier 法作生存曲线,分析两个分组的患者的生存率;采取受试者工作特征曲线(receiver operating characteristic curve,ROC)来判断TMPRSS11B 诊断OSCC的敏感性和特异性;采用曲线下面积(area under the curve,AUC) 分 析TMPRSS11B 的 诊 断 价值;采用约登指数确定TMPRSS11B的最佳临界值。
1.3 GeneMANIA预测TMPRSS11B互作基因
Gene MANIA数据库是一个通过大量基因组学和蛋白组学数据找到功能相似的基因的网站[14]。在其主页(http://genemania.org)搜索TMPRSS11B,定义物种为人,并根据基因间的现有的相互作用找到可能相同功能的基因,从而绘制出TMPRSS11B 的互作基因网络。
1.4 GO 功能注释和KEGG 通路富集分析 打开DAVID 数据库[the database for annotation,visualization and integrated discovery (https://david.ncifcrf.gov/)]对TMPRSS11B 进行GO(gene ontology,GO)功能注释和KEGG(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.5 细胞和组织 人口腔上皮细胞(HOEC细胞)、口腔癌细胞株(CAL27、SAS 细胞)均购于上海雅吉生物科技有限公司。收集2020年6~12月广西医科大学口腔医学院病理科55 例OSCC 组织及配对的相邻非癌组织石蜡块(距离肿瘤边缘至少5 cm处)。其中男19 例,女36 例,年龄27~91 岁,平均58 岁。病例纳入标准:(1)经两位高水平病理医师诊断为口腔鳞状细胞癌的患者;(2)术前未受任何放、化疗、免疫疗法或靶药疗法的患者;(3)临床材料完备的患者。排除标准:(1)拒绝参加实验的患者;(2)有其他恶性肿瘤或全身性疾病的患者;(3)病理诊断不明晰的患者。本研究已获广西医科大学附属口腔医院医学伦理委员会伦理审批(批号:2021028),并得到所有招募患者的知情同意。
1.6 试剂 Gibco 培养基、10%胎牛血清和100 U青霉素/链霉素,DEPC-Treated Water、Trizol 试剂、PowerUP SYBER Green Master MIX和TMPRSS11B多克隆抗体(货号:PA5-31481)购于赛默飞公司(美国)。逆转录试剂盒The TransScript one-step gDNA Removal and cDNA Synthesis superMix 购于北京全式生物科技有限公司。PV-6000免疫组化通用型试剂盒、EDTA(pH=9)抗原修复液、DAB 显色试剂盒和碳酸锂饱和溶液均购于北京中杉金桥生物技术有限公司。
1.7 细胞培养 HOEC 细胞使用DMEM 培养基培养,SAS、CAL27用DMEM-F12培养,配置10%浓度的胎牛血清和1%浓度的青霉素/链霉素,将细胞放至培养箱内培养,温度为37 ℃,CO2体积为5%,湿度为饱和湿度。
1.8 实时荧光定量聚合酶链反应(RT-qPCR)
HOEC、CAL27、SAS 细胞RNA 由TRIzol 提取,后将其逆转为互补DNA(cDNA)。RT-qPCR 采用StepOnePlus™实时荧光定量PCR 仪(美国赛默飞公司)进行。使用SYBER Green 试剂盒进行qRTPCR。反应体系总体积为20µL[10 ulSYBER Green(2×),7 µL DEPC 水,1 µL cDNA,1 µL 上游引物,1µL 下游引物]。引物序列为:TMPRSS11B:正向:5'-GTAAGCTGGGGTGATGGATGT-3',反 向:5'-ATCCTTATCTGTGGCTTTGGGA-3'。GAPDH:正向:5'-GCTCAGACACCATGGGGAAG-3',反向:5'-CCC-CTTCATTGACCTCAACTACA-3'。反应条件为,98 ℃预变性30 s,1 轮循环。98 ℃15 s,65 ℃60 s,72 ℃90 s 40轮循环。内参标准是GAPDH,每个样品提供3 个复孔,实验重复3 次。基因相对表达水平算法为2-ΔΔCt方法。
1.9 免疫组织化学(IHC)染色 组织石蜡块切片,厚4µm。将切片置于二甲苯中脱蜡,再于梯度酒精(100%,95%,85%和75%)中水化。采用EDTA修复液(pH=9)在高压锅修复5 min,常温至彻底冷却。之后使用内源性过氧化物酶阻断剂孵育10 min。滴加TMPRSS11B抗体(1∶250),孵育一夜。次日采用酶标山羊抗小鼠/兔IgG孵育20 min。现配DAB,尔后滴加染色。在苏木精中染色30 s,并在0.5%的盐酸中分化,在碳酸锂中反蓝。在梯度酒精(75%,85%和95%)中脱水。在二甲苯中透明,用中性树脂封片,光学显微镜下观察。实验均设置阳性对照和阴性对照。IHC片由2名病理医师单独打分。评分标准根据阳性细胞染色程度和染色面积对TMPRSS11B 蛋白的表达做半定量分析。先通过低倍镜(×100)寻找OSCC细胞和(或)正常口腔鳞状上皮细胞,然后换成高倍镜(×400)。打分者挑取10个视野,在每一视野下观察100 个完整OSCC 细胞和/或正常口腔鳞状上皮细胞。无阳性着色计0 分,着色强度呈浅黄色计1 分,棕黄色计2 分,棕褐色计3分。阳性细胞百分比<10%判0 分;10%~40%判1分;>40%~70%判2 分;≥70%判3 分。两标准得分的乘积作为TMPRSS11B 最末分。评分<3 分为低表达,≥3分为高表达。
1.10 统计学方法 采用SPSS 25.0 进行数据分析。计量资料采用均数±标准差()表示,两组比较采用独立样本t检验,配对样本采取配对样本t检验。计数资料以百分率(%)表示,组间比较采用χ²检验。采用Kaplan-Meier 检验法进行生存分析,采用AUC 判评TMPRSS11B 的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 TMPRSS11B在OSCC组织中mRNA水平
从TCGA数据库中筛选出287例口腔癌标本和31 例正常口腔标本。与正常口腔组织相比,TMPRSS11B 在OSCC 组织的mRNA 水平明显下调(t=7.058,P<0.05),见图1。

图1 TCGA 数据库中OSCC 组织TMPRSS11B mRNA 水平下调
2.2 Kaplan-Meier 曲 线分析TMPRSS11B 在OSCC中的预后价值 生存分析结果显示,TMPRSS11B转录水平与OSCC 预后相关,与TMPRSS11B 高表达组相比,低表达组患者总生存率较低(P<0.05),见图2。

图2 TMPRSS11B低表达组的OSCC患者预后不良
2.3 TMPRSS11B的mRNA水平对OSCC的诊断价值 基于287例OSCC组织与31例正常口腔组织的mRNA水平,检测出TMPRSS11B mRNA的AUC为0.793(95%CI:0.697~0.889,P<0.05),提示TMPRSS11B 可能作为OSCC 的诊断指标(P<0.05),见图3。此外,TMPRSS11B的灵敏度为94.5%,特异度为59.4%,其最佳临界值(AUC)为0.716。
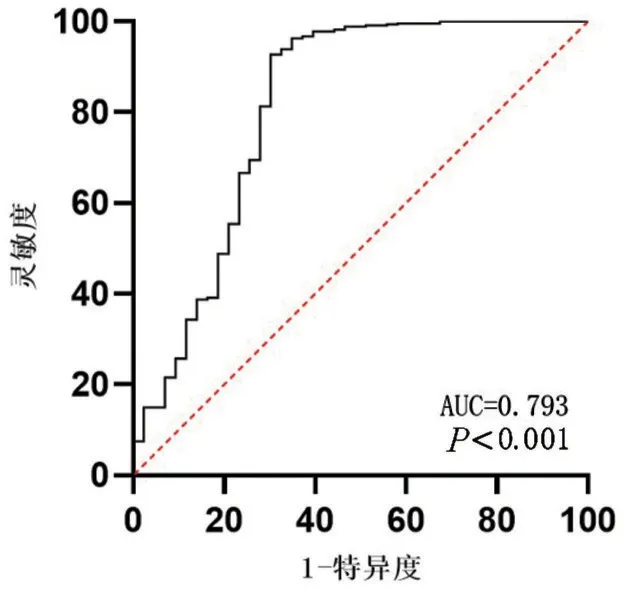
图3 OSCC中TMPRSS11B的转录水平的ROC曲线
2.4 TMPRSS11B 的互作基因及其GO 分析和KEGG 通路分析 TMPRSS11B 的相关基因网络以TMPRSS11B为中心点,多个互作基因呈扇形展开,基因节点的大小与互作强度呈正比,TMPRSS11B的互作基因根据互作强度由强到弱顺序分别为
TMPRSS11E、KIF9、TMPRSS11D、LHFPL1、KLK13、COX7B2、SERPINB13、LDHAL6B、RHOV、1-Dec、CRISP3、TAS2R7、USP26、PRSS27、HERC3、MYOCD、IFNB1、OR2L13、HS3ST2、SCEL,见图4。
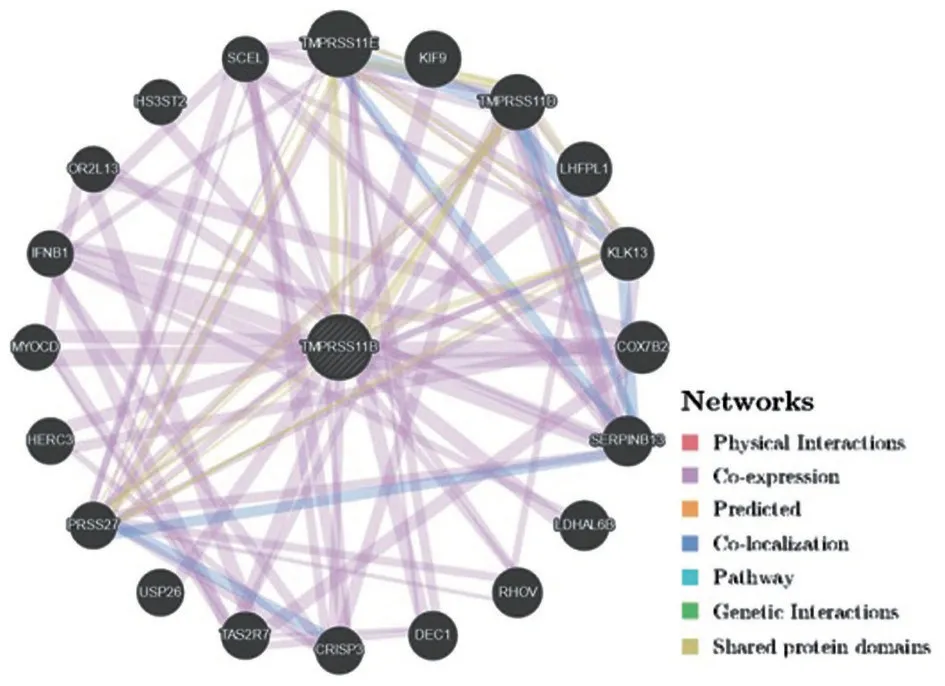
图4 GeneMANIA 数据库预测TMPRSS11B 的基因互作网络图
GO分析显示,TMPRSS11B及其相互作用基因的生物过程主要涉及角化细胞分化、角质化和多肽交联等11个方面(P<0.05),细胞成分集中在胞外外泌体、角化包膜、细胞间黏附连接等15项(P<0.05),分子功能集中在结构分子活性、钙离子结合和钙粘蛋白结合参与细胞—细胞黏附等8 项(P<0.05),见图5。
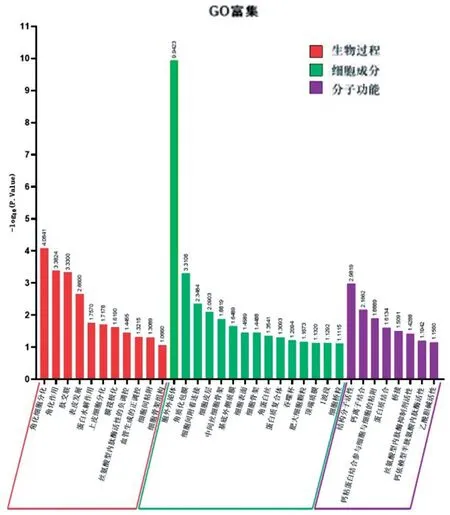
图5 TMPRSS11B互作基因的GO分析
KEGG 通路分析发现,与TMPRSS11B 共表达基因密切相关的通路为代谢途径、花生四烯酸代谢、PPAR信号通路、细胞色P45代谢、AMPK信号通路和轴突导向等,见图6。
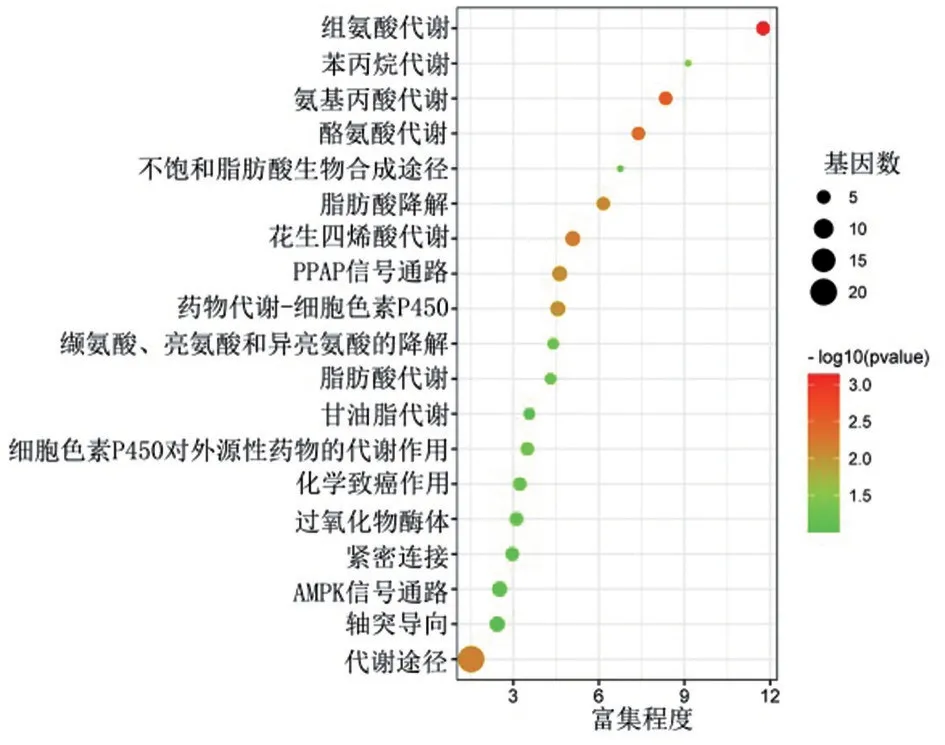
图6 TMPRSS11B互作基因的KEGG通路分析
2.5 RT-qPCR法检测TMPRSS11B在口腔癌细胞中的mRNA 水平 口腔癌细胞株(CAL27、SAS)中的TMPRSS11B 的mRNA 水平较正常口腔上皮细胞HOEC明显降低(P<0.05),见图7。
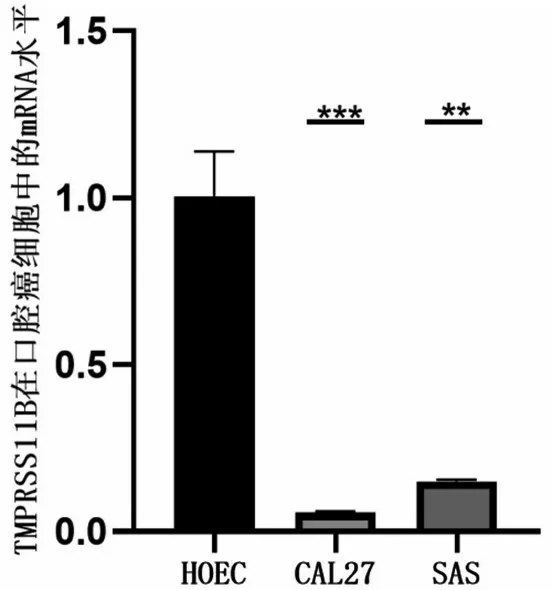
图7 OSCC细胞中TMPRSS11B的mRNA水平降低
2.6 IHC染色法分析TMPRSS11B蛋白在OSCC中的表达情况 IHC 结果显示,OSCC 组织中TMPRSS11B 蛋白的染色强度和阳性染色面积的乘积低于相应的癌旁组织(P<0.0001))(表1),IHC评分如图8A 所示。TMPRSS11B 蛋白免疫组化染色主要见于细胞质,在正常口腔上皮各层表达明显,多呈深黄或黄棕色着色,在基底层和棘层着色尤深。这与在OSCC 细胞中呈鲜明对比,后者着色率较之少,且多呈淡黄色或无着色(图8B)。
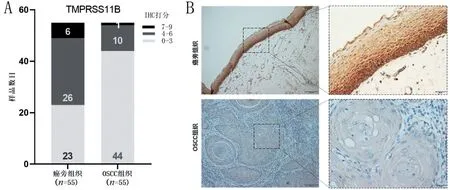
图8 TMPRSS11B蛋白在OSCC中的表达情况
表1 OSCC组织和癌旁组织中TMPRSS11B表达情况

表1 OSCC组织和癌旁组织中TMPRSS11B表达情况
2.7 TMPRSS11B蛋白表达与OSCC临床病理特征的关系 基于IHC 染色评分,将OCSS 患者分为两组,TMPRSS11B 高表达组和TMPRSS11B 低表达组。进一步分析TMPRSS11B蛋白表达水平与临床特点的相关性。结果显示,TMPRSS11B 蛋白表达与OSCC 肿瘤分级相关,且TMPRSS11B 蛋白表达越低,分化趋势越差(P<0.05) ;TMPRSS11B蛋白水平与OSCC 患者的年龄、性别、TMN 分期和肿瘤直径无明显关系(P>0.05),见表2。
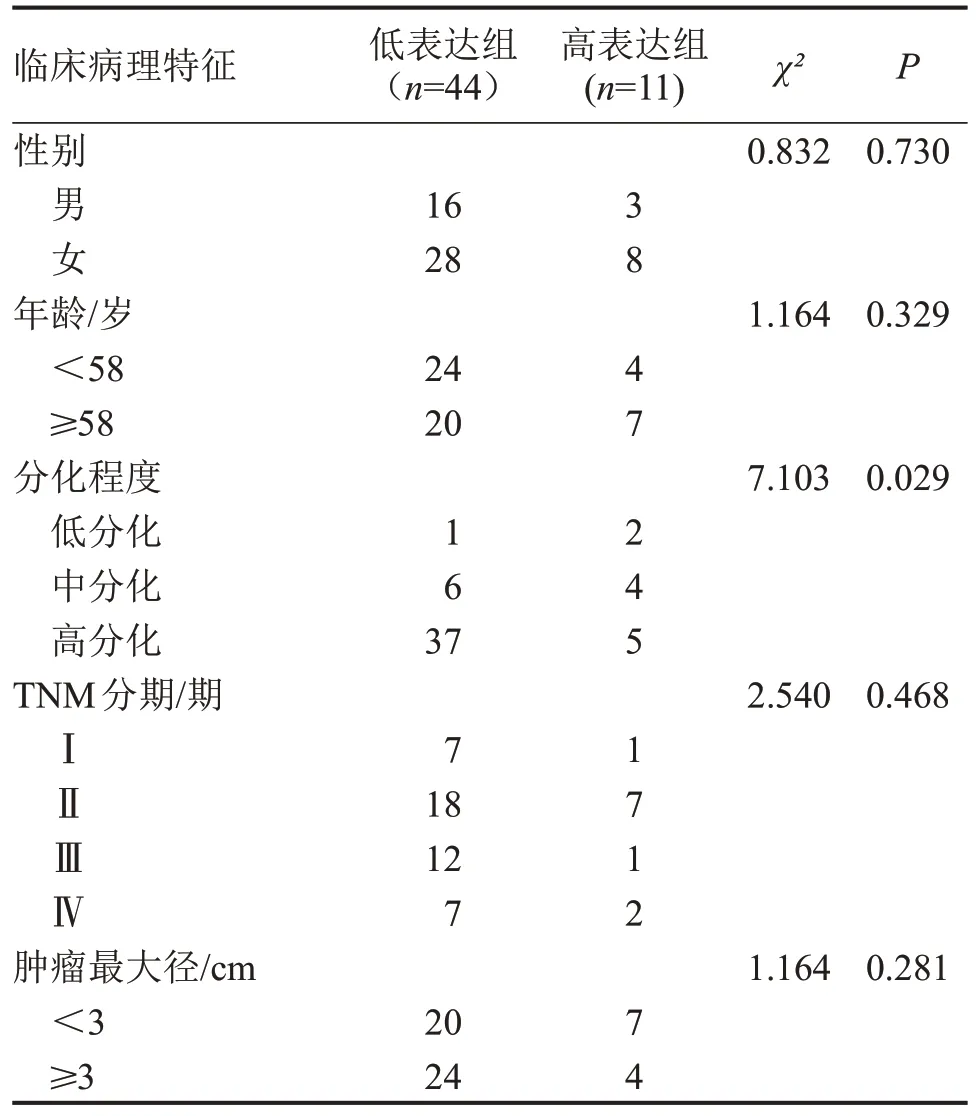
表2 TMPRSS11B与OSCC患者临床病理特征中的关系
3 讨论
OSCC是一种侵袭性肿瘤,初期病灶小,通常无症状,65%的OSCC是在晚期确诊的[15]。OSCC患者的5 年生存率约50%,因为口腔中淋巴管丰富且吻合较多等原因,25%~50%的患者在术后依然复发和远端转移[16]。因此,OSCC 的早期诊断十分重要。此外,传统的手术、放化疗等手段在治疗的同时也给患者的机体功能和颌面部美观带来不可逆转的损害,严重影响患者生活质量,基因靶向治疗的研究由此趋于热门,寻找靶向治疗基因也为OSCC 的治疗开启了新思路[17]。
口腔覆盖的复层鳞状上皮依赖于基底细胞增殖,在向外移动到外表面的过程中,经历复杂的分化过程,产生棘层、颗粒层、角化层,最终脱落[18]。良好的分化是上皮屏障形成的关键,有研究表明,TTSPs 在人类鳞状上皮中过表达,并在上皮屏障形成中诱导细胞分化[19]。Miller等[11]的组织阵列分析显示,TMPRSS11B 在鳞状上皮细胞恶性转化过程中丢失,提示TMPRSS11B 的可能通过参与分化过程调控癌症。本研究结果发现,在OSCC 细胞中TMPRSS11B 的mRNA 水平较正常口腔细胞下调。TMPRSS11B 蛋白在OSCC 组织中低表达,在正常口腔上皮层尤其是基底层和棘层高表达。进一步分析发现TMPRSS11B 蛋白表达与肿瘤分级相关。在低分化的OSCC 组织中,免疫阳性细胞百分比和染色程度较低,提示TMPRSS11B 的丢失可能与口腔鳞状上皮在癌变过程中脱分化有关。
TMPRSS11B 的相关基因网络显示,SERPINB13、USP26 等为TMPRSS11B 的互作基因。已有研究表明,这些TMPRSS11B 互作基因与多种癌症的分化和肿瘤形成相关[20-21]。GO 富集分析示,TMPRSS11B 及其互作基因富集在角化细胞分化,角化作用、上皮细胞分化等生物过程,和胞外外泌体、角质化胞膜等细胞组分上,从而有可能因表达失调影响细胞分化和上皮屏障形成。KEGG通路富集结果示,TMPRSS11B 及其互作基因在OSCC 可能通过代谢途径、花生四烯酸代谢和PPAR 信号通路等分子机制,作用于癌症的临床表现和预后。Updegraff 等[12]曾指出,TMPRSS11B 在肺癌中促进乳酸输出和糖酵解代谢。TMPRSS11B在人肺鳞状细胞癌(human lung squamous cell carcinomas,LSCCs)中上调,并促进肺癌的发生。这与其在鳞状细胞癌中已经过验证的表达下调和的抑癌作用相反[11],也与本研究结果相反,可能是TMPRSS11B 在不同的癌种起着不同的作用。
早期诊断是OSCC有效治疗的关键。在本研究中,根据TCGA数据发现TMPRSS11B的表达与OSCC的预后和诊断有关。但由于本研究进行的试验较少,有一定的局限性,需要更大样本量的临床数据和实验验证才能得出可靠的结论。此外,TMPRSS11B 调控OSCC 发生发展的确切机制尚未被揭示。对TMPRSS11B的进一步研究有助于确定其作为OSCC 恶性肿瘤评估的分子标志物的作用。TMPRSS11B 靶基因的研究可能为OSCC 的治疗开辟新的途径。
