耐辐射芽胞杆菌JK23的鉴定及其生防活性研究
2021-12-17张丽娟热依罕姑丽阿卜杜克依穆布坚乃提阿巴斯
张丽娟,黄 伟,王 宁,宋 博,朱 静,热依罕姑丽·阿卜杜克依穆,布坚乃提·阿巴斯,王 玮*
(1. 新疆农业科学院微生物应用研究所/ 新疆特殊环境微生物实验室, 乌鲁木齐 830091;2.农业部西北荒漠绿洲作物有害生物综合治理重点实验室/特色林果产业国家地方联合工程研究中心/新疆农业科学院植物保护研究所, 乌鲁木齐 830091)
植物病虫害是农业生产和生态环境稳定面临的最主要的威胁。化学农药是目前防治病虫害的主要手段,但是化学农药的长期大量使用带来了耕地生态退化严重、抗药性增加等诸多危害人畜健康问题,生产中亟需对人类和环境友好、防效显著的替代策略,生物防治是目前研究应用的热点。芽胞杆菌因具有超强的生存繁殖能力、丰富的合成代谢产物的能力、易定殖于植物根际且大多对人畜有益的特性,是技术最成熟、开发利用最广泛的生防菌类群,目前应用于生物防治的芽胞杆菌主要有解淀粉芽胞杆菌Bacillus amyloliquefaciens、苏云金芽胞杆菌Bacillus thuringiensis、枯草芽胞杆菌Bacillus subtilis、多粘类芽胞杆菌Panebacillus polymyxa和贝莱斯芽胞杆菌Bacillus velezensis等[1-3]。
芽胞杆菌分泌的抑菌活性物质分为两大类:一类是核糖体途径合成的蛋白类抗菌物质,以酶类、细菌素及其他小分子多肽为主;另一类是非核糖体途径合成的脂肽类化合物及聚酮类化合物。脂肽类抗生素因其结构多样、抗菌谱广、不易产生抗药性,是当前研究开发的热点,主要包括表面活性素(Surfactins)、伊枯草菌素(Iturins)、丰原素(Fengycins)三大环肽家族及杆菌溶素[4]。表面活性素是目前已知的最有效的生物表面活性剂,能够作用于生物膜磷脂双分子层,形成微孔导致细胞内容物外泄,致细胞死亡,有很好的溶血、抗病毒、抗支原体和抗细菌作用,对真菌抑制作用不明显[5]。伊枯草菌素通过改变膜的表面张力,使膜上形成离子通道,导致细胞内K+等离子外泄,胞内离子稳态失衡,影响菌丝生长,具有较强的抑制真菌生长和溶血活性,其中以Iturin A抗真菌活性最好,与常用化学农药杀菌性能相当,是极具开发潜力的生物源农药[6]。丰原素通过破坏细胞膜的结构,使膜丧失半透性,胞内物质外泄细胞死亡,对丝状真菌具有明显的抑制效果,具有较强的表面活性,溶血作用弱于伊枯草菌素和表面活性素[7]。有报道显示表面活性素能增强丰原素和伊枯草菌素对真菌的抑制作用。脂肽类物质除抗菌活性外,还能促进芽胞杆菌在根部定殖,诱导植物系统抗性,显示出极大的生防潜力[8]。
本研究从新疆某放射性污染土壤中分离得到耐辐射芽胞杆菌JK23,能耐受15 Gryγ-辐照。前期试验发现,菌株JK23发酵液乙酸乙酯粗提物能够抑制植物病原真菌孢子萌发,对野生型秀丽线虫成虫具有触杀作用,但是对病原性细菌抑制作用不明显。本研究综合运用形态学、生理生化实验、分子生物学方法对菌株JK23进行了鉴定,以多种植物病原真菌作为靶向菌对该菌的抑菌谱进行测定,同时对该菌合成脂肽类活性物质的能力进行分析,为明确其抑菌活性物质组成及抑菌机理提供理论基础,为生防细菌JK23的开发利用提供理论依据。
1 材料与方法
1.1 供试菌株及主要试剂
供试菌株:拮抗细菌JK23由本单位耐辐射微生物资源库保存;香梨黑斑病菌由新疆农业科学院植物保护研究所分离保存;核桃腐烂病菌、马铃薯早疫病菌、西瓜枯萎病菌、西瓜蔓枯病菌、水稻恶苗病菌、棉花枯萎病菌由中国农业大学赠予(表1)。

表1 试验所用植物病原菌Table 1 Plant pathogens used for tests
培养基:马铃薯葡萄糖琼脂培养基(PDA):马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,蒸馏水定容至1000 mL,自然pH;营养琼脂培养基(Nutrient agar,NA):牛肉膏1.0 g,酵母膏2.0 g,蛋白胨5.0 g,NaCl 5.0 g,琼脂15.0 g,加水定容至1000 mL,pH 7.4;营养肉汤培养基(Nutrient broth,NB):牛肉膏1.0 g,酵母膏2.0 g,蛋白胨5.0 g,NaCl 5.0 g,加水定容至1000 mL,pH 7.4;R2A固体培养基:酵母浸出粉0.5 g,蛋白胨0.5 g,酪蛋白水解物0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,磷酸氢二钾0.3 g,无水硫酸镁0.024 g,丙酮酸钠0.3 g,琼脂15.0 g,pH 7.2;血琼脂平板(青岛日水生物,货号31402)。
供试试剂:GEN III微孔板(美国 Biolog,货号 1030)、细菌基因组提取试剂盒(北京鼎国,货号NEP021-1)、API 20E/50CHB试剂条(法国梅里埃,货号20100,50300)、液体石蜡(国药,分析纯)、苏丹III(Sigma)等相关试剂。
供试仪器:超净工作台(浙江孚夏,型号SW-CJ-1F)、气浴振荡培养箱(上海天呈,型号TS-2102C)、高压蒸汽灭菌锅(上海申安,型号LDZM-60KGS-Ⅲ)、微生物自动鉴定系统(美国Biolog,型号MiroStation)、基质辅助激光解吸电离飞行时间质谱仪(德国布鲁克,型号 Autoflex Speed MALDI-TOF-MS)。
1.2 菌株的鉴定
1.2.1 形态学鉴定 在超净工作台中用无菌接种环挑取20%甘油管-20 ℃冻存菌液,接种于新鲜的50 mL NB培养基,28℃、180 r/min振荡培养48 h后,在NA固体平板上划线培养,28 ℃静置培养,观察菌落形态,挑取菌落进行革兰氏染色。
1.2.2 生理生化特征 菌株的生理生化特性采用API试剂条及Biolog GEN III微孔板测定。用无菌棉签细菌蘸取NA固体平板上培养24 h的菌落参照API 20E、API 50CHB试剂条使用说明制备菌悬液,接种、培养、检测并记录结果[9]。将细菌纯培养物接种于R2A琼脂平板,30 ℃培养24 h。无菌棉签蘸取单菌落,棉签深入含接种液的接种管,上下晃动均匀释放菌体,制备均一菌悬液。将菌悬液倒入V型加样槽,用八道移液器按每孔100 μL的量加入Biolog GEN III微孔板。微孔板在33 ℃培养箱培养,每隔12 h,用BIOLOG微生物自动鉴定系统读板[10]。
1.2.3 分子生物学鉴定 挑取NA固体培养基上的单菌落接种50 mL NB液体培养基,28 ℃、180 r/min培养24 h,10000 r/min离心1 min收集菌体,用细菌基因组提取试剂盒提取基因组。菌株的16S rRNA基因鉴定选择通用引物27F和1492R进行扩增测序,引物序列27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-TACCTTGTTACGACTT-3'。PCR扩增均采用25 μL扩增体系,扩增程序:94 ℃ 4 min;94 ℃30 s,65 ℃ 40 s,72 ℃ 90 s,30 cycles;72 ℃ 10 min。扩增产物用1%琼脂糖凝胶电泳检测,目标条带经切胶回收后委托北京鼎国昌盛生物技术有限责任公司测序。测序结果BLAST进行比对,通过MEGA 7.0软件采用Neighbor-Joining法构建系统发育树,Bootstrap值设为1000。
1.3 抑菌活性测定
将冻存的菌株JK23接种于NA平板,28 ℃培养24 h活化后,通过平板对峙法测定其抑菌活性。具体操作如下:用无菌竹签挑取少量病原真菌菌丝置于 PDA平板中央,拮抗细菌对称接种于平板四周。同时接种只含有病原真菌的PDA平板作为对照,每组试验设计3个重复。接种平板置于28 ℃培养。待对照菌落长满平板时,测量抑菌圈直径。菌丝生长抑制率(%)=(对照菌落直径-对峙板菌落直径)/对照菌落直径×100。
1.4 菌株JK23脂肽类化合物相关基因分析
贝莱斯芽胞杆菌产生脂肽类抗生素是通过非核糖体合成途径完成,其合成基因是以基因簇的形式分布在基因组中,分别为srfABCD、fenABCDE、ituCBAD。参照邓建良等[11]的方法,以菌株JK23的基因组DNA为模板,分别用7对引物扩增脂肽类抗生素合成相关的基因fenB、fenD、ituA、ituD、srfAB、bamC、mycB,采用25 μL PCR体系,扩引物序列见表2,根据引物退火温度和扩增片段大小设计PCR扩增程序[11-14]。引物合成及基因测序委托生工生物工程(上海)股份有限公司进行,利用NCBI网站的BLAST功能对所测序列进行同源性分析。

表2 基因扩增用到的引物Table 2 Primers for PCR amplification
1.5 脂肽类化合物鉴定
1.5.1 血平板及排油活性检测 将经NA固体平板活化后的菌株JK23转接于血琼脂平板,28 ℃下培养48 h观察菌落周围有无溶血现象[15]。活化后菌株接种NB液体培养基,28 ℃、180 r/min振荡培养48 h,10000 r/min离心1 min获得发酵上清液。取60 mL无菌水加入直径9 cm培养皿中,于表面加入5 mL液体石蜡(含0.5%苏丹Ⅲ),形成油膜后加入0.2 mL发酵液上清,观察是否形成排油圈[16]。
1.5.2 基质辅助激光解吸电离飞行时间质谱分析 参照李兴玉等[17]方法,用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)对脂肽类物质进行快速检测:基质工作液为α-氰-4-羟肉桂酸饱和溶液,提取液为70%乙腈(0.1% TFA)。将菌株JK23划线于NA平板上,挑取1个菌落均匀置于靶板上,依次覆盖1 μL提取液、1 μL基质工作液混匀,自然风干,置于仪器离子源进行测定。确定仪器真空度为10-7mbar 或无,开始样品分析时先进行分子量校正,使用337 nm氮激光源解吸附和电离,质量扫描范围为500~2000 Da。
2 结果与分析
2.1 菌株JK23的分类鉴定
2.1.1 形态学特征和生理生化特征 菌株JK23在NA固体平板上30 ℃培养24 h后,形成直径3~6 mm不规则圆形菌落,乳白色不透明,干燥,表面褶皱,边缘锯齿状(图 1A)。菌株染色革兰氏阳性,菌体形态呈短杆状,菌体大小(0.5~0.8)μm×(1.5~2.0)μm,芽胞位于菌体中心或偏中心,大小约为(0.5~0.8)μm×(1.0~1.5)μm(图1 B)。
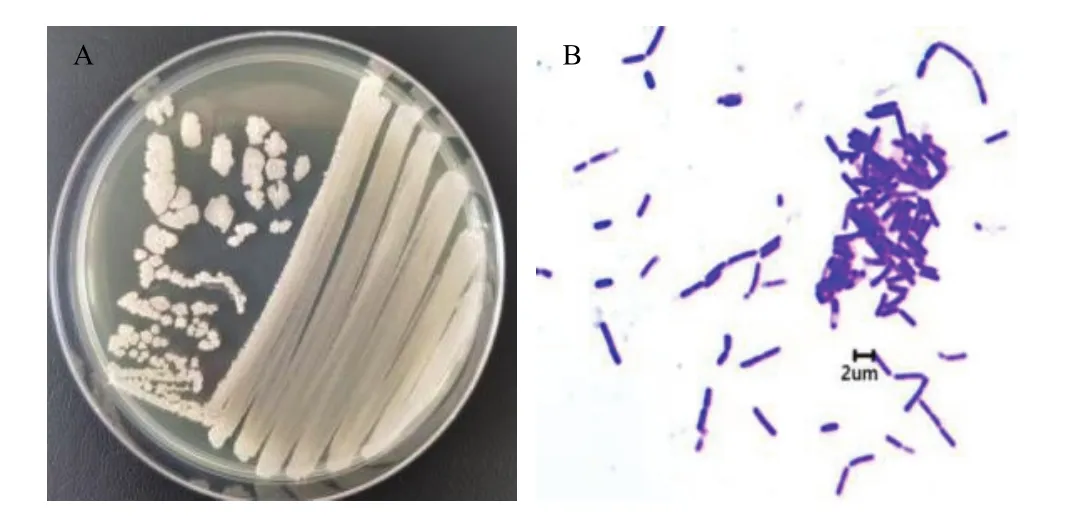
图1 菌株JK23形态学特征的菌落图(A)和菌体图(B)Fig. 1 Colony diagram and body diagram (B) of the morphological characteristics of strain JK23
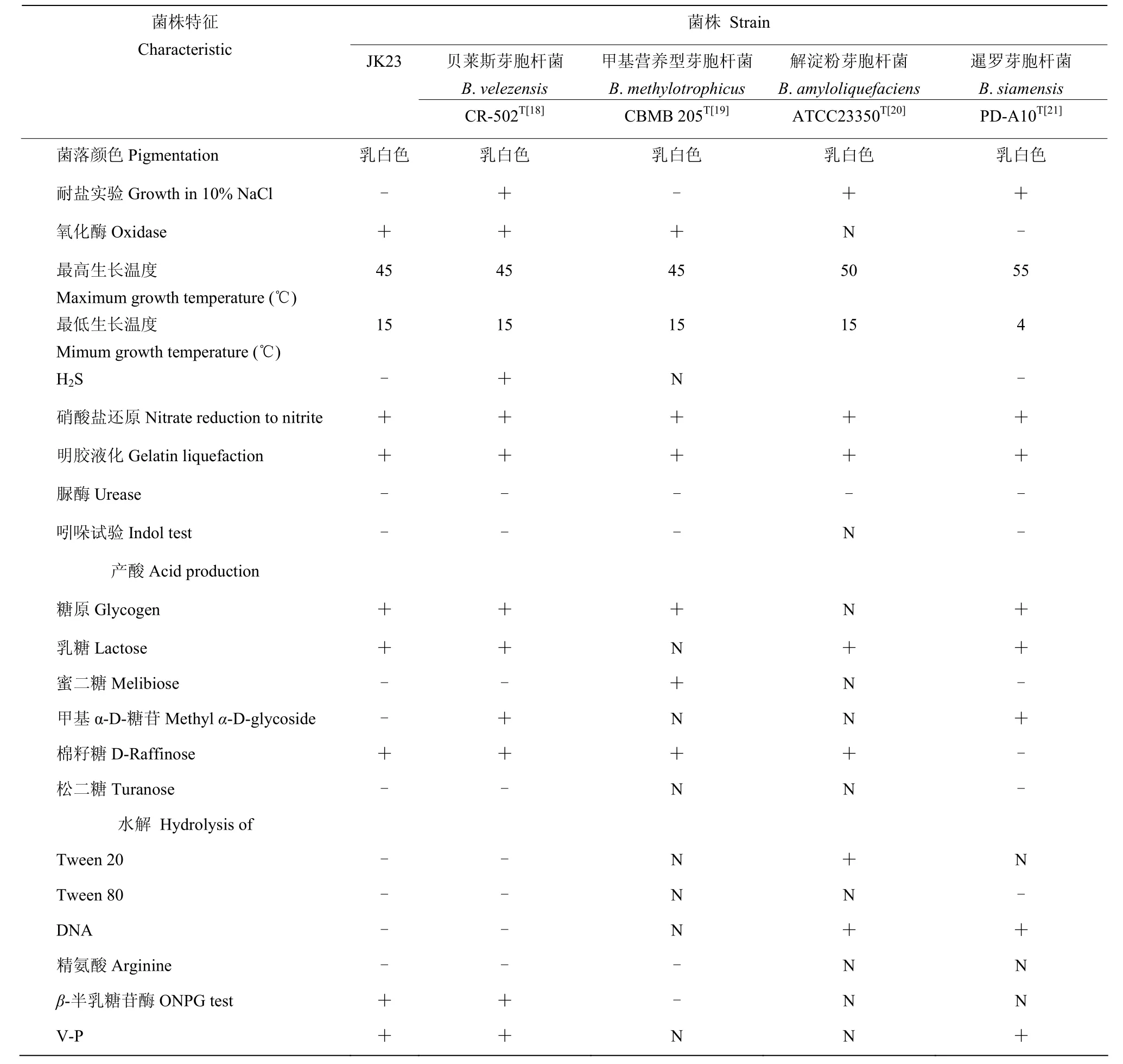
表3 菌株JK23及相关芽胞杆菌的生理生化特征Table 3 Physiological and biochemical characteristics of strain JK23 and some related species of the genus Bacillus
利用Biolog GEN III微孔板进行94种表型测试,其中包括71种碳源测试以及23种化学敏感性测试。将微生物在测试板上显示出的“表型指纹”同Biolog数据库中的数据进行比较,可用于种水平上鉴定。鉴定结果显示,JK23与解淀粉芽胞杆菌同源性最近,SIM 值为 0.539。JK23可以利用糊精、D-麦芽糖、D-海藻糖等47种碳源。耐受pH 5.0、8% NaCl,对梭链孢酸、D-丝氨酸、醋竹桃霉素、利福霉素SV、二甲胺四环素、林肯霉素、硫酸四癸钠、万古霉素、四唑紫、四唑蓝、萘啶酮酸、氨曲南敏感。
API生理生化试验结果表明,菌株 JK23氧化酶反应、硝酸盐还原反应、明胶液化、β-半乳糖苷酶及V-P反应均为阳性,脲酶、吲哚试验、H2S试验均为阴性,可以利用糖原、乳糖、棉籽糖。
参照《常见细菌系统鉴定手册》,综合菌株JK23的形态特征和生理生化特征,初步确定菌株JK23为芽胞杆菌属菌株。
2.1.2 分子鉴定 经测序分析,菌株JK23的16S rDNA序列大小为1424 bp(Genbank序列号MN847602.1),在NCBI数据库中进行BLAST比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),与多株贝莱斯芽胞杆菌、解淀粉芽胞杆菌、枯草芽胞杆菌菌株的序列相似性均达到99%以上。选取同源性较高的标准菌株序列构建系统发育树,菌株JK23与贝莱斯芽胞杆菌CR-502位于同一分支(图2)。基于形态观察、生理生化检测和分子鉴定的结果,将菌株JK23鉴定为贝莱斯芽胞杆菌。

图2 基于16S rDNA序列的菌株JK23的系统发育进化树Fig. 2 Phylogenetic tree of strain JK23 based on 16s rDNA sequence cluster analysis
2.2 菌株JK23的抑菌谱测定
通过平板对峙试验,菌株JK23对下列植物病原菌的抑菌率分别为:香梨黑斑病菌(39.68%)、西瓜枯萎病菌(37.5%)、水稻恶苗病菌(50.0%)、棉花枯萎病菌(53.85%)、番茄早疫病菌(60.7%)、马铃薯早疫病菌(73.3%)、西瓜蔓枯病菌(100%),核桃腐烂病菌(100%)。几乎完全抑制核桃腐烂病、西瓜蔓枯病病原菌的生长(图3)。重复试验及数次传代后仍能得到稳定的抑菌结果,可见菌株JK23具有稳定、广谱的抑菌效果。

图3 菌株JK23对供试植物病原菌的抑制效果(PDA培养基7 d,A:对照组;B:处理组)Fig. 3 Antagonistic effects of strain JK23 against different phytopathogens (PDA medium for 7 d, A: contrast; B: treatment )
与正常生长的菌丝相比,处理组 PDA培养基内抑菌圈周围的菌丝生长缓慢,抑菌圈边界明显,显微镜下可见:基内菌丝顶端膨大、弯曲、畸形,原生质凝聚,菌丝生长受到明显抑制(图4)。
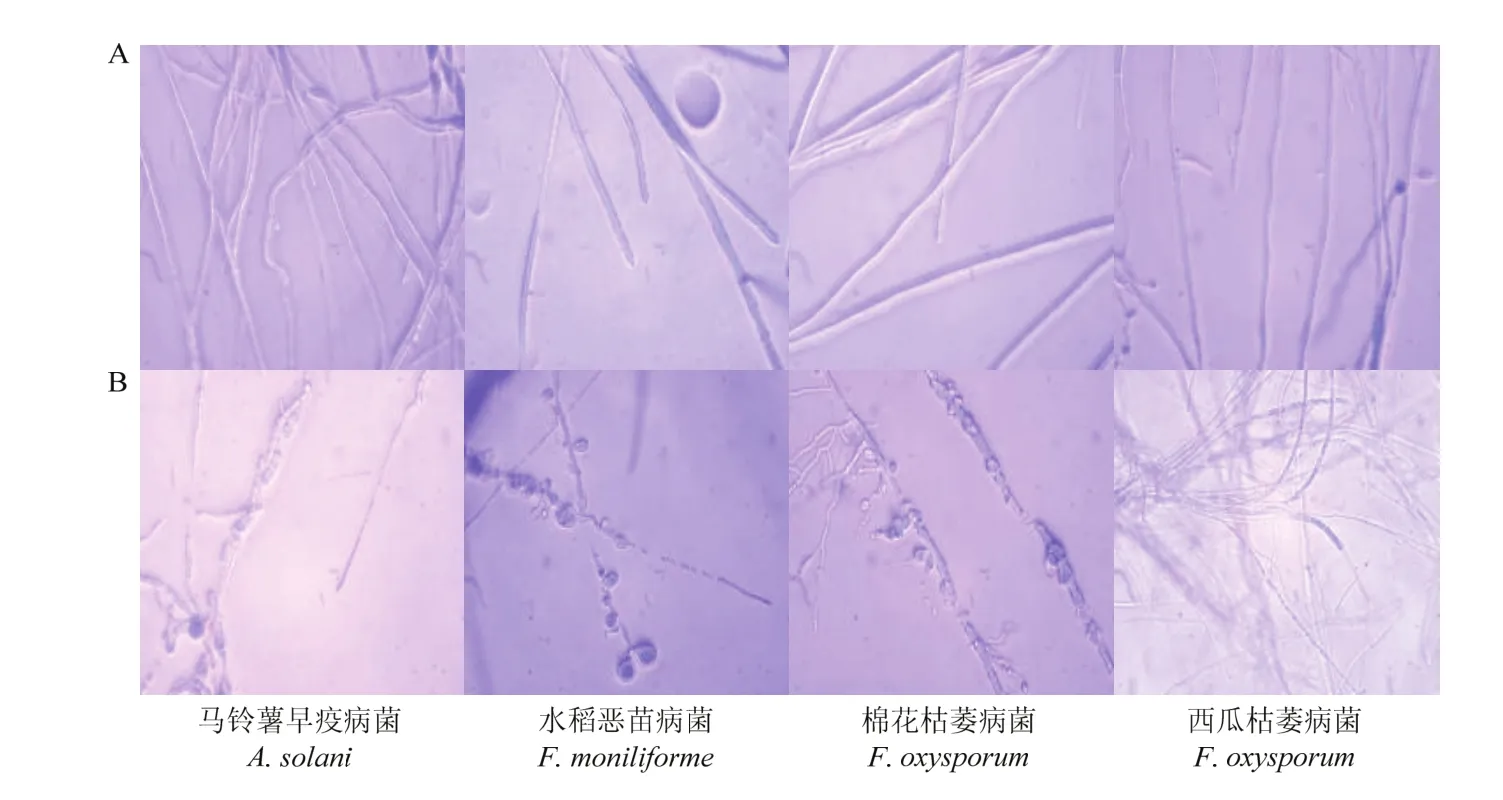
图4 菌株JK23对供试植物病原菌的菌丝致畸作用(10×40倍;A:对照组;B:处理组)Fig. 4 Inhibition effects of B. velezensis strain JK23 on mycelial growth of different phytopathogens (magnification times 10×40,A: contrast; B: treatment )
2.3 菌株JK23 脂肽类化合物相关基因检测
经过PCR扩增,菌株JK23基因组上检测到参与脂肽类抗生素合成的6个基因ituA(1030 bp)、ituD(615 bp)、bamC(733 bp)、fenD(285 bp)、srfAB(280 bp)、mycB(1166 bp),未检测到fenB基因(表4)。

表4 PCR产物序列比对结果Table 4 Alignment results of PCR products
2.4 脂肽类化合物分析
菌株JK23能产生明显的溶血圈和排油圈(图5),表明该菌具有较强的生成脂肽的能力。
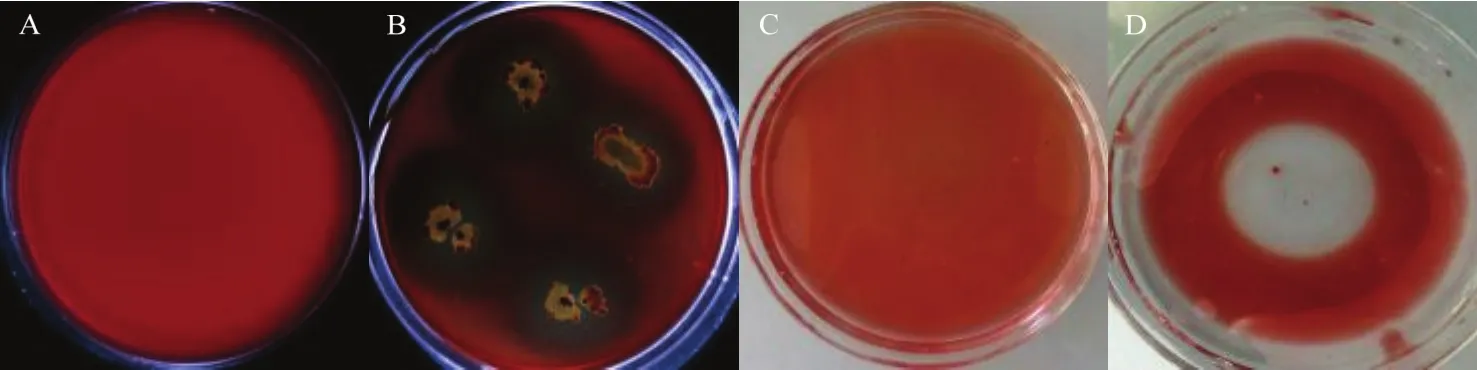
图5 菌株JK23的溶血圈和排油圈检测结果Fig. 5 Results of hemolysis and oil spreading
芽胞杆菌产生的脂肽类抗生素主要有伊枯草菌素、丰原素和表面活性素,根据氨基酸及C链的长短不同存在多个同系物。伊枯草菌素和表面活性素同系物的分子量分布1000~1100 Da,丰原素同系物的分子量分布在1400~1500 Da。对MALDI-TOF MS检测得到的分子量比对分析发现,菌株JK23产物在此分子量区间主要有8个质谱峰,质核比(m/z)分别为1044.9、1058.9、1066.8、1074.9、1080.9、1096.8、1102.9、1118.8,峰的分布规律符合脂肽化合物的质谱峰规律(如1044.9和1058.9分子量相差14 Da,即一个亚甲基(-CH2-),为Iturin的同系物)[22]。根据文献报道,1058.9、1080.9、1096.8分别对应C15 Iturin的M+H+(分子量1058.4)、M+Na+(分子量1080.4)和M+K+(分子量1096.4),或者对应C16 Bacillomycin D的M+H+(分子量1059.4)、M+Na+(分子量1081.4)和M+K+(分子量1097.4);1044.9、1066.8分别对应C14 Iturin的M+H+(分子量1044.4)、M+Na+(分子量1066.4);1058.9、1074.9可能与已报道的C15 Surfactin的M+Na+(分子量1058.4)和M+K+(分子量1074.4)相对应;1102.9、1118.8未在已报道的脂肽化合物中未找到对应的分子量,可能是新的脂肽同系物[22]。质谱结果表明,菌株JK23产物中含有多种脂肽产物,可能为C15 Iturin、C14 Iturin、C16 Bacillomycin D、C15 Surfactin及其他[23,24]。

图6 JK23脂肽化合物的飞行时间质谱分析Fig. 6 MS chromatograms of lipopeptides from JK23 by whole cell in situ MALDI-TOF-MS
3 讨论
贝莱斯芽胞杆菌作为一种新型的生防芽胞杆菌,广泛存在于水、土壤等自然环境中,近年来广泛报道应用于作物的生物防治[25]。李生樟等[26]发现贝莱斯芽胞杆菌504能够特异性拮抗水稻白叶枯病病原菌(黄单胞菌)。Kaki等[27]发现金盏花内生贝莱斯芽胞杆菌对尖孢镰孢菌和葡萄孢菌有较好抑制作用(>60%)。贝莱斯芽胞杆菌HN-2对黄单胞菌、芒果炭疽病菌有明显抑制作用[28,29]。本研究经过系统的形态学、生理生化特征和分子生物学鉴定分析,将耐辐射菌 JK23鉴定为贝莱斯芽胞杆菌,并发现该菌对多种植物病原菌均有较好的抑制作用,尤其对核桃腐烂病菌、西瓜蔓枯病菌几乎完全抑制,且具有稳定、广谱的抑菌效果,与前人报道一致。
脂肽类抗生素是目前贝莱斯芽胞杆菌主要开发的抗菌物质之一,主要包括表面活性素、伊枯草菌素、丰原素三大环肽家族。Chen等[30]比较基因组学分析,发现贝莱斯芽胞杆菌模式菌株FZB42比枯草芽胞杆菌168具有更丰富的产物合成能力,FZB42有9个非核糖体多肽合成酶和聚酮化合物合成酶基因簇,包括4个FZB42特有的基因簇(bmyD,pks2,pks3,nrs)。通过MALDI-TOF-MS分析FZB42的脂肽化合物,主要有表面活性素、丰原素、杆菌抗霉素D(伊枯草菌素的一种),而枯草芽胞杆菌B168经进一步证实,不产生丰原素和表面活性素,只能合成少量的1种伊枯草菌素[17]。贝莱斯芽胞杆菌YAUB9601,通过产生芽胞杆菌素D、丰原素、地非西汀和杆菌肽等抗生素发挥抑菌作用[31]。Liu等[32]研究发现贝莱斯芽胞杆菌H3的抗真菌物质主要是C14-Surfactin和C15-Surfactin。本研究菌株JK23通过PCR扩增,检测到3类脂肽类抗生素合成和生长素合成相关的基因,通过脂肽化合物定性检测和质谱分析,进一步明确了菌株JK23产物中可能含有C14 Iturin、C15 Iturin、C16 Bacillomycin D、C15 Surfactin等多种脂肽化合物,包含2种文献中未见分子量报道的脂肽化合物。与已报道的部分贝莱斯菌株不同,菌株JK23基因组中未检测到fenB基因,产物中也没有丰原素同系物。
贝莱斯芽胞杆菌作为新型生防因子,具有强大的合成环脂肽和聚酮类次级代谢产物的能力,已报道有杀菌、杀线虫、诱导抗性和促生长作用,可以作为一种实用高效的生防制剂,有效替代化学农药的使用[24]。本研究中的贝莱斯芽胞杆菌 JK23能够产生多种脂肽类抗生素,对植物病原真菌均具有明显的抑制作用,具有高效、广谱的抑菌活性,生防应用前景广阔。目前菌株JK23的抑菌活性物质的作用机理尚不明确,后续将进行深入研究,为以该菌为基础的生防制剂的研发与应用提供理论基础。
