β-卡波林生物碱flazin与冬凌草甲素杂合衍生物的合成及其抗肿瘤活性
2021-12-17李莉路明坤连国周义博孙焕刘吉开
李莉,路明坤,连国,周义博,孙焕,刘吉开
(中南民族大学 药学院,武汉 430074)
恶性肿瘤是严重危害人类生命健康的重大疾病之一[1],而目前临床上用于癌症治疗的药物却普遍存在毒副作用高、耐药性强等缺陷[2],研发高效低毒的抗肿瘤药物是当前药物研究的热点与重点之一.天然产物作为药物先导化合物的重要来源在药物研发领域扮演着重要角色[3].基于天然产物,特别是已知具有生物活性的天然产物,通过“多样性导向合成”策略构建结构新颖、丰富的“类天然产物”化合物库,并对其进行活性评价,是加速药物先导化合物优化与改进的策略之一[4-5].生物碱在天然产物中占据重要地位,此前本课题组就对生物碱的抗肿瘤活性进行过探索[6-7].
吡啶[3,4-b]吲哚生物碱β-卡波林(carboline alkaloids)因其抗疟疾、抗肿瘤、抗病毒、抗炎等活性而备受关注[8-10].其中,1-(5′-羟甲基-2′-呋喃)-β-卡波林-3-羧酸(flazin)衍生物可促进微管蛋白聚合,具有良好的体外抗肿瘤活性.构效关系研究表明,在flazin母体3位、6位、9位、1′位、5′位进行结构修饰可增强其抗肿瘤活性[11-12](图1).
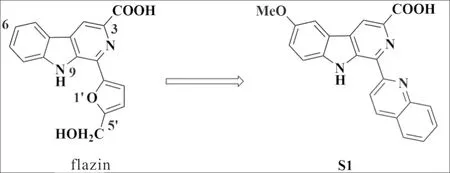
图1 β-卡波林生物碱flazin及其类似物Fig.1 β-carboline flazin and its derivatives
冬凌草甲素为对映贝壳杉烷类二萜,主要来源于中草药冬凌草及相关植物.冬凌草甲素具有抗炎、抗菌、抗肿瘤等多种药理活性,其中尤以抗肿瘤作用而备受关注[13].研究表明:通过结构修饰可提高其生物活性、改善其水溶性、改变其体内药动学过程等,因此对冬凌草甲素的结构修饰受到越来越多的重视,其中C(1)、C(14)、C(6)和C(7)位是主要修饰位点,所获得衍生物大都表现出优良的活性[14](图2).
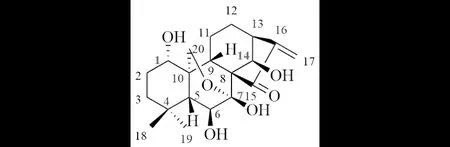
图2 冬凌草甲素及其修饰位点Fig.2 Oridonin and its modification-sites
基于β-卡波林生物碱flazin及冬凌草甲素表现出的抗肿瘤活性及其分子结构特点,本文对其进行结构修饰,并利用活性官能团拼接原理,将β-卡波林和冬凌草甲素杂合成一个分子骨架.采用改良MTT法研究杂合衍生物对肿瘤细胞增殖的影响,初步确定了具有良好细胞毒性的活性分子,为获得更为低毒、高效的抗肿瘤先导化合物提供了线索.
1 实验部分
1.1 仪器与试剂
除非特别说明,文中所用到的色氨酸(麦克林)、苯甲醛(麦克林)、冬凌草甲素(宝鸡辰光)等试剂,均为商业可得,无需纯化处理可直接使用;参照Purification of Laboratory Chemicals(W.L.F.Armarego, Christina Li Lin Chai, Elsevier Inc. 2009)对文中所用到的有机溶剂进行纯化;薄层硅胶板型号为GF254(60-F250, 0.2 mm, 青岛海洋化工厂),用UV(波长254 nm)显色;快速柱层析使用硅胶规格为青岛海洋硅胶60(200~300 mesh ASTM, 青岛海洋化工厂),通常使用乙酸乙酯/石油醚混合溶剂为洗脱剂.
1H NMR、13C NMR、HRMS(ESI)由中南民族大学药学院分析测试中心完成,其中1H NMR、13C NMR检测以氘代氯仿为溶剂,使用Bruker Advance-600(1H: 600 MHz,13C: 150 MHz)、Bruker Advance-500(1H: 500 MHz,13C: 125 MHz)核磁共振仪测定.
1.2 β-卡波林生物碱flazin及其衍生物的合成
称取1 mmol L-色氨酸甲酯1、1 mmol 取代芳香醛2于干燥烧瓶中,加入10 mL干燥DCM,氮气保护下室温反应6 h后加入催化量三氟乙酸(TFA),继续反应48 h,再加入5 mL DMF、1 mL三乙胺,冰浴冷却至0 ℃后缓慢滴加三氯异氰尿酸(TCCA)(1 mmol,溶于1 mL DMF中).0 ℃下继续反应2~3 h,减压旋转蒸发除去DCM,向烧瓶中加入碎冰待其自然融化,过滤,滤饼用甲醇重结晶得β-卡波林-3-羧酸甲酯3.所得产物通过1H NMR进行表征,波谱数据与文献[10]一致(图3).
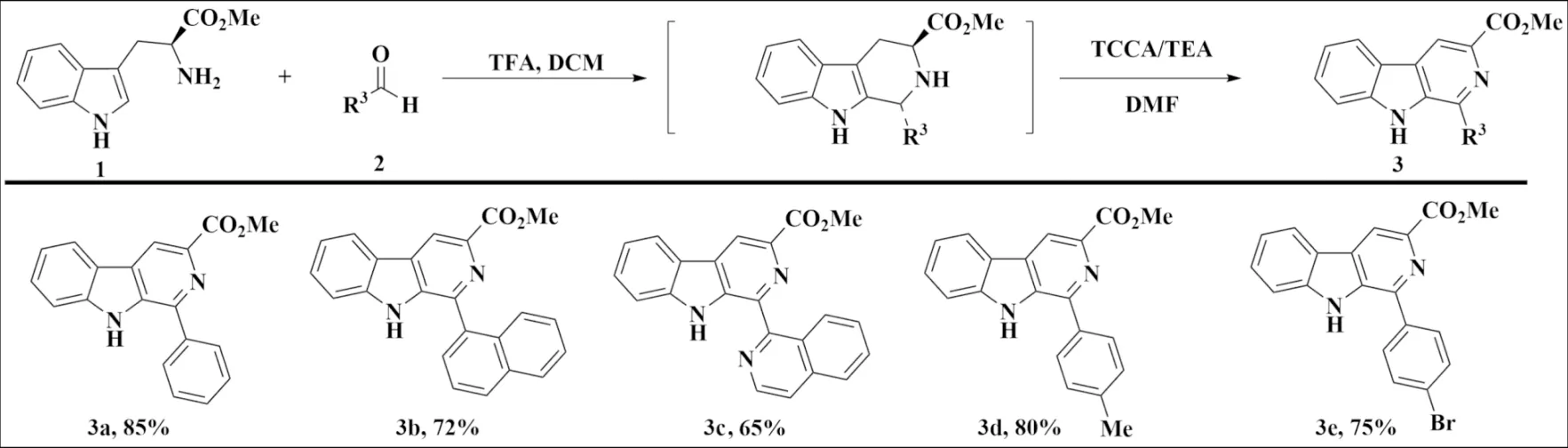
图3 β-卡波林-3-羧酸甲酯的合成Fig.3 Synthesis of β-carboline-3-carboxylic methyl ester
前期研究表明,对卡波林9位烷基化可提高其抗肿瘤活性[12];同时为避免裸露N―H对后续酯化反应的影响,先对9位N―H键进行烷基化后在碱性条件下将3-羧酸甲酯转化为3-羧酸,以便后续在缩合剂存在下与冬凌草甲素C(14)位发生酯化反应得到杂合产物.所得产物通过1H NMR进行表征,波谱数据与文献[10]一致.
9位甲基化β-卡波林-3-羧酸甲酯4的合成:称取0.5 mmolβ-卡波林-3-羧酸甲酯3于干燥烧瓶中,加入无水DMF(5 mL)、无水THF(5 mL),冰浴下分批加入NaH(1.5当量, 0.75 mmol)后转入室温反应1 h.再在冰浴下向反应体系中滴加MeI(1.5 当量, 0.75 mmol),滴加完毕后转入室温反应3 h. 反应完成后冰浴下滴加水淬灭,然后倒入冰水混合物中,用乙酸乙酯(EA)萃取3次,将有机相合并后用无水Na2SO4干燥,旋转蒸发去除挥发性溶剂,硅胶柱层析得9位甲基化的β-卡波林-3-羧酸甲酯4.
9位甲基化β-卡波林-3-羧酸5的合成:向0.2 mmol的β-卡波林-3-羧酸甲酯4中加入甲醇(5 mL)溶解,磁力搅拌下加入1 mol·L-1NaOH(1 mL),加热回流,TLC监测反应进程.待原料消失后将反应冷却至室温,旋蒸除去挥发性溶剂,加水稀释,调pH值到5~6,用乙酸乙酯萃取,合并有机相,无水Na2SO4干燥后旋转蒸发得到9位甲基化的β-卡波林-3-羧酸5(图4).
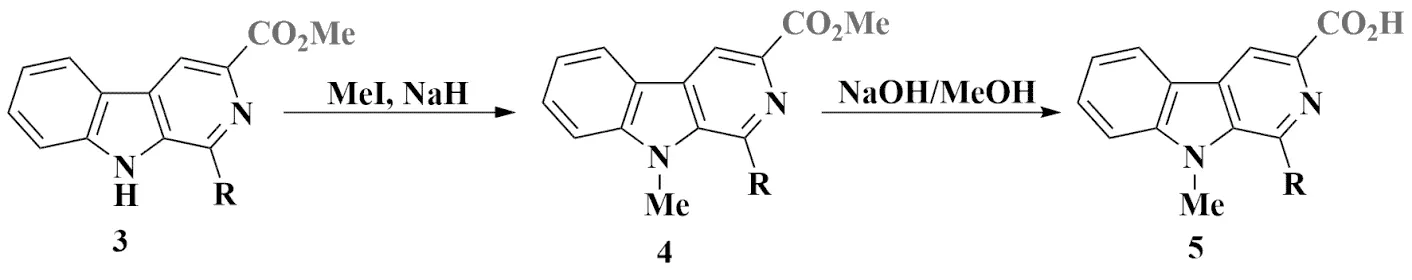
图4 β-卡波林-3-羧酸的合成Fig.4 Synthesis of β-carboline-3-carboxylic acid
1.3 冬凌草甲素衍生物的合成
冬凌草甲素为多羟基化合物,利用不同位点羟基反应活性的不同可对其进行选择性修饰,本文先对冬凌草甲素C(1)、C(6)、C(7)位进行修饰获得相应冬凌草甲素衍生物后,通过C(14)位羟基与β-卡波林-3-羧酸反应生成酯化产物[15].
1.3.1 C(1)位修饰
C(1)位羟基氧化产物的合成:称取冬凌草甲素6(150 mg, 0.41 mmol)于干燥烧瓶中,加入12 mL DCM溶解后,冰浴下分批加入PCC(133.6 mg, 1.5 当量)和等量硅胶,冰浴下反应30 min后,用硅藻土过滤,DCM洗涤滤饼,滤液加水稀释后用DCM萃取3次后合并有机相,用饱和食盐水洗涤,无水Na2SO4干燥,旋转蒸发浓缩后以96%产率得C(1)位羟基氧化成酮产物7.
C(1)位羟基乙酰化产物的合成:称取冬凌草甲素6(100 mg, 0.27 mmol)于干燥烧瓶中,加入丙酮(10 mL)溶解,搅拌下加入2,2-二甲氧基丙烷(1 mL)、催化量对甲苯磺酸.56 ℃下反应15 min,冷却至室温后加水稀释,用DCM萃取(20 mL×3次),合并有机相分别用饱和NaHCO3、饱和食盐水洗涤,无水Na2SO4干燥,过滤,旋转蒸发得7,14-丙酮叉保护冬凌草甲素8(图5).
在烧瓶中加入7,14-丙酮叉保护冬凌草甲素8(90 mg,0.22 mmol),DMAP(0.1 当量)和三乙胺(0.2 mL),搅拌下滴加乙酸酐(1 mL),室温搅拌2.5 h后加水稀释,用DCM萃取(10 mL×3次)后合并有机相分别用饱和NaHCO3、饱和食盐水洗涤,无水Na2SO4干燥,过滤,旋转蒸发得1-乙酰氧基-7,14-丙酮叉保护冬凌草甲素后加入10 mL 10% HCl/THF(体积比1∶1),室温搅拌1 h后加水稀释,用DCM萃取(20 mL×3次),合并有机相用饱和食盐水洗涤,无水Na2SO4干燥,过滤,旋转蒸发得1-乙酰氧基保护冬凌草甲素9(图5).
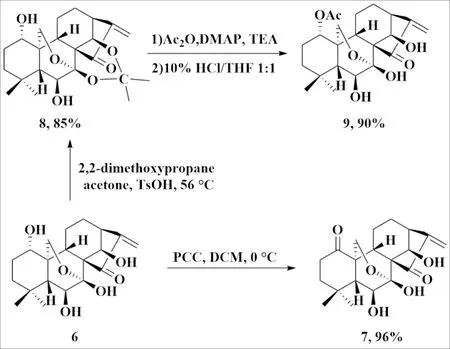
图5 冬凌草甲素C(1)位修饰Fig.5 Modification of oridonin at C(1) position
1.3.2 C(6)位,C(7)位开环修饰
冬凌草甲素C(6)、C(7)位连二醇通过NaIO4氧化开环得延命素型衍生物10,并进一步通过PCC氧化得延命素型衍生物11.
称取冬凌草甲素6(182 mg, 0.5 mmol)溶于10 mL水中,加入NaIO4(1.58 g, 7.4 mmol),室温下搅拌24 h后用DCM萃取,合并有机相用饱和食盐水洗涤,无水Na2SO4干燥,过滤,旋转浓缩得延命素型化合物10.将得到的化合物10溶于DCM中,冰浴下分批加入PCC(1.5 当量)和等量硅胶,继续反应30 min后,用硅藻土过滤,DCM洗涤滤饼,滤液加水稀释后用DCM萃取3次,将有机相合并后用饱和食盐水洗涤,无水Na2SO4干燥,旋转蒸发浓缩后得延命素型冬凌草甲素衍生物11(图6).
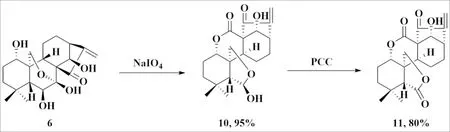
图6 冬凌草甲素C(6)位、C(7)位修饰Fig.6 Modification of oridonin at C(6)、C(7) position
得到的冬凌草甲素衍生物7~11均通过1H NMR进行表征,波谱数据与文献[13]报道一致.
1.4 β-卡波林与冬凌草甲素杂合衍生物的合成
称取等摩尔量β-卡波林3-羧酸与冬凌草甲素衍生物于烧瓶中,用DCM溶解后,加入1.1 当量EDCI,10%DMAP(摩尔比)和1.5当量三乙胺,室温搅拌过夜后,依次用1 mol·L-1HCl、饱和NaHCO3、饱和食盐水洗涤,无水Na2SO4干燥,过滤,旋转蒸发浓缩后干法拌样通过快速硅胶柱层析(石油醚/乙酸乙酯混合溶剂为流动相)分离纯化得β-卡波林与冬凌草甲素杂合衍生物.
1.5 杂合衍生物抗肿瘤活性研究
采用改良MTT法研究杂合衍生物对肿瘤细胞增殖的影响.选取对数生长期的人早幼粒白血病细胞株HL60、人肺癌细胞株A549、人肝癌细胞株SMMC-7721、人乳腺癌细胞株MCF-7和人结肠癌细胞株SW480为细胞模型.待测化合物用DMSO溶解,以40 μmol·L-1浓度初筛,选定效果较好的化合物后,以40、8、1.6、0.32、0.064 μmol·L-1浓度复筛,以LOGIT法计算半数抑制浓度IC50值.每次实验均设顺铂(DDP)为阳性对照,每种处理均设置3个复孔.
2 结果与讨论
2.1 β-卡波林-3-羧酸与冬凌草甲素杂合衍生物的合成
以9位甲基化β-卡波林-3-羧酸和修饰过的冬凌草甲素为原料,以EDCI为缩合剂、DMAP为催化剂、三乙胺为碱,利用卡波林3位羧基和冬凌草甲素14位羟基之间的酯化,可以较高收率得到杂合衍生物(图7).
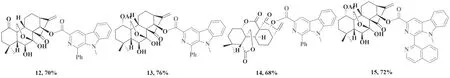
图7 杂合衍生物的合成Fig.7 Synthesis of hybrid derivatives
谱图解析:
(4aR, 5S, 6R, 6aR, 9S, 11aS, 11bS, 14R)-5, 6-dihydroxy-4,4-dimethyl-8-methylene-1,7-dioxododecahydro-1H-6,11b-(epoxymethano)-6a,9-methanocyclohepta[a]naphthalen-14-yl9-methyl-1-phenyl-9H-pyrido[3,4-b]indole-3-carboxylate(12, white solid, 70%):1H NMR(600 MHz, Chloroform-d)δH8.79(s, 1H), 8.23(d,J=7.8, 1H),7.68~7.65(m, 1H),7.65~7.61(m, 2H), 7.52(t,J=7.3, 2H), 7.50~7.46(m, 2H), 7.39(t,J=7.7, 1H), 6.20(s, 1H), 5.86(s, 1H), 5.56(s, 1H), 5.52(dd,J=9.5, 2.1 Hz, 1H), 4.34(dd,J=10.9, 1.4 Hz, 1H), 4.08(dd,J=10.8, 1.9 Hz, 1H), 3.87(dd,J=9.5, 7.8 Hz, 1H), 3.59(d,J=9.6 Hz, 1H), 3.50(s, 3H), 2.74(m, 1H), 1.21(s, 3H), 1.03(s, 3H). HRMS(ESI):m/z[M+H]+calcd. for C39H39N2O7647.2757, found 647.2747.
(1S,4aR,5S,6R,6aR,9S,11aS,11bS,14R)-1-acetoxy-5,6-dihydroxy-4,4-dimethyl-8-methylene-7-oxododecahydro-1H-6,11b-(epoxymethano)-6a,9-methanocyclohepta[a]naphthalen-14-yl9-methyl-1-phenyl-9H-pyrido[3,4-b]indole-3-carboxylate(13, white solid, 76%):1H NMR(500 MHz, Chloroform-d)δH8.83(s, 1H), 8.25(d,J=7.9 Hz, 1H), 7.68~7.63(m, 3H), 7.53(t,J=7.4 Hz, 2H), 7.50~7.45(m, 2H), 7.40(t,J=7.5 Hz, 1H), 6.24(d,J=8.7 Hz, 1H), 6.18(broad, 1H), 6.11(s, 1H), 5.94(s, 1H), 5.45(s, 1H), 4.69(dd,J=11.6, 5.4 Hz, 1H), 4.31(d,J=10.7 Hz, 1H), 4.19(d,J=10.6 Hz, 1H), 3.82(m, 1H), 3.56(d,J=10.1 Hz, 1H), 3.49(s, 3H), 2.69(m, 1H), 2.04(s, 3H), 1.13(s, 3H), 1.12(s, 3H).13C NMR(125 MHz, Chloroform-d)δC206.98, 170.17, 165.44, 149.48, 144.53, 143.53, 138.25, 137.21, 135.73, 130.37, 130.06, 129.23, 129.08, 128.44, 128.14, 127.95, 127.76, 121.93, 121.47, 121.19, 119.98, 116.63, 110.51, 96.46, 73.63, 63.61, 61.71, 60.96, 53.24, 40.79, 39.76, 39.31, 33.75, 33.62, 32.26, 30.51, 25.42, 21.80, 21.44, 17.93. HRMS(ESI):m/z[M+H]+calcd. for C41H43N2O8691.3019, found 691.3008.
(3aR,6aS,8aR,11S,13aS,13bS,14R)-4,4-dimethyl-10-methylene-3,8,9-trioxotetradecahydro-8a,11-methanocyclohepta[c]furo[3,4-e]chromen-14-yl9-methyl-1-phenyl-9H-pyrido[3,4-b]indole-3-carboxylate(14, white solid, 68%):1H NMR(500 MHz, Chloroform-d)δH8.73(s, 1H), 8.27(d,J=8.0 Hz, 1H), 7.64~7.58(m, 3H), 7.49(m, 4H), 7.44(d,J=8.2 Hz, 1H), 7.36(t,J=7.5 Hz, 1H), 6.33(s, 1H), 5.96(s, 1H), 5.65(s, 1H), 4.69(dd,J=11.5, 5.6 Hz, 1H), 4.41(d,J=10.1 Hz, 1H), 3.53~3.48(m, 1H), 3.47(s, 3H), 1.08(s, 3H), 0.87(s, 3H). HRMS(ESI):m/z[M+H]+calcd. for C39H37N2O7645.2601, found 645.2591.
(1S,4aR,5S,6R,6aR,9S,11aS,11bS,14R)-1-acetoxy-5,6-dihydroxy-4,4-dimethyl-8-methylene-7-oxododecahydro-1H-6,11b-(epoxymethano)-6a,9-methanocyclohepta[a]naphthalen-14-yl1-(isoquinolin-1-yl)-9-methyl-9H-pyrido[3,4-b]indole-3-carboxylate(15, white solid, 72%):1H NMR(500 MHz, Chloroform-d)δH8.91(s, 1H), 8.49(d,J=8.5 Hz, 1H), 8.29(d,J=8.5 Hz, 1H), 8.26(d,J=7.9 Hz, 1H), 8.12(d,J=8.4 Hz, 1H), 7.97(d,J=8.1 Hz, 1H), 7.74(t,J=7.8 Hz, 1H), 7.68(t,J=7.7 Hz, 1H), 7.60(t,J=7.5 Hz, 1H), 7.53(d,J=8.2 Hz, 1H), 7.40(t,J=7.5 Hz, 1H), 6.40(s, 1H), 6.38(d,J=2.6 Hz, 1H), 6.09(s, 1H), 5.94(d,J=1.6 Hz, 1H), 5.45(s, 1H), 4.69(dd,J=11.4, 5.5 Hz, 1H),4.32(d,J=10.7 Hz, 1H), 4.23(d,J=10.7 Hz, 1H), 3.86(dd,J=8.9, 5.7 Hz, 1H), 3.71(s, 3H), 3.59(d,J=10.1 Hz, 1H), 2.71~2.65(m, 1H), 2.03(s, 5H), 1.15(s, 3H), 1.13(s, 3H). HRMS(ESI):m/z[M+H]+calcd. for C44H44N3O8742.3128, found 742.3115.
2.2 β-卡波林-3-羧酸与冬凌草甲素杂合衍生物抗肿瘤活性筛选
采用改良MTT法研究杂合衍生物对肿瘤细胞增殖的影响,初步筛选结果表明杂合衍生物12、13对多种肿瘤细胞均表现出良好的细胞毒性,特别是化合物13对肿瘤细胞株HL-60、A-549、SMMC-7721、MCF-7、SW480的IC50为1.54、4.27、3.69、3.12、1.46 μmol·L-1,分别是抗癌药物顺铂的6.5、6.8、3.0、9.6、13.1倍,初步表明β-卡波林生物碱与冬凌草甲素杂合有望获得抗肿瘤活性分子线索(表1).

表1 杂合衍生物12和13抗肿瘤活性研究Tab.1 Anticancer activity study of hybrid molecule 12 and 13
