首乌藤治疗阿尔茨海默病的网络药理学研究
2021-12-17谭铖罗洪斌黄胜
谭铖,罗洪斌,2*,黄胜
(1 湖北民族大学 生物资源保护与利用湖北省重点实验室 & 医学部,恩施 445000;2 湖北民族大学 神经精神共患病研究所,恩施 445000)
阿尔茨海默病(Alzheimer′s disease, AD)是一种发生在中枢神经系统的神经退行性疾病.随着社会老龄化进程的加快,AD发病率和发病人数急剧上升,目前我国65岁以上的老年人发病率大约在4.8%[1],且AD的发病率随着年龄的增长而升高,已成为严重威胁老龄人群身心健康的常见疾病.由于记忆力及智力衰退,AD患者生活不能自理,晚期几乎完全需要他人护理,给社会和家庭带来了沉重负担和极大痛苦[1].
目前,临床上治疗阿尔茨海默病的药物主要有乙酰胆碱酯酶抑制剂,谷氨酸受体抑制剂等.这些药物可缓解认知功能下降所引发的症状,但无法从根本上消除病因[2].因此,寻找更为有效的AD治疗药物就显得格外重要.
中医学是中国传统医学宝库,在防治疾病方面具有不可替代的优势,很多中药的潜在治疗作用正在挖掘并得到有效应用.中医学中AD被称为“痴呆”,又名呆病.其病位在脑,与心肝脾肾关系密切,基本病机为髓海空虚,元神失养[3].临床分期常依据症状分为平台期、波动期、下滑期.中医治疗老年痴呆的论治主要体现于补肾健脾、养心安神[4].近年来,许多基于中医理论研制出来的中药单体或复方制剂常通过多组分作用和多靶点方式来治疗AD等疾病,取得了良好的治疗效果,如传统中药千层塔有效成分石杉碱甲就已广泛应用于AD等神经退行性疾病的早期治疗[4],这与中医理论强调整体观来治疗疾病与现代医学理论高度契合.
网络药理学是基于系统生物学、多元药理学、网络分析等多学科知识[5]并通过分析药物的有效成分,映射疾病相关靶点,利用多靶点、多通路与疾病的相互作用形成可视化网络,在探索治疗途径,明确药物疗效特别是寻找药物有效成分方面具有非常重要的作用,与中医理论所强调的整体观高度吻合.近年来,国内众多学者利用网络药理学探究了许多中药材的有效成分及治疗疾病的靶点、机制,为许多疾病的药物开发提供了新的思路.黄斌等[6]利用网络药理学探讨了药物头顶一颗珠治疗阿尔茨海默病的可行性,验证了头顶一颗珠可通过抑制乙酰胆碱酯酶活性、促进神经元及突触发育等机制改善AD的发展.时悦等[7]研究预测了开心散缓解AD可能与抑制乙酰胆碱酯酶活性、抑制Tau的过度磷酸化等相关.说明网络药理学在探讨中药治疗AD的有效成分及其作用分子机制方面具有非常重要的预测作用.
首乌藤(PolygnimultifloriCaulis),又名夜交藤,为蓼科植物何首乌(PolygonummultiflorumThunb.)的藤茎,性平,味甘.具有养血安神、祛风通络之功效,属养心安神药.临床上常用于治疗失眠梦多、血虚身痛等[8].针对处于波动期的痴呆患者,中医常使用含首乌藤的天麻钩藤饮进行治疗,其治法治则主要为清心平肝、安神定志,从而缓解健忘颠倒及认知损害[9].刘琼丽等发现首乌藤能通过调节超氧化物歧化酶、一氧化氮合酶等缓解小鼠脑的氧化应激损伤[10],而氧化应激又是AD可能的发病机制之一.因此,首乌藤具有治疗AD的潜在作用,有必要借助网络药理学相关研究方法深入研究探讨该药物治疗AD的有效成分及其作用分子机制.
鉴于此,本文拟通过网络药理学相关知识,筛选首乌藤有效成分,确定其映射AD疾病的靶点及相关细胞信号通路,探究其有效成分及其治疗AD的作用机制,为后续研究提供一定的理论基础.
1 材料与方法
1.1 首乌藤有效成分筛选
通过中药系统药理学数据库(TCMSP)(http://tcmspw.com/tcmsp.php)、中药综合数据库(TCMID)(http://www.megabionet.org/tcmid/)检索首乌藤的化合物成分,并根据相关文献报道对其有效成分进行补充.按照生物利用度(oral bioavailability,OB)≥30%对所获得的化合物进行初步筛选.在Pub Chem数据库对首乌藤的有效成分进行检索,获得每个成分的Canonical SMILES格式,将SMILES号依次导入Swiss Target Prediction(http://www.swisstargetprediction.ch/)数据库中,对所分析的化合物进行准确的生物活性分子靶点预测,在物种选择为人类的基础上将结果导出.
1.2 AD疾病靶点的获取
以“Alzheimer′s disease”为关键词在TTD数据库(http://bidd.nus.edu.sg/group/cjttd)、Drugbank数据库(https://www.drugbank.ca/)、GeneCards 数据库(https://www. genecards. org)、OMIM 数据库(http://www.omim.org)对其(即AD)进行检索,对检索到AD的已知潜在靶点进行汇总,同时删除重复靶点.在GeneCards数据库中检索所得到的靶点按照大于Score值进行筛选,而Score大小与靶点的密切程度成正相关.再将最终所得靶点基因在Uniprot数据库(http://www.uniprot.org/)中进行基因的标准化.
1.3 首乌藤-AD疾病靶点网络的构建
将检索并筛选到的首乌藤有效成分进行简称命名,分别由SWT1-SWTn表示.将首乌藤成分潜在作用靶点信息与AD的疾病相关靶点信息均导入EXCEL中,保留其共有靶点,去除其他靶点.整理后导入Cytoscape3.7.2中进行首乌藤-AD疾病靶点网络的构建,并对该网络进行分析.将每个节点的颜色按照自由度进行渐变,颜色的深浅与该节点的重要程度呈正相关.
1.4 首乌藤成分-AD靶点与通路的富集分析
DAVID(https://david.ncifcrf.gov/)是一个基因功能在线注释平台,它能对所分析的基因进行系统提取,展现其所涉及的疾病、蛋白、通路以及进行GO、KEGG的功能注释与富集分析,能帮助研究者从分子层面更加深入地了解基因之间的富集关系[11].将首乌藤作用于AD的潜在靶点导入到DAVID平台,对其进行GO与KEGG的分析,对导出的结果进行表格整理与图形可视化,以便后续分析讨论.
1.5 首乌藤成分-AD靶点-重要信号通路网络的构建
运用Cytoscape3.7.2构建首乌藤成分-AD靶点-信号通路网络,进一步分析其活性成分、作用靶点及信号通路之间的相互作用关系.
2 结果与分析
2.1 首乌藤有效成分及靶点的筛选结果
根据TCMSP数据库、TCMID数据库以及文献[12-13]报道初步提取出首乌藤有效成分53种,经OB限定筛选后得到活性成分14种,分别以SWT1-SWT14表示(见表1),其中BBB(blood brain barrier)值用于衡量分子对血脑屏障的通透性,BBB<-0.3的化合物通透性差,BBB介于-0.3~0.3则具有中等通透性,BBB>0.3则具有强穿透性[14].将14种化合物在Swiss Target Prediction中进行靶点预测后得到成分作用靶点383个.
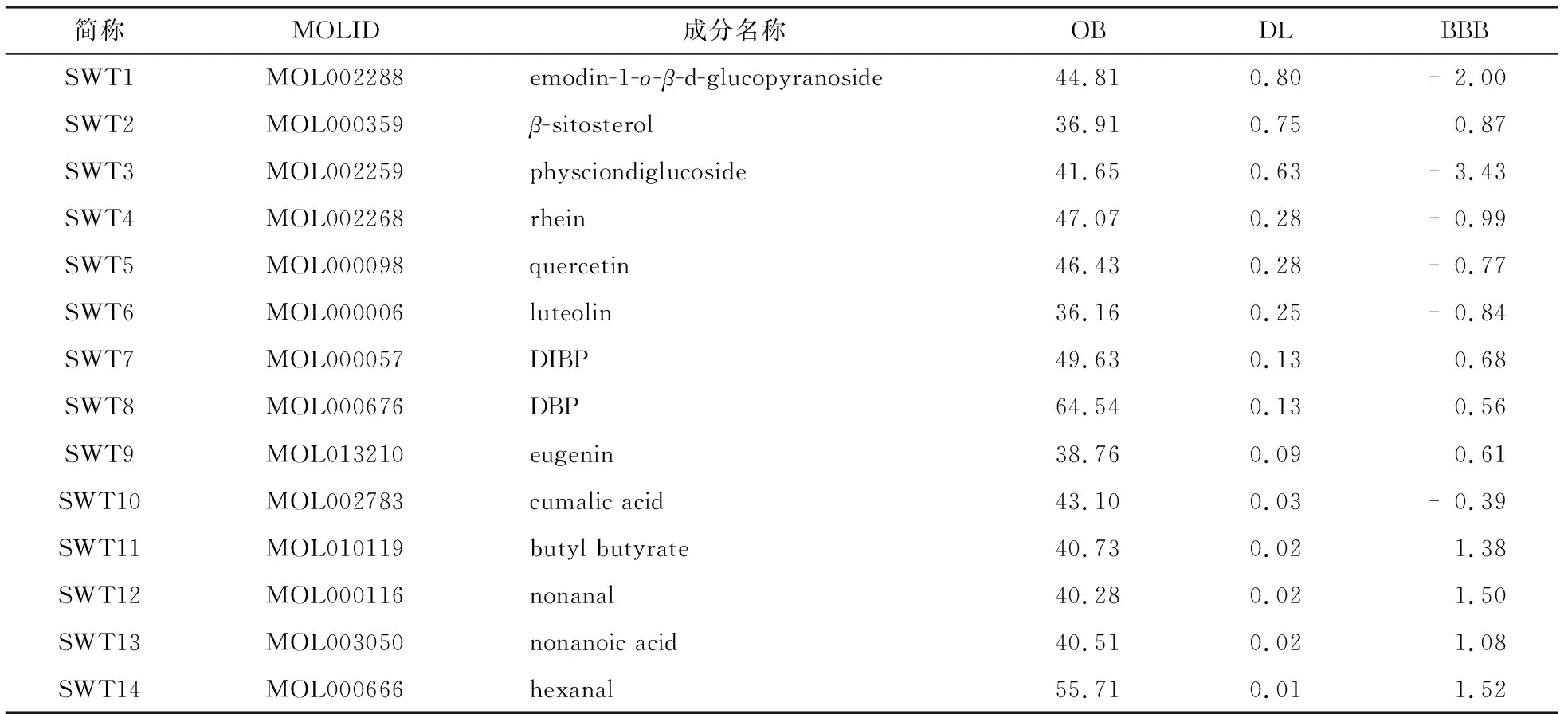
表1 首乌藤潜在活性化合物基本信息Tab.1 Basic information of potential active compounds of Polygni multiflori Caulis
2.2 AD相关靶点的获取
利用TTD、Drugbank、Genecards及OMIM数据库对AD进行检索,对于Genecards数据库按照score值大小选择相关性较高的靶点,删去重复靶点最终得到靶点228个.
2.3 首乌藤成分-AD疾病靶点网络的构建
将首乌藤有效成分潜在作用靶点与AD疾病相关的靶点导入Excel进行比较,保留其中共有的靶点并绘制韦恩图,得到首乌藤成分-AD共同靶点50个(见图1).
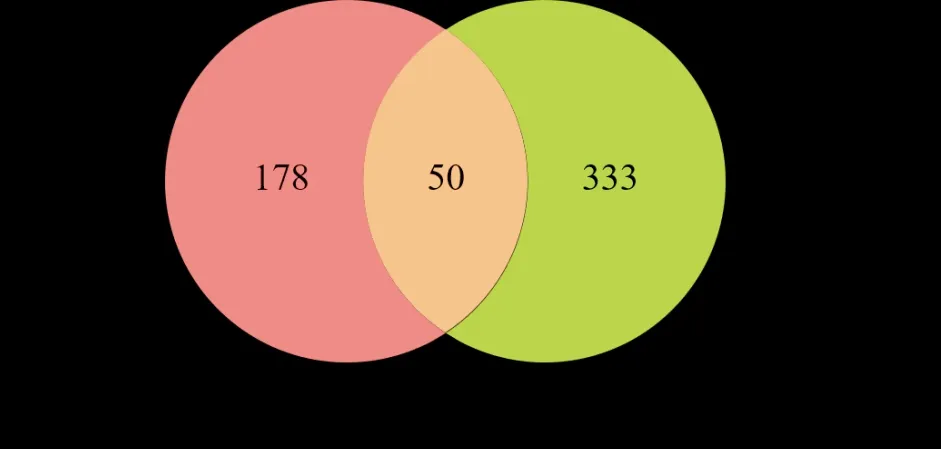
图1 首乌藤成分-AD靶点韦恩图Fig.1 Venn map of Polygni multiflori Caulis component and AD target
而首乌藤成分-AD共有的50个靶点具体信息见表2.进而将首乌藤成分-AD靶点对应信息导入Cytoscape3.7.2,绘制首乌藤成分-AD靶点网络图,见图2.
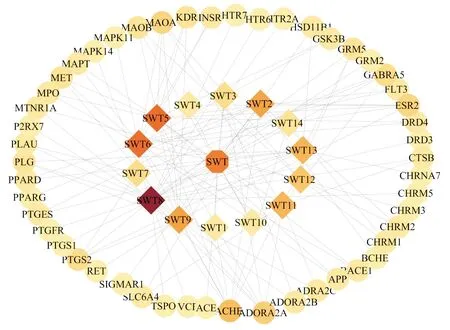
图2 首乌藤成分-AD疾病靶点图Fig.2 Disease target map of Polygni multiflori Caulis compatibility ingredients-AD 注:边形代表首乌藤;菱形代表首乌藤有效成分;圆形代表首乌藤与AD共同作用的靶点;节点颜色随自由度渐变,颜色越深则其在网络中越重要

表2 首乌藤映射AD疾病的共同靶点的相关名称Tab.2 Related names of Polygni multiflori Caulis mapping the common target of AD

表2(续)
2.4 GO过程富集分析
DAVID平台进行GO功能富集分析后共得到GO条目185个,其中生物过程(biological process, BP)条目117个,细胞组分(cellular component, CC)条目32个,分子功能(molecular function, MF)条目36个.按照分析数据中错误发现率(FDR)<0.01进行限定,得到的BP、CC、MF组分如表3所示.而GO功能分析结果见图3.

表3 GO分析项目信息Tab.3 Information of GO analysis

图3 首乌藤与AD疾病潜在靶点GO功能分析Fig.3 GO function analysis map of Polygni multifloriCaulis and AD potential target
2.5 KEGG通路分析
2.5.1 KEGG信号通路富集分析结果
在DAVID平台进行KEGG富集分析后共得到KEGG信号通路21条.将得到的21条信号通路按FDR<0.05限定进行筛选,得到筛选后的信号通路共3条,按FDR从小到大的顺序排列,见表4.

表4 首乌藤作用于AD的KEGG信号通路信息Tab.4 Information of the signal pathways by KEGG ofPolygni multiflori Caulis acting on AD
2.5.2 成分-靶点-信号通路网络构建结果
将KEGG信号通路分析所得到的FDR<0.05的信号通路进行整理,获取其相关的靶点信息.将首乌藤成分、信号通路、相关靶点信息导入Cytoscape3.7.2中构建药物成分-靶点-重要通路网络,结果见图4.
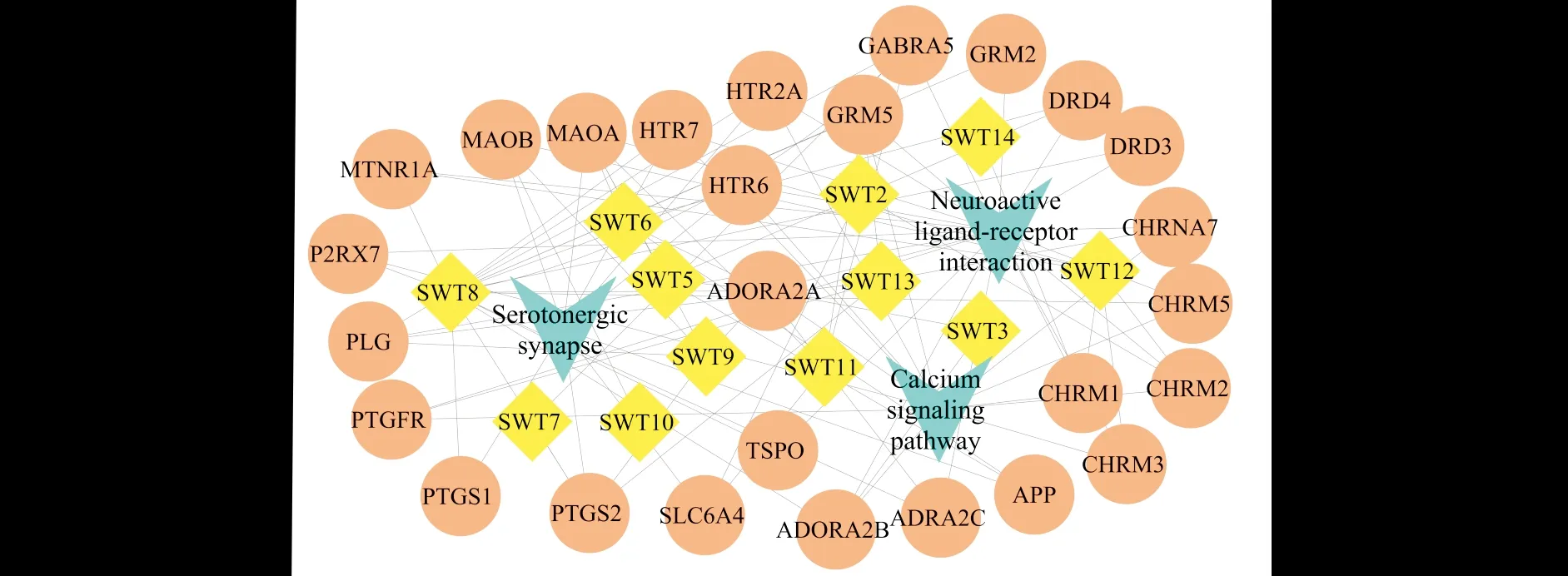
图4 首乌藤与富集所得通路共同映射的成分靶点及疾病靶点网络图Fig.4 Target maps and disease target maps mapped together in the compatibility of Polygni Multiflori Caulis注:蓝色代表信号通路;黄色代表首乌藤成分;桃红色代表信号通路与成分疾病共同靶点基因
2.6 首乌藤与AD共同作用靶点-重要信号通路网络的构建
将与AD相关的血清素能突触信号通路、钙信号通路、神经配体-受体相互作用信号通路单独与药物疾病共同作用靶点进行网络构建,见图5.重要信号通路及其对应的基因见表5.

图5 首乌藤成分与AD共同作用靶点-重要信号通路网络图Fig.5 Network map of targets and important pathways in combination of Polygni multiflori Caulis and AD注:蓝色代表重要信号通路;桃红色代表成分疾病共同靶点基因

表5 AD相关重要通路对应靶点信息Tab.5 Information of targets of AD-related important signal pathways
3 讨论
到目前为止,AD病因及发病机制尚未完全明确,一般认为遗传因素、免疫因素、环境因素等在内的多种因素都参与致病.AD的发病机制主要有β淀粉样蛋白(beta-amyloid, Aβ)学说、Tau过度磷酸化学说、神经血管学说、胆碱能学说、免疫炎症学说以及氧化应激学说等多种学说[15-17].其主要病理表现为脑组织中的老年斑(senile plaque, SP)、神经原纤维缠结(neurofibrillary tangle, NFT)、大量营养不良性神经炎及神经元功能受损,其最主要的临床症状为进行性认知功能障碍、神经精神和行为学功能失调,以致最终丧失生活能力为主要临床表现.其中老年斑主要由毒性Aβ在神经细胞外聚集引起;NFT主要以双螺旋丝(paired helical filaments, PHFs)样结构存在.已有研究表明:一过性的Tau蛋白磷酸化对神经具有保护作用,而异常过度磷酸化的Tau蛋白可形成双螺旋丝样结构,构成NFT[18].Tau蛋白是一种微管相关蛋白,它能与微管蛋白结合促进其聚合形成微管.而Tau蛋白与管蛋白结合成为微管蛋白可作为微管组装早期的核心,进而促进其他微管蛋白在此核心上延伸聚集形成微管参与各种生理活动[19].
在AD的发病过程中涉及多因素、多机制以及多条细胞信号通路的参与.而目前临床上治疗AD疗效显著的药物则报道不多,现有临床药物多仅能缓解轻中度AD的临床症状且作用机制单一.而网络药理学是基于医学、生物学、信息学等多个学科综合而成的研究方法,能对多组分、多靶点、多通路进行分析,且与中医用药的整体性有很大的相似性,适合用于研究AD这类多因素致病的疾病[20].
本文筛选得到首乌藤有效成分14种,其中8种成分对血脑屏障有着较好的通透性,6种成分则通透性较低.首乌藤有效成分与AD疾病共同作用的靶点为50个,占总AD相关靶点(228个)的21.93%,首乌藤对AD靶点的映射率较好.因此首乌藤能通过多个靶点作用于AD并可产生较好的防治作用.
对首乌藤成分-成分疾病作用靶点构建网络后,得到自由度最高的前4个基因节点分别为ACHE、ADORA2A、ESR2、MAOA.这4种基因所表达的蛋白广泛参与AD的发病发生发展过程中.目前认为:ACHE是现代医学中抗AD最常用的药物靶点之一,ACHE的表达产物为乙酰胆碱酯酶(AChE).临床上常使用AChE抑制剂治疗AD,其作用机制主要是抑制AChE以减少突触间隙中乙酰胆碱的失活,从而提高乙酰胆碱水平,促进胆碱能神经的传递,以此改善AD患者的认知功能[21].在首乌藤有效成分中SWT1、SWT2、SWT5、SWT6、SWT8、SWT9、SWT11、SWT14均可对ACHE基因产生影响.因此,通过抑制AChE可能是首乌藤防治AD的作用机制之一.
腺苷是人体内重要的神经调质,近年研究表明:腺苷的受体功能失衡参与了AD的发病.在AD患者脑中腺苷A1受体(ADORA1)表达减少而腺苷A2A受体(ADORA2A)过度表达,且ADORA1介导的抑制作用减弱,ADORA2A介导的兴奋作用增强,通过各自的信号通路引起相应神经病理变化,从而导致AD的发生[22].首乌藤可能从降低ADORA2A的表达进而恢复受体功能失衡这一层面影响并发挥了治疗AD的发生.
ESR2基因编码能产生雌激素受体β(ERβ).而ERβ与其另外一个亚基雌激素受体α(ERα)在人体内分布有差异,其发挥的生物学效应也不完全相同.研究表明:在中枢神经系统中ERβ有较高丰度的表达,而ERα低表达或无表达[23-24].在中枢神经系统作用的局部雌激素与AD的发生密切相关,其功能可能为促进大脑海马区树突棘的发育、拮抗毒性Aβ导致的神经元毒性以及影响Tau的磷酸化水平进而延缓AD的发生发展[25].因此,首乌藤可能通过影响ESR2基因表达,进而提高中枢神经系统局部ERβ的丰度从而达到治疗AD的作用.
在AD的发病机制中,毒性Aβ除了可聚集形成老年斑之外,还参与到其他多条发病机制当中.如毒性Aβ可作用于神经细胞膜,引发钙超载,细胞内Ca2+大量增多会激活单胺氧化酶A(MAO-A),MAO-A可产生过氧化物和自由基,造成对神经细胞的氧化应激损害[26].因此,针对MAO-A的活性进行调节以减少氧化应激所产生的神经损伤可能是首乌藤治疗AD的可能机制之一.
KEGG通路富集分析筛选后得到3条重要通路,即血清素能突触信号通路、Ca2+信号通路以及神经配体-受体相互作用信号通路.神经配体-受体相互作用信号通路与AD的发生密切相关,该通路的调节主要利用5-HT、ACh、多巴胺、GABA等神经递质或调质作为前体物质,进而影响后续的信号转导[27].
血清素即5羟色胺(5-HT),血清素能系统与AD的发病也密切相关.研究表明,5-HT4及5-HT6受体(即5-HT receptor 6, 5-HTR6)参与了Tau蛋白过度磷酸化的过程[28].而5-HTR6与配体结合可激活M1R介导的信号通路,以减少毒性Aβ的沉积.此外,长期使用5-HT4受体的激动剂可使AD模型小鼠脑内毒性Aβ沉积减少,神经纤维缠结与老年斑形成下降,Aβ导致的氧化应激所带来的损伤也相应得到缓解[29].而5-HT7受体的激活能对海马神经元的凋亡产生抑制作用,并使突触的可塑性增强[30].进一步探索首乌藤是否能通过激活血清素能受体从而延缓AD的发生也是一个重要的思路.
Ca2+信号通路与机体各种疾病的发生发展都密切相关.在AD中,Ca2+能与毒性Aβ协同促进AD发生,而毒性Aβ导致的钙超载能刺激细胞产生更多的氧自由基,加重神经细胞的氧化应激损伤.同时,细胞内Ca2+的失衡还会加速毒性Aβ的聚集,进一步促进AD的发生[31].经预测发现首乌藤有12种有效成分都能通过钙信号通路来达到治疗AD的目的.
综上所述,本文基于网络药理学的方法,探索了首乌藤治疗AD的作用靶点及其可能的作用机制,证明了中草药首乌藤具有多种活性成分,能通过影响多个靶点、多条信号通路的方式作用于AD疾病发生过程中的各个病理生理学过程,从而达到治疗AD或延缓其发生发展的作用.其具体机制可能主要与上调ACh水平、抑制Aβ形成、抑制钙超载与氧化应激、增强突触可塑性等有关.本文可为后续的实验设计和研究思路提供一定的理论依据和研究思路,所分析的首乌藤治疗AD重要靶点基因及其重要信号通路,还需进一步的细胞实验和动物实验进行验证.
