吉祥草甾体皂苷RCE-4诱导人宫颈癌Ca Ski细胞凋亡与自噬相互作用的分子机制
2021-12-16游方芳陈剑锋
游方芳,程 凡,邹 坤,张 晶,陈剑锋
(三峡大学生物与制药学院天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
宫颈癌是一种常见的妇科恶性肿瘤,化疗是主要的治疗手段之一,但耐药性和严重的毒副作用往往导致治疗预期不佳。天然来源的药物因其多靶点、毒性低的优势一直备受关注。RCE-4(结构见Fig 1)是本实验室从百合科铃兰族植物吉祥草中分离得到的一个螺甾烷型甾体皂苷,实验室前期研究发现,RCE-4对宫颈癌Ca Ski细胞具有较好的选择性细胞毒性,能诱导其发生凋亡和自噬[1-3],对荷瘤裸小鼠的最高抑瘤率可达到69.1%,且对正常组织的毒性极低[4],显示了其治疗宫颈癌的巨大潜力。但同时也发现了RCE-4的一些不足之处,比如用药剂量较大、抑瘤率还有待提高以及其抗宫颈癌作用机制研究还不够深入等。

Fig 1 The chemical structure of RCE-4
化疗药物的最终目标是诱导肿瘤细胞死亡,凋亡和自噬作为细胞程序性死亡的主要方式,尽管其特征和机制不同,但大量研究已证实,二者并不是孤立存在的,一些关键的调控因子在双方的调控网络中频繁地出现,说明在两者之间存在着复杂的相互作用。现有的研究表明两者之间可能存在着如下几种可能:(1)促进关系。当凋亡和自噬其中一种被激活或者抑制时,另外一种也相应被激活或抑制。宋峰等[5]发现,自噬激动剂雷帕霉素预处理细胞上调自噬可进一步增加IL-1β诱导的细胞凋亡,而使用自噬抑制剂3-MA预处理抑制细胞自噬后则可逆转IL-1β诱导的INS-1胰岛细胞凋亡。(2)拮抗关系。两者之间是对抗的关系,自噬对肿瘤细胞起保护作用,对肿瘤的发展起促进作用。Zhuang等[6]发现,人参皂甙Rh2诱导的自噬可以保护人白血病U937和K562细胞免于凋亡,3-MA处理能增强其诱导的细胞凋亡。(3)合作关系。自噬和凋亡协作引起细胞死亡,两者可能同时发生;或者当其中一种受到阻碍或抑制时,另一程序则被激活并继续完成细胞死亡进程[7]。虽然凋亡和自噬相互作用的分子机制尚未完全阐明,但探讨化疗药物诱导的细胞凋亡和自噬之间的关系并进行精准调控对肿瘤治疗和抗肿瘤药物研发具有非常重要的意义,已成为当前引人注目的研究领域之一。
鉴于此,本实验拟在前期研究的基础上,通过不同抑制剂和siRNA质粒的应用,初步探讨RCE-4诱导的Ca Ski细胞凋亡和自噬的相互作用,以期找到降低用药剂量、提高其疗效的途径,为RCE-4将来的临床应用提供理论支撑。
(1β,3β,5β,25S)-spirostan-1,3-diol1-[α-L-rhamnopyranosyl-(1→2)-β-D-xylopyranoside]
1 材料与方法
1.1 材料
1.1.1细胞株 人宫颈癌 Ca Ski细胞株由中国科学院典型培养物保藏委员会细胞库提供。
1.1.2药物及试剂 RCE-4由本实验室从吉祥草中分离得到[8];自噬抑制剂3-甲基腺嘌呤(3-Methyladenine,3-MA)(M9281)、巴弗洛霉素A1(bafilomycin A1,Baf A1)(HY-100558)和氯喹(chloroquine,CQ)(C6628)及凋亡抑制剂Z-VAD(OH)-FMK(Z-VAD-FMK)(HY-16658)均购于中国Med Chem Express公司;基因沉默质粒Bcl-2 siRNA(6441S)、Beclin 1 siRNA(6222S)一抗Beclin 1(3495S)、phospho (p)-Beclin 1(84966S)、LC3 Ⅰ/Ⅱ(4108S)、ATG 4B(13507S)、ATG 14(96752S)、Bax(5023T)、Bcl-2(4223S)、cleaved caspase-3(9664T)、cleaved caspase-7(8438T)、cleaved caspase-9(9505T)及β-actin(8457S)购于美国CST公司;二抗辣根酶标记山羊抗小鼠IgG(GB23301,武汉赛维尔生物科技有限公司);RPMI 1640细胞培养基(31800-022,美国Gibco公司);四季青胎牛血清(11011-8611,浙江天杭生物科技股份有限公司);青霉素-链霉素混合液(SV30010,北京索莱宝科技有限公司);四甲基偶氮唑盐(MTT)(BS0328,美国Amersco公司);ECL超敏发光液(BL520A,北京普利莱基因技术有限公司);GFP-CERTIED®细胞凋亡/坏死检测试剂盒(ENZ-51002-100,美国ENZO公司);AO/EB双荧光染色试剂盒(DA0039,雷根生物公司)。
1.1.3仪器 灭菌器(型号:HVE-50)购于日本Hirayama公司;CO2培养箱(型号:9040-0112)购于德国Binder公司;荧光显微镜(型号:XD30A-RFL)购于宁波舜宇仪器有限公司;高速离心机(型号:FC5515R)购于德国Eppendorf公司;酶标仪(型号:INFINITE 200 PRO)购于瑞士Tecan公司;流式细胞仪(型号:FACS Verse)购于美国 BD 公司;低速离心机(型号:SC-2542)购于安徽中科中佳科学仪器有限公司;超纯水仪(型号:Smart-S15UVF)购于上海和泰仪器有限公司Smart-S15UVF;电泳仪(型号:EPA300)购于北京基昂生物科技有限公司。
1.2 方法
1.2.1细胞培养及传代 Ca Ski 细胞用RPMI 1640培养基(含10%胎牛血清、1% 青霉素-链霉素混合液)置于37 ℃、5% CO2饱和湿度培养箱中孵育,待Ca Ski细胞贴壁生长,取对数生长期细胞用于实验,0.25%胰酶消化传代。
1.2.2MTT法检测细胞增殖 以0.5、1、2、4、6、8、16、32 μmol·L-1RCE-4单用及分别与作用浓度为8 mmol·L-1的3-MA、0.4 μmol·L-1的Baf A1、30 μmol·L-1的CQ或30 μmol·L-1的Z-VAD-FMK联合使用,并设置对照组,每组设定5个复孔,检测对Ca Ski细胞的增殖抑制效果。收集对数生长期Ca Ski细胞,调整细胞悬液浓度并以1×107个·L-1的细胞浓度种96孔板,每孔加入100 μL,四周用PBS液封,于37 ℃、5% CO2饱和湿度培养箱孵育,待细胞贴壁后:分别设置空白对照组;3-MA组;Baf A1组;CQ组;Z-VAD-FMK组;RCE-4组;RCE-4+3-MA组;RCE-4+Baf A1 组;RCE-4+CQ组;RCE-4+ Z-VAD-FMK组;RCE-4+Beclin 1 siRNA组;RCE-4+Bcl-2 siRNA组。反应48 h后每孔加入5 g·L-1MTT工作液20 μL,避光孵育4 h后,每孔加入150 μL DMSO,室温震荡3 min。在酶标仪上492 nm波长处测定各孔的吸光度值,计算对细胞的抑制率。细胞抑制率(%)=1-(加药孔吸光度值-空白孔吸光度值)/(对照孔吸光度值-空白孔吸光度值)×100%,每组重复3次,取平均值。
1.2.3AO/EB染色观察凋亡细胞形态学变化 取对数生长期的Ca Ski细胞以2×108个·L-1的单细胞悬液1 mL接种于24孔板中,待细胞贴壁后,分别设置空白对照组;RCE-4组;Z-VAD-FMK组;RCE-4+Z-VAD-FMK组;RCE-4+Beclin 1 siRNA组。于37°C、5% CO2饱和湿度培养箱孵育12 h后,收集细胞,用PBS冲洗2次,AO Stain Buffer 1×清洗细胞1次,加入适量的AO Stain Buffer 1×重悬细胞,按照细胞悬液 ∶AO Stain=19 ∶1的比例混合,并加入适量AO、EB染色液,轻轻混匀,室温避光染色15 min,在荧光显微镜(激发滤光片波长488 nm,阻断滤光片波长515 nm)下观察凋亡细胞形态学变化,计数并拍照。
1.2.4流式细胞仪检测细胞凋亡率 细胞瓶传代培养细胞,细胞贴壁生长至80%左右时,分别设置空白对照组;3-MA组;Baf A1组;CQ组;Z-VAD-FMK组;RCE-4组;RCE-4+3-MA组;RCE-4+Baf A1 组;RCE-4+CQ组;RCE-4+ Z-VAD-FMK组;RCE-4+Beclin 1 siRNA组。反应24 h后将培养基吸入离心管中,向培养瓶中加3-5 mL PBS清洗两次,加3-5 mL不含EDTA的胰酶消化收集细胞。收集细胞,离心,去上清,PBS清洗两次(3 000 r·min-1,3 min),晾干,按照Buffer ∶水=1 ∶9配制细胞混悬液,按照悬液 ∶染色液=100 ∶1的比例加入适量凋亡、坏死染色试剂,轻轻混匀,室温避光染色15 min,流式细胞仪进行检测。
1.2.5Western blot检测自噬及凋亡相关蛋白表达 取对数生长期的Ca Ski细胞用RCE-4单用或与3-MA、Baf A1、CQ、Z-VAD-FMK、Beclin 1 siRNA、Bcl-2 siRNA联合应用处理后,于37 ℃、5% CO2饱和湿度培养箱中孵育24 h后,收集细胞,提取Ca Ski细胞蛋白,蛋白定量后,加样品缓冲液煮沸5 min,各取20 μL加样。样品经SDS-PAGE分离,转移至PVDF膜上。5%脱脂奶封闭2 h后,用TBST洗涤3次×10 min,一抗(1 ∶1 000)4 ℃孵育过夜,洗涤3次×10 min,加二抗(1 ∶5 000)室温孵育1 h。再用ECL试剂可视化凝胶条带,并使用发光成像系统(Tanon 5200)记录结果,使用ImageJ软件计算灰度值。

2 结果
2.1 RCE-4诱导的细胞自噬对凋亡的影响采用不同的自噬抑制剂(3-MA、CQ和Baf A1)和RCE-4共处理Ca Ski细胞,通过对细胞增殖和凋亡的评估,探索RCE-4诱导的自噬的作用以及和凋亡的关系。
2.1.1不同自噬抑制剂对RCE-4所诱导的自噬流的影响 细胞自噬包括吞噬泡的形成、自噬小体的形成、自噬小体与溶酶体融合形成自噬溶酶体、自噬溶酶体的降解4个步骤[9],自噬流是这些步骤在细胞内连续出现的动态过程,自噬流中的任一环节出现障碍自噬将无法顺利进行。3-MA可通过抑制class III PI3K而抑制自噬小体的形成,CQ可通过改变溶酶体的pH从而阻止自噬小体与溶酶体的融合,Baf A1可阻止自噬溶酶体的降解[10]。
2.1.2RCE-4与自噬抑制剂联合应用对Ca Ski细胞增殖的影响 结果如Fig 2所示,当用不同的自噬抑制剂阻断自噬流时,Ca Ski细胞对RCE-4的敏感性明显增强,其中,Baf A1与RCE-4的协同效果最佳,使RCE-4对Ca Ski细胞的IC50由4.669 μmol·L-1减少到1.368 μmol·L-1(P<0.01)。
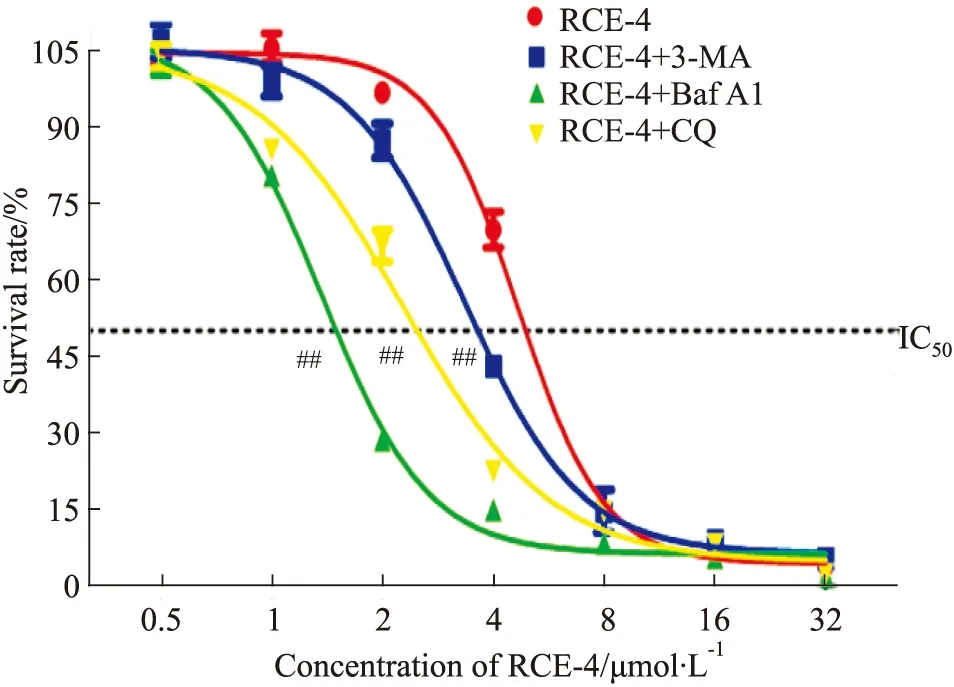
Fig 2 Proliferation of Ca Ski cells inhibited by RCE-4 combined with or without autophagy inhibitors n=3)##P<0.01 vs RCE-4
2.1.3RCE-4与自噬抑制剂联合应用对Ca Ski细胞凋亡的影响 结果如Fig 3所示,与单用RCE-4组相比,当用不同的自噬抑制剂与RCE-4联用时,细胞凋亡率明显升高,其中,Baf A1与RCE-4的协同效果最佳,使RCE-4所诱导的Ca Ski细胞凋亡率由49.96% 增加到91.08%(P<0.01)。同时,如Fig 4A,B和C所示,与单用RCE-4组相比,联用自噬抑制剂使凋亡相关蛋白cleaved caspase-3、cleaved caspase-9的表达进一步增加,Bcl-2的表达进一步降低,表明当RCE-4诱导的自噬被抑制后,其诱导的凋亡增强(P<0.01)。
2.2 RCE-4诱导的细胞凋亡对自噬的影响与上一个实验的设计相似,我们拟采用凋亡抑制剂和RCE-4共处理Ca Ski细胞,通过对细胞增殖和自噬的评估,探索RCE-4诱导的凋亡的作用以及和自噬的关系。以前的研究已证实RCE-4能诱导Ca Ski细胞发生线粒体途径的凋亡,因此,本实验选用Z-VAD-FMK来抑制凋亡。Z-VAD-FMK是一种细胞渗透性,不可逆的泛caspase抑制剂,能够抑制caspase家族蛋白酶活性从而同时阻断线粒体途径和死亡受体途径的凋亡。
2.2.1RCE-4与凋亡抑制剂联合应用对Ca Ski细胞增殖的影响 结果如Fig 5所示,当RCE-4与Z-VAD-FMK联用时,与单用RCE-4组相比,细胞增殖差异无显著性,凋亡抑制剂Z-VAD-FMK与RCE-4无协同效果。
2.2.2RCE-4与凋亡抑制剂联合应用对Ca Ski细胞自噬的影响 结果如Fig 6所示,当RCE-4与Z-VAD-FMK联用时,与单用RCE-4组相比,LC3II、Beclin 1、p-Beclin 1、ATG 4B、ATG 14的表达量降低,表明当RCE-4诱导的凋亡被部分抑制时,其诱导的自噬也相应被削弱(P<0.01)。
2.3 Beclin 1在RCE-4诱导的细胞凋亡自噬互反馈调控中的作用Beclin 1是自噬进程的关键调控因子之一,它可以与HMGB-1、ATG 14、Vps34、Vps15等自噬相关蛋白结合,形成不同的复合体,在不同阶段参与自噬的进程[11]。考虑到Beclin 1的重要性,我们用siRNA 质粒将其沉默,以观察Beclin 1对RCE-4所诱导的凋亡和自噬的影响。
2.3.1RCE-4与Beclin 1 siRNA联合应用对Ca Ski细胞增殖的影响 结果如Fig 7所示,当应用Beclin 1 siRNA处理后,Ca Ski细胞对RCE-4的敏感性明显增强(P<0.01),使RCE-4对Ca Ski细胞的IC50由4.669 μmol·L-1减少到1.538 μmol·L-1。
2.3.2RCE-4与Beclin 1 siRNA联合应用对Ca Ski细胞凋亡的影响 结果如Fig 9所示,不管是单用Beclin 1 siRNA还是与RCE-4共处理Ca Ski 细胞,Beclin 1的表达均被明显抑制,表明Beclin 1 siRNA发挥了作用。同时,与单用RCE-4组相比,Beclin 1siRNA与RCE-4共处理组中cleaved caspase-3/7/9和Bax的表达均明显增加(P<0.01),而抗凋亡蛋白Bcl-2的表达则明显降低(P<0.01),表明抑制Beclin 1促进了RCE-4诱导的Ca Ski细胞凋亡,Beclin 1在RCE-4诱导的凋亡和自噬互反馈调控中扮演了重要角色。
2.4 RCE-4与Bcl-2 siRNA 的联合应用Bcl-2因具有拮抗细胞凋亡的功能而被广泛熟知,但现有研究发现Bcl-2同时也是凋亡自噬互反馈调控的关键联系蛋白之一[12]。因此,我们也重点考察了Bcl-2在RCE-4所诱导的凋亡自噬互反馈调控中的作用。
2.4.1RCE-4与Bcl-2 siRNA联合应用对Ca Ski细胞增殖的影响 结果如Fig 10所示,当应用Bcl-2 siRNA处理后,Ca Ski细胞对RCE-4的敏感性明显增强(P<0.01),使RCE-4对Ca Ski细胞的IC50由4.669 μmol·L-1减少到1.582 μmol·L-1,表明Bcl-2在RCE-4诱导的凋亡和自噬互反馈调控中扮演了重要角色。

Fig 4 Expression of apoptosis related proteins in Ca Ski cells treated with RCE-4 combined with or without autophagy inhibitors n=3)*P<0.05 vs control,**P<0.01 vs control,##P<0.01 vs RCE-4
2.4.2RCE-4与Bcl-2 siRNA联合应用对Ca Ski细胞自噬的影响 结果如Fig 11所示,不管是单用Bcl-2 siRNA还是与RCE-4共处理Ca Ski 细胞,Bcl-2的表达均被明显抑制,表明Bcl-2 siRNA发挥了作用。同时,与单用RCE-4组相比,Bcl-2 siRNA与RCE-4共处理组中Beclin 1、p-Beclin 1、LC3II、ATG 4B和ATG 14的表达均明显增加(P<0.01),表明抑制Bcl-2促进了RCE-4诱导的Ca Ski细胞自噬。
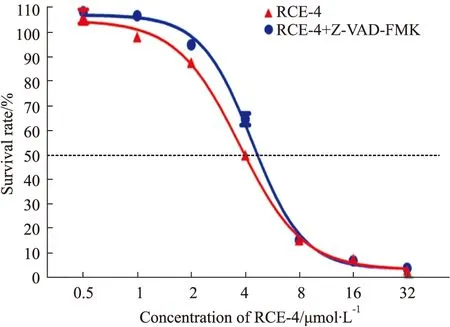
Fig 5 Proliferation of Ca Ski cells inhibited by RCE-4 combined with or without apoptosis inhibitors n=3)

Fig 6 Expression of autophagy related proteins in Ca Ski cells treated with RCE-4 combined with or without apoptosis inhibitors n=3)**P<0.01 vs control,##P<0.01 vs RCE-4.
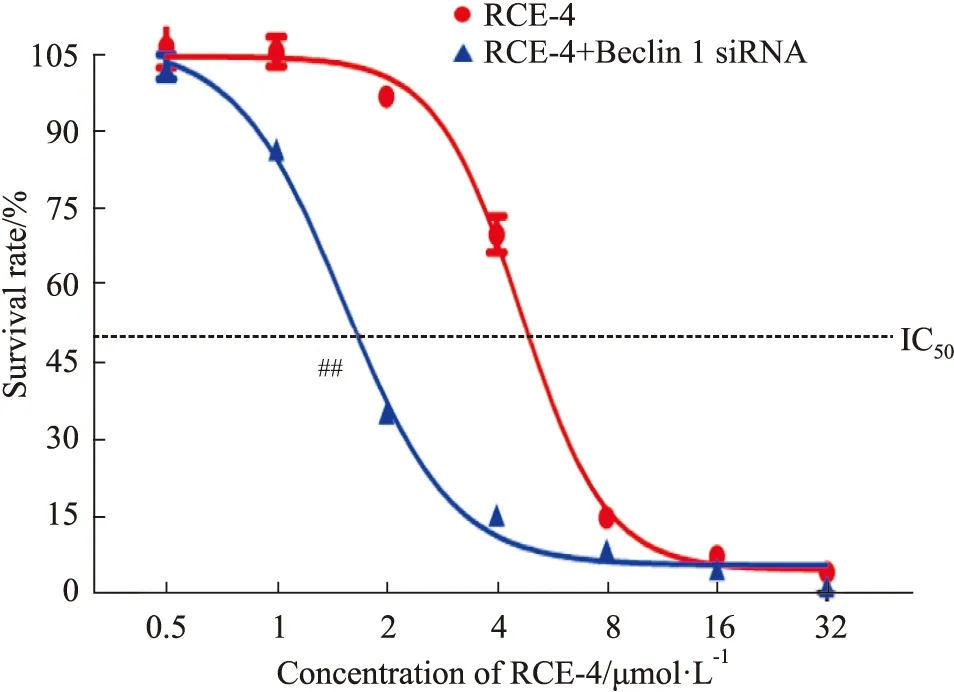
Fig 7 Proliferation of Ca Ski cells inhibited by RCE-4 combined with or without Beclin 1 siRNA n=3)##P<0.01 vs RCE-4.
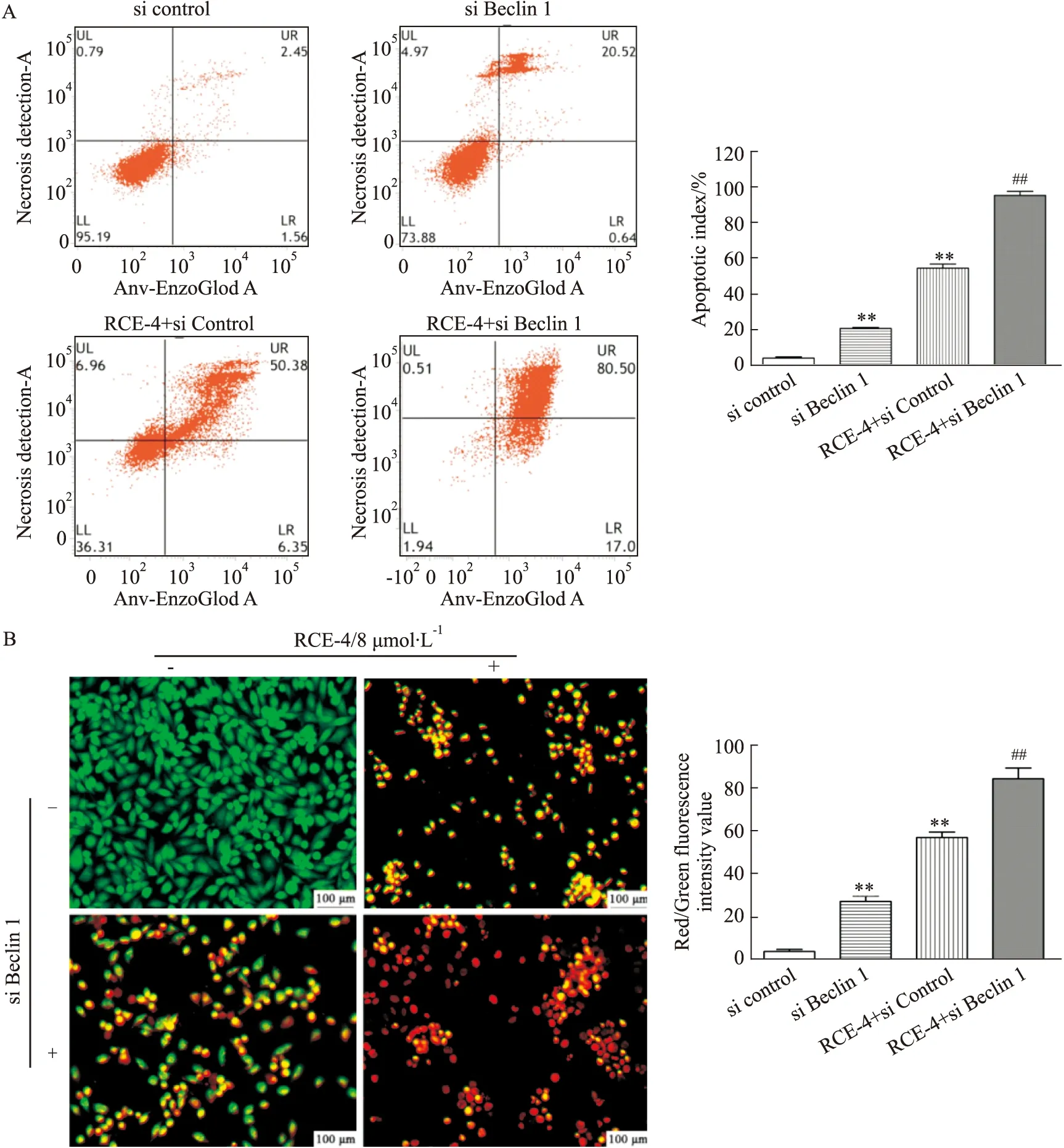
Fig 8 Effect of RCE-4 combined with Beclin 1 siRNA on apoptosis of Ca Ski cells n=3)Scale:400×.**P<0.01 vs control,##P<0.01 vs RCE-4.

Fig 9 Expression of apoptosis-related proteins in Ca Ski cells treated with RCE-4 combined with or without Beclin 1 siRNA n=3)**P<0.01 vs control,##P<0.01 vs RCE-4.

Fig 10 Proliferation of Ca Ski cells inhibited by RCE-4 combined with or without Bcl-2 siRNA n=3)##P<0.01 vs RCE-4.
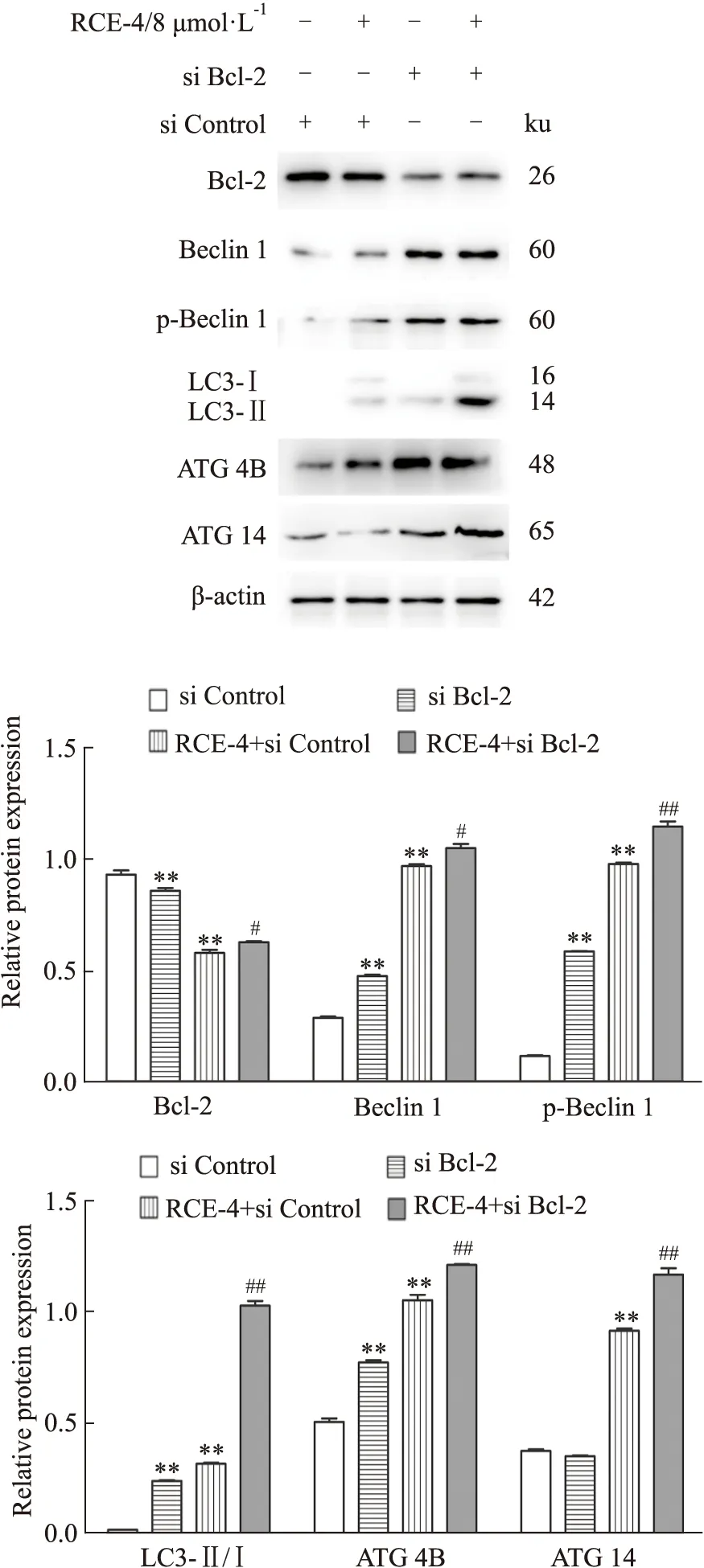
Fig 11 Expression of apoptosis-related proteins in Ca Ski cells treated with RCE-4 combined with or without Bcl-2 siRNA n=3)**P<0.01 vs control,#P<0.05 vs RCE-4,##P<0.01 vs RCE-4.
3 讨论
本研究中,我们首次解析了凋亡和自噬在RCE-4所诱导的Ca Ski细胞程序性死亡中的作用。首先,应用3种作用于自噬流不同阶段的抑制剂与RCE-4共处理Ca Ski细胞后,Ca Ski细胞对RCE-4的敏感性和凋亡率均得到不同程度的增强,表明RCE-4所诱导的自噬可能是保护性的,对于Ca Ski细胞是一种存活机制。一般情况下,当肿瘤细胞受到外界刺激(如化疗)后,诱发的自噬可以通过加速受损细胞器或蛋白聚集物的清除,使大分子物质得以循环利用,保护肿瘤细胞免于死亡,这也是肿瘤细胞对抗化疗,产生耐药性的机制之一[13-14];在3种自噬抑制剂中,Baf A1对RCE-4的协同效果最好,这可能是由于Baf A1阻断了自噬流的最后一道关卡—自噬溶酶体的降解,对自噬流的阻断最为彻底,凋亡得到了最大程度的激活所致。需要指出的是,虽然诱导的自噬是保护性的,但这并不表明促进自噬就能降低细胞死亡,自噬在肿瘤细胞中常常扮演“双刃剑”的角色,过度激活的自噬很可能会导致细胞的自噬性死亡以及凋亡增加,细胞的死亡反而会进一步增加[15-16]。
其次,我们应用凋亡抑制剂Z-VAD-FMK与RCE-4共处理Ca Ski细胞,结果发现,当凋亡被部分抑制时,自噬水平也相应降低,表明RCE-4诱导的凋亡对触发自噬起着重要作用。另外,相对于单用RCE-4组,凋亡抑制剂Z-VAD-FMK与RCE-4联用时细胞死亡情况并没有发生统计学变化,推测其原因可能是Z-VAD-FMK只是部分的抑制了凋亡。另外,联用时其诱导的自噬也相应的被削弱,其保护性作用降低,故综合来看,细胞的程序性死亡进程没有受到太大的影响。
自噬起始因子Beclin l和抗凋亡蛋白Bcl-2在凋亡和自噬的信号转导通路以及相互作用中扮演了关键角色[11,17]。比如Beclin l可被Bcl-2家族中的促凋亡蛋白Bax裂解成“C端片段”和“N端片段”而失去诱导自噬的能力,裂解的Beclin 1碎片可进入线粒体内,促进细胞色素C的释放,进而启动细胞凋亡[17]。Bcl-2可以通过BH3结构域与Beclin1结合形成Bcl-2-Beclin 1复合体,该复合体被认为是细胞程序性死亡进程的“核心”和“总开关”[18]。鉴于此,我们应用siRNA来分别沉默其表达,探索其在RCE-4所诱导的凋亡和自噬互作中的作用。结果显示,当Beclin 1的表达被抑制之后,自噬流被阻断,RCE-4诱导的凋亡率则显著增强,表明Beclin 1在RCE-4诱导的凋亡中起着负调控作用,下调Beclin 1有利于凋亡的发生。而应用Bcl-2 siRNA之后则明显不同,抑制Bcl-2既明显增强了自噬,也增强了RCE-4诱导的凋亡以及细胞死亡。推测其原因,可能是此时自噬处于过度活化的状态,导致细胞发生自噬性死亡,从而导致RCE-4对Ca Ski细胞的抑制作用更为明显。因此,Bcl-2在RCE-4诱导的自噬中也起着负调控作用,下调Bcl-2有助于凋亡和自噬的深度激活,从而增强Ca Ski细胞对RCE-4的敏感性。
综上所述,本研究首次阐明了凋亡和自噬在RCE-4所诱导的Ca Ski细胞程序性死亡中的作用。在RCE-4诱导的Ca Ski细胞程序性死亡中,凋亡占据着主导地位,对触发自噬起着重要作用,而自噬则起着保护细胞、拮抗凋亡的作用。自噬抑制剂Baf A1和RCE-4有最佳的协同作用,Beclin 1和Bcl-2在RCE-4诱导的Ca Ski细胞程序性死亡中起着关键的负调控作用,可通过对其的抑制来增强Ca Ski细胞对RCE-4的敏感性,以降低RCE-4用药剂量,提高其疗效。
(致谢:本研究在三峡大学生物与制药学院天然产物研究与利用湖北省重点实验室完成,衷心感谢本研究的指导老师和各位参与者!)