CysLT1R对APP-HEK293细胞Aβ生成的调控作用及其机制
2021-12-16龙燕,柯璇,洪浩
龙 燕,柯 璇,洪 浩
(中国药科大学药学院药理系,江苏 南京 211198)
淀粉样蛋白-β(Aβ)是阿尔茨海默病(Alzheimer′s disease,AD)的主要病理标志,Aβ诱导的神经毒性和神经纤维缠结被认为是引起和延续AD神经退行性过程的关键事件。Aβ级联假说认为Aβ在脑内异常升高、聚集、交联、沉积形成老年斑(senile plaque,SP),造成神经元变性、坏死、突触可塑性下降和记忆障碍。Aβ主要有Aβ1-42和Aβ1-40两种,其中Aβ1-42的疏水性更强,更易形成寡聚体,形成SP沉淀的核心。Aβ通过β分泌酶和γ分泌酶先后剪切β淀粉样蛋白前体蛋白(amyloid β-protein precursor,APP)而产生[1]。正常情况下,Aβ的产生和清除保持平衡,但是当APP基因突变、APP裂解酶或Aβ降解酶中任一者功能异常时,Aβ产生和清除间的平衡就被打破,Aβ异常升高导致级联病理损伤,形成AD[2]。
半胱氨酰白三烯受体1(cysteinyl leukotriene receptor 1,CysLT1R)是一种G蛋白偶联受体,由6个亲水环连接着7个跨膜疏水区组成[3]。CysLT1R在外周的气道平滑肌细胞和上皮细胞、血管内皮细胞以及嗜酸性粒细胞等均有表达,在中枢的神经元和胶质细胞也有表达[4]。有研究资料显示,生理状态下大脑CysLT1R表达水平明显低于病理状态下的水平[5],这提示CysLT1R表达上调很可能是组织器官病理反应的信号。近年来,人们研究发现基因敲除CysLT1R和药物阻断(普鲁司特和孟鲁司特)CysLT1R可通过抑制小胶质细胞激活、神经炎症和神经毒性,减轻LPS和链脲佐菌素诱导的AD样损伤[6-8];向小鼠脑海马注射CysLT1R 激动剂半胱氨酰白三烯D4(leukotriene D4,LTD4)可以降低小鼠学习记忆能力[9];而CysLT1R拮抗剂普仑司特可以显著改善Aβ诱导的AD模型小鼠认知功能障碍[10]。本课题组近期研究结果显示,AD患者海马和前额叶皮层中CysLT1R蛋白和mRNA水平明显增加[11]。以上研究均表明CysLT1R在AD的发病过程中起重要作用,但目前其作用机制仍不清楚。本研究的目的是探究CysLT1R对APP-HEK293细胞中Aβ生成的影响并探寻其可能的作用机制,为进一步阐明CysLT1R在AD发病过程中的重要作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞系 稳定表达APP的人胚胎肾293细胞(APP-HEK293)由中国药科大学徐晓军副教授课题组惠赠。
1.1.2试剂 YM17690(108806-41-3,上海康曼生物科技有限公司),普仑司特(150821-03-7,美国Sigma-Aldrich公司),LV-CysLT1R-EGFP(00015399,上海吉凯基因化学技术有限公司),DMEM培养基(12100046,美国Hyclone公司),人Aβ1-40酶联免疫试剂盒、人Aβ1-42酶联免疫试剂盒(CSB-E06928Eq、CSB-E10684h,武汉华美生物工程有限公司),兔抗APP 抗体、兔抗BACE1抗体、兔抗NF-κB p65抗体(2452S、5606S、4764T,美国CST公司),兔抗PS1抗体、兔抗PS2抗体、鼠抗CysLT1R抗体(sc-7860、sc-1456-R、sc-514181,美国Santa cruz公司),兔抗β-actin抗体、山羊抗兔二抗IgG(BM3873、BA1039,中国博士德生物工程有限公司),Alexa Fluor 488 标记驴抗兔 IgG、Alexa Fluor 594标记山羊抗小鼠IgG(34206ES60、33212ES60,上海翊圣生物科技有限公司),BCA 蛋白浓度测定试剂盒、DAPI(P0012、C1002,碧云天生物技术有限公司),膜蛋白、核蛋白和胞质蛋白抽提试剂盒(C510002,上海生工生物工程股份有限公司),Clathrin siRNA、β-arrestin-2 siRNA、Rab-5 siRNA(苏州吉玛基因股份有限公司),Lipofactamine 2000(11668-019,美国Invitrogen公司),Protein A agarose琼脂糖珠(16-156,美国Sigma-Aldrich公司)。
1.1.3仪器 RT-6000型酶标仪(深圳雷杜生命科学股份有限公司),转移电泳槽和转移电泳仪(美国Bio-Rad公司),Tanon4200 型化学发光成像分析系统、Tanon3500 型数码凝胶成像分析系统(上海天能科技有限公司),Eppendorf Master Cycler PCR仪(德国Eppendorf),DMI3000 B荧光显微镜(德国 LEICA)。
1.2 方法
1.2.1试剂的配置 含普仑司特的培养基配制:称取普仑司特0.490 5 g,溶解到1 mL PBS(0.1 mol·L-1,pH 7.4)中,得到终浓度为1.0 mol·L-1的母液。临用取1.0 μL母液,用培养基稀释至1 000 mL。含YM17690的培养基配制:称取YM17690 0.491 5 g,溶解到1 mL PBS(0.1 mol·L-1,pH 7.4)中,得到终浓度为1.0 mol·L-1的母液。临用取1.0 μL母液,用培养基稀释至1 000 mL。
1.2.2APP-HEK293细胞的病毒转染 APP-HEK293细胞接种于细胞瓶中。用促转染溶液(enhanced infection solution,Eni.S)将慢病毒稀释成病毒滴度为1×1010TU·L-1的病毒稀释液。细胞瓶中加入病毒稀释液和Polybrene(50 mg·L-1)稀释液,转染5 d(120 h)后,检查病毒转染效率。
1.2.3ELISA法检测细胞培养基中Aβ的含量 给予CysLT1R激动剂YM17690(1 μmol·L-1)及拮抗剂普仑司特(1 μmol·L-1)12 h后,收集各组细胞的培养基上清液,按照试剂盒说明书规定的方法测定细胞培养基中Aβ1-40和Aβ1-42的含量。
1.2.4Western blot法检测APP、BACE1、PS1、PS2蛋白表达水平和CysLT1R和NF-κB p65的细胞分布 药物干预后用细胞刮收集细胞,按照试剂盒说明书步骤分步提取细胞的膜蛋白、核蛋白和胞质蛋白。用BCA法检测蛋白含量,上样、电泳、转膜,加入一抗APP(1 ∶1 000)、BACE1(1 ∶1 000)、PS1(1 ∶1 000)、PS2(1 ∶1 000)、β-actin(1 ∶3 000)、CysLT1R(1 ∶1 000)、NF-κB p65(1 ∶1 000)、β-actin(1 ∶3 000)、Histone 3(1 ∶3 000)和Na+-K+-ATPase(1 ∶3 000),4 ℃过夜,洗去一抗,加入适当的二抗(1 ∶5 000),室温孵育2 h,洗去二抗,随后采用化学发光成像系统成像,蛋白条带积分光密度值用Gel-Pro扫描分析。其中以β-actin为胞质蛋白内参、Histone 3为核蛋白内参、Na+-K+-ATPase为膜蛋白内参。
1.2.5细胞免疫荧光法检测CysLT1R和NF-κB p65的细胞分布 细胞接种于24孔板中,培养过夜。给予CysLT1R激动剂YM17690(1 μmol·L-1)及拮抗剂普仑司特(1 μmol·L-1)2 h后,固定封闭处理细胞,孵育抗体CysLT1R(1 ∶200)、NF-κB p65(1 ∶200),4 ℃过夜,PBS冲洗5 min×3次。加入适当的荧光二抗(1 ∶500),室温避光孵育2 h,PBS冲洗5 min×3次,加入少量DAPI染核5 min,PBS冲洗5 min×3次,加入防淬灭甘油,Leica DMI3000荧光显微镜下观察。
1.2.6siRNA转染 将细胞接种于6孔板中。取clathrin siRNA、β-arrestin-2 siRNA、Rab-5 siRNA按说明书制成siRNA-Lipofactamine 2000复合物。6孔板加入siRNA-Lipofactamine 2000复合物后,细胞无血清培养基培养6 h后更换为完全培养基,12 h后细胞分组并开展后续药物干预实验。
1.2.7免疫共沉淀法分析CysLT1R和NF-κB p65的蛋白相互作用 单独给予CysLT1R激动剂YM17690(1 μmol·L-1)或同时给予拮抗剂普仑司特(1 μmol·L-1)2 h后,RIPA裂解液裂解细胞,离心后收集上清液,加入Protein A琼脂糖珠,离心,收集上清,弃去Protein A琼脂糖珠。BCA法测定蛋白含量,稀释蛋白至1 g·L-1,以每1 mL总蛋白中加入1 μg抗体的比例(1 ∶1 000)加入NF-κB p65抗体,4 ℃过夜,等量Normal Rabbit IgG作为阴性对照。加入Protein A琼脂糖珠,4 ℃孵育过夜。洗涤、离心,重复6次。上样缓冲液重悬琼脂糖珠-抗原抗体复合物,99 ℃变性10 min,电泳,转膜,加入一抗CysLT1R(1 ∶1 000)4 ℃过夜。洗去一抗,加入适当的二抗(1 ∶5 000),室温孵育2 h,洗去二抗,随后采用化学发光成像系统成像。

2 结果
2.1 激活CysLT1R增加APP-HEK293细胞中Aβ的生成转染LV-CysLT1R-EGFP 5 d后,Western Blot验证病毒转染效率,结果显示:与阴性对照组相比,感染LV-CysLT1R-EGFP的APP-HEK293细胞中CysLT1R表达水平明显增加(Fig 1)。ELISA检测结果显示,CysLT1R激动剂YM17690升高APP-HEK293细胞中Aβ1-40和Aβ1-42的分泌水平,而预先给予CysLT1R拮抗剂普仑司特能抑制Aβ1-40和Aβ1-42的分泌(Fig 2A、B)。
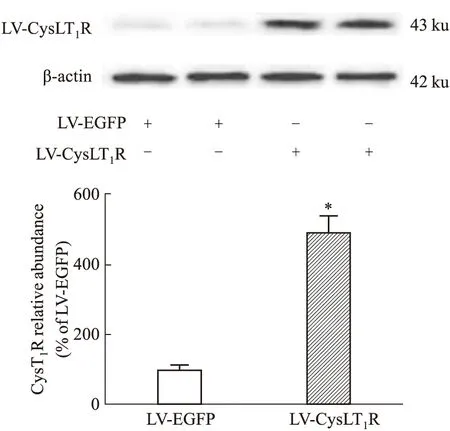
Fig 1 LV-CysLT1R-EGFP transfection significantly Western blot detection of the expression of CysLT1R in APP-HEK293 cells after LV-CysLT1R-EGFP transfection.*P<0.01 vs LV-EGFP group.
为了进一步探究CysLT1R影响Aβ生成的具体环节,给予CysLT1R激动剂YM17690(1 μmol·L-1)及拮抗剂普仑司特(1 μmol·L-1)12 h后,我们采用Western blot检测APP-HEK293细胞中APP、β分泌酶BACE1、γ分泌酶亚基PS1、PS2的表达,结果显示,激活CysLT1R对APP和PS1、PS2的表达没有影响,但能上调BACE1的表达,并且预先给予普仑司特能抑制BACE1的上调(APP:P>0.05;BACE1:P<0.05;PS1:P>0.05;PS2:P>0.05;n=4,Fig 3A-F)。
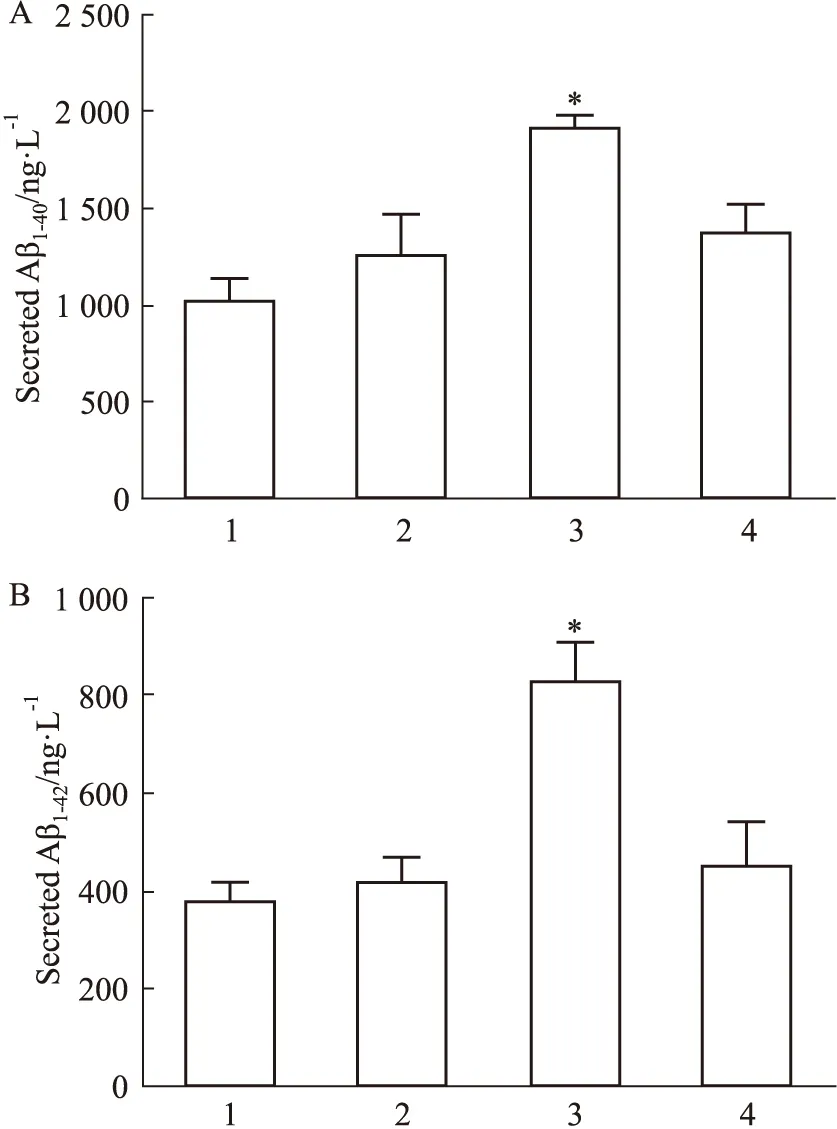
Fig 2 Activation of CysLT1R increased Aβ 1:LV-EGFP+Veh+Veh;2:LV-CysLT1R-EGFP+Veh+Veh;3:LV-CysLT1R-EGFP+YM17690+Veh;4:LV-CysLT1R-EGFP+YM17690+Pran.A:Levels of Aβ1-40 in cell culture medium;B:Levels of Aβ1-42 in cell culture medium.*P<0.05 vs LV-CysLT1R-EGFP+Veh+Veh group.
2.2 激活CysLT1R引起受体和NF-κB p65亚基的核转位GPCR在激活后往往发生内化从而下调细胞表面受体的水平,因此,我们观察CysLT1R激活后细胞内受体的分布情况。Western blot结果显示,激活CysLT1R使细胞膜及细胞质中受体水平明显下降,而细胞核中受体水平升高,并且预先给予普仑司特能抑制受体分布的这种变化(Fig 4A-C)。免疫荧光实验也证实了这一结果(Fig 5)。已有研究表明,CysLT1R的激活与NF-κB信号通路有关[10],为此我们研究了NF-κB p65亚基的细胞分布情况。Western blot结果显示,激活CysLT1R使细胞质中NF-κB p65亚基水平下降,而细胞核中其水平升高,并且预先给予普仑司特能抑制NF-κB p65亚基的分布变化(Fig 6A、B)。
2.3 抑制CysLT1R核转位减少细胞中Aβ的生成已有文献报道,CysLT1R的内化依赖于clathrin、β-arrestin-2和Rab-5等蛋白的辅助[12],为了探究CysLT1R对Aβ生成的影响是否与其内化后的核转位相关,我们首先应用siRNA分别敲减上述三个内化辅助因子。Western blot结果显示,敲减clathrin和β-arrestin-2显著抑制了APP-HEK293细胞中CysLT1R激活后发生的受体核转位,而敲减Rab-5对此无明显影响(Fig 7A-F)。免疫荧光实验也证实了这一结果(Fig 7G、H)。检测Aβ结果显示,敲减clathrin和β-arrestin-2显著抑制Aβ1-40和Aβ1-42的分泌,而敲减Rab-5对此无明显影响(Fig 7F-H)。此外,敲减clathrin和β-arrestin-2还显著抑制BACE1的表达,而对APP的表达没有明显影响(Fig 8A-C)。
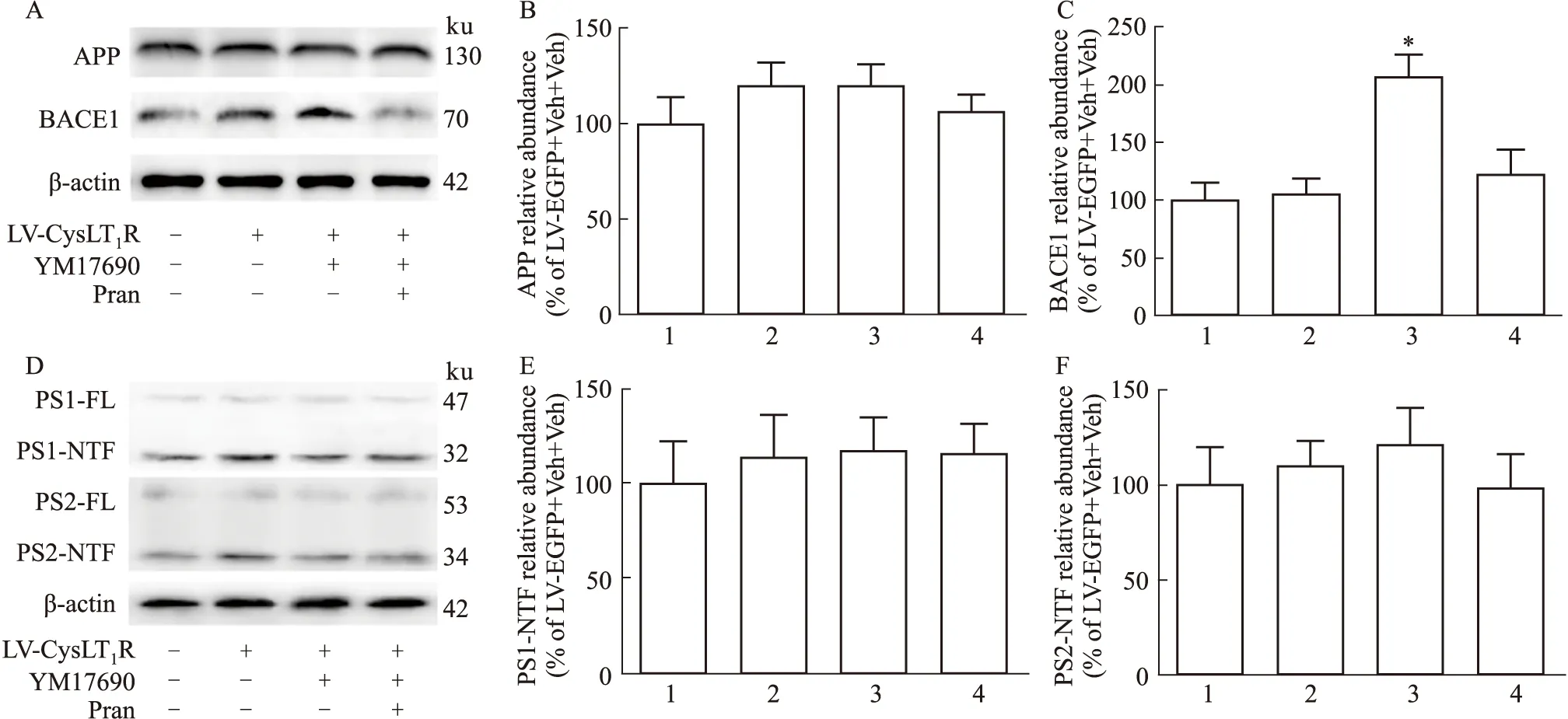
Fig 3 Effect of CysLT1R activity on expression of APP,BACE1,PS1,1:LV-EGFP+Veh+Veh;2:LV-CysLT1R-EGFP+Veh+Veh;3:LV-CysLT1R-EGFP+YM17690+Veh;4:LV-CysLT1R-EGFP+YM17690+Pran.A:Expression of APP and BACE1 in APP-HEK293 cells after administration of YM17690 (1 μmol·L-1)and pranlukast (1 μmol·L-1)for 12 h;B:Statistical analysis of the expression of APP;C:Statistical analysis of the expression of BACE1;D:Expression of PS1 and PS2 in APP-HEK293 cells after administration of YM17690 (1 μmol·L-1)and pranlukast (1 μmol·L-1)for 12 h;E:Statistical analysis of the expression of PS1;F:Statistical analysis of the expression of PS2.*P<0.05 vs LV-CysLT1R-EGFP+Veh+Veh group.
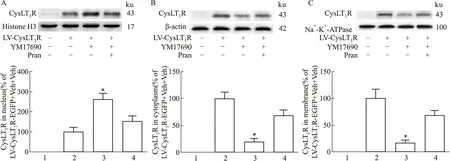
Fig 4 Nuclear translocation of CysLT1R by Western 1:LV-EGFP+Veh+Veh;2:LV-CysLT1R-EGFP+Veh+Veh;3:LV-CysLT1R-EGFP+YM17690+Veh;4:LV-CysLT1R-EGFP+YM17690+Pran.A:The expression of CysLT1R in nucleus.B:The expression of CysLT1R in cytoplasm.C:The expression of CysLT1R on the cell membrane.*P<0.05 vs LV-CysLT1R-EGFP+Veh+Veh group.
2.4 抑制CysLT1R核转位能抑制NF-κB p65亚基的核转位CysLT1R核转位与NF-κB信号通路的相关性研究结果显示,敲减clathrin和β-arrestin-2能抑制NF-κB p65亚基的核转位(Fig 9A、B)。
2.5 CysLT1R与NF-κB p65亚基在细胞核内存在相互作用为了研究CysLT1R入核的意义,我们采用免疫共沉淀法研究了CysLT1R与NF-κB p65亚基是否存在相互作用。结果显示,单独给予YM17690激活CysLT1R时,核蛋白提取物经anti-NF-κB p65抗体沉淀后仍能检测到CysLT1R蛋白,表明CysLT1R与NF-κB p65亚基间存在相互作用,而预先给予普仑司特能抑制两者之间的这种相互作用(Fig 10A)。而在其胞质蛋白提取物中暂未发现CysLT1R与NF-κB p65亚基的相互作用(Fig 10B)。
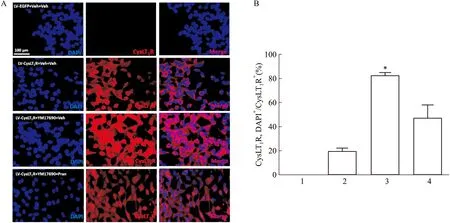
Fig 5 Nuclear translocation of CysLT1R by cell immunofluorescence 1:LV-EGFP+Veh+Veh;2:LV-CysLT1R-EGFP+Veh+Veh;3:LV-CysLT1R-EGFP+YM17690+Veh;4:LV-CysLT1R-EGFP+YM17690+Pran.A:The location of CysLT1R in the nucleus;B:Statistical results of the nuclear localization of CysLT1R.*P<0.05 vs LV-CysLT1R-EGFP+Veh+Veh group.
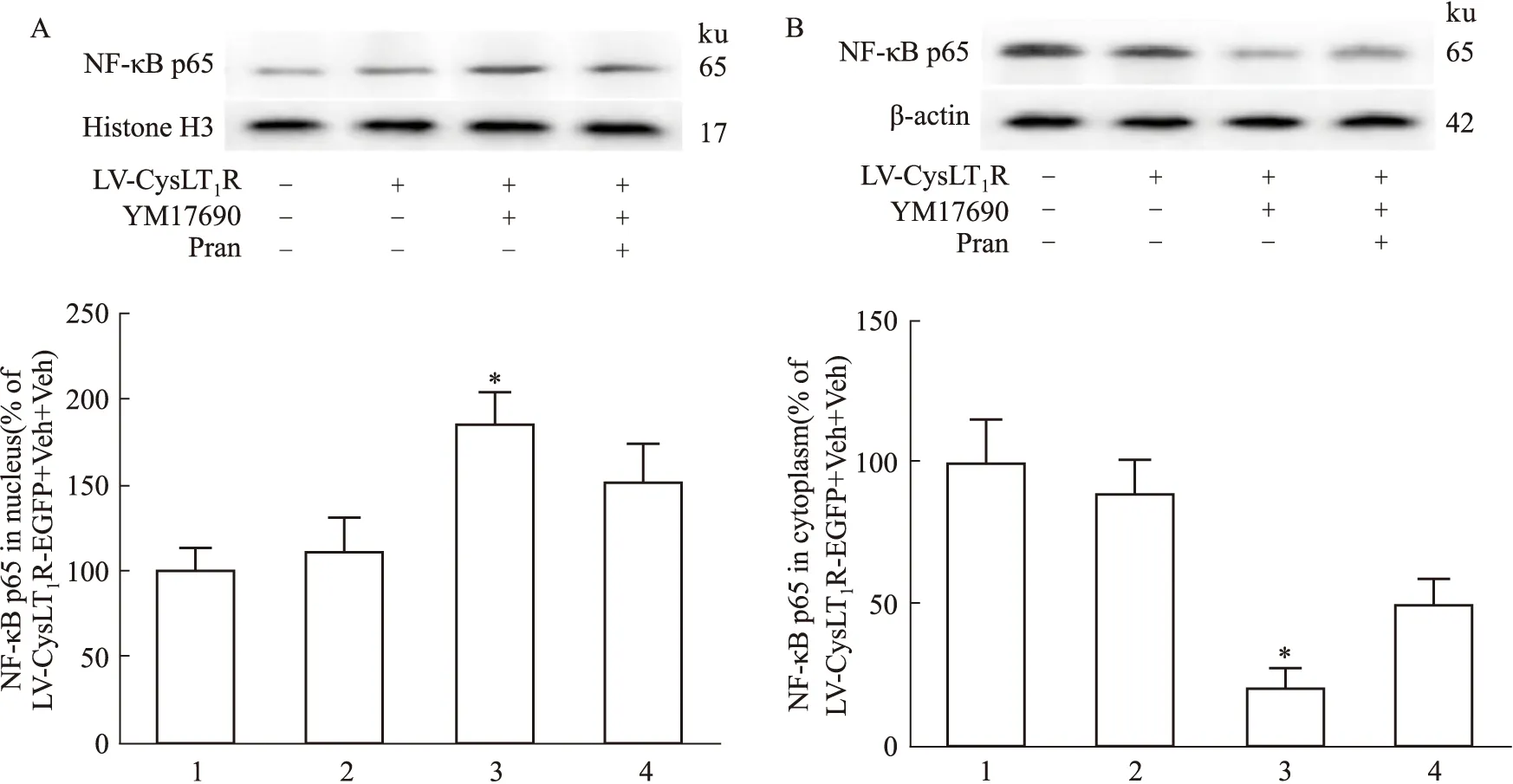
Fig 6 Nuclear translocation of NF-κB p65 1:LV-EGFP+Veh+Veh;2:LV-CysLT1R-EGFP+Veh+Veh;3:LV-CysLT1R-EGFP+YM17690+Veh;4:LV-CysLT1R-EGFP+YM17690+Pran.A:The distribution of NF-κB p65 subunit in nucleus;B:The distribution of NF-κB p65 subunit in cytoplasm.*P<0.05 vs LV-CysLT1R-EGFP+Veh+Veh group.
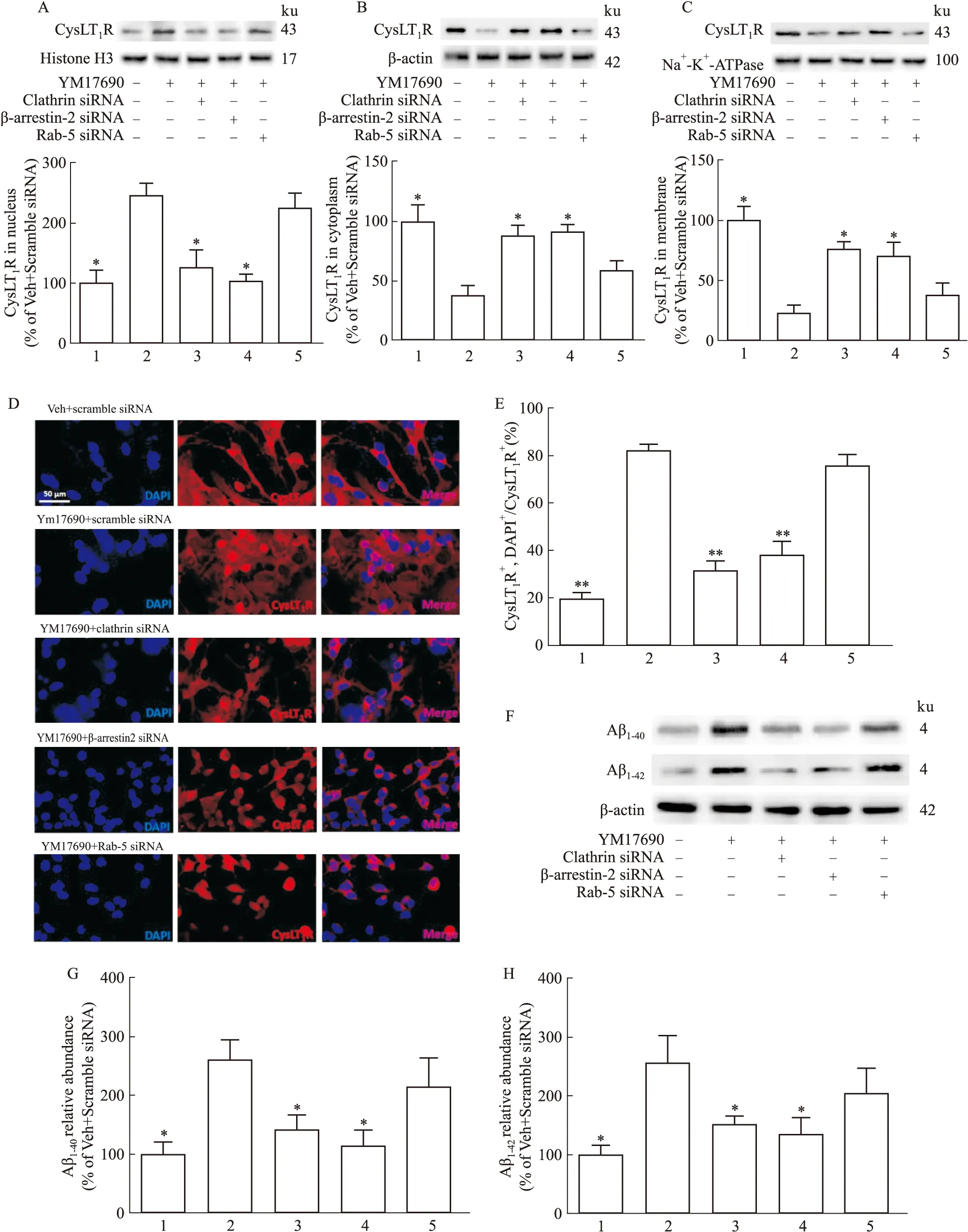
Fig 7 Inhibition of nuclear translocation of CysLT1R reduces Aβ production in 1:Veh+Scramble siRNA;2:YM17690+Scramble siRNA;3:YM17690+Clathrin siRNA;4:YM17690+β-arrestin-2 siRNA;5:YM17690+Rab-5 siRNA.A-C:Expression of CysLT1R in nucleus,cytoplasm and cell membrane by Western blot and the statistical results;D-E:Expression of CysLT1R in nucleus,cytoplasm and cell membrane by cell immunofluorescence staining and the statistical results;F-H:Levels of Aβ1-40 and Aβ1-42 by Western blot and the statistical results.*P<0.05 vs YM17690+Scramble siRNA group.
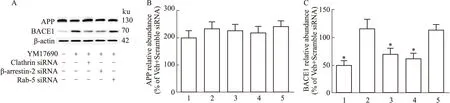
Fig 8 Inhibition of nuclear translocation of CysLT1R reduced BACE1 1:Veh+Scramble siRNA;2:YM17690+Scramble siRNA;3:YM17690+Clathrin siRNA;4:YM17690+β-arrestin-2 siRNA;5:YM17690+Rab-5 siRNA.A-C:Expression of BACE1 and APP by Western blot and the statistical results.*P<0.05 vs YM17690+Scramble siRNA group.

Fig 9 Knockdown of clathrin and β-arrestin-2 inhibited nuclear translocation of NF-κB p65 1:Veh+Scramble siRNA;2:YM17690+Scramble siRNA;3:YM17690+Clathrin siRNA;4:YM17690+β-arrestin-2 siRNA;5:YM17690+Rab-5 siRNA.A:The distribution of NF-κB p65 subunit in nucleus by Western blot and the statistical results.B:The distribution of NF-κB p65 subunit in cytoplasm by Western blot and the statistical results.*P<0.05 vs YM17690+Scramble siRNA group.
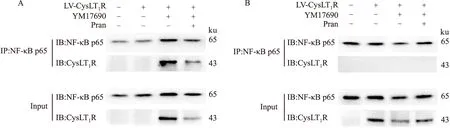
Fig 10 CysLT1R interacted with NF-κB p65 subunit in nucleusA:The nucleoprotein extracts were prepared and co-immunoprecipitated by NF-κB antibody with IgG as negative control.B:The cytoplasmic extracts were prepared and co-immunoprecipitated by NF-κB antibody with IgG as negative control.
3 讨论
有研究表明,CysLT1R参与并调节AD的发病过程[8-11],并且CysLT1R在脑内表达随年龄的增长而增加,这与Aβ沉积增加和行为缺陷密切相关[13]。但目前对CysLT1R调节Aβ积累的具体作用机制的研究仍较匮乏,同时CysLT1R与NF-κB途径之间的关系也需进一步阐明。YM17690 是一种选择性CysLT1R激动剂,其远远优于LTD4的化学稳定性使它逐渐成为研究CysLT1R特性的一个重要工具药物[9-10]。因此,本实验采用 YM17690 作为CysLT1R特异性激动剂。
CysLT1R是一种G蛋白偶联受体,由6个亲水环连接着7个跨膜疏水区组成[4]。长久以来,GPCR都被视为是一类细胞表面受体,近年来,已发现越来越多的GPCR在细胞内其他的一些区室发挥作用,如细胞核、线粒体、内质网等。目前已发现超过40种细胞核GPCR,细胞核GPCR大部分来源于质膜转位[14]。已经有大量的研究表明,GPCR内化的最可能机制是通过clathrin包被的小泡进行内吞[15]。2005年首次有研究报道在细胞核中观察到了CysLT1R[16]。此后的研究表明,如同多数GPCR一样,CysLT1R在质膜被激活后随即经内吞作用发生内化。CysLT1R的内化由clathrin、β-arrestin-2和Rab-5共同介导[12]。基于此,我们使用siRNA在APP-HEK293细胞中分别敲减上述三种蛋白。结果显示,敲减clathrin或β-arrestin-2可以有效抑制CysLT1R的核转位,而敲减Rab-5对此无影响。Rab-5介导的内体融合通常标志着受体进入降解程序[12],这提示我们本实验中高表达CysLT1R受体的APP-HEK293细胞受体内化后的去路是核转位,并且CysLT1R的核转位是其参与Aβ生成调控的必要环节。
有研究表明,Aβ激活NF-κB有2种可能机制:一种是通过RAGE间接激活,一种是直接激活方式[17]。并且,Aβ1-42诱导NF-κB报告基因的转录,诱导NF-κB p65亚基向细胞核移位[18]。本实验中,我们还发现激活CysLT1R可以引起NF-κB p65亚基的核转位,CysLT1R与NF-κB p65亚基间在细胞核内相互结合。因此,我们有理由推测,激活CysLT1R引起受体内化与核转位,从而上调BACE1表达进而诱导细胞生成Aβ1-42,后者诱导NF-κB p65亚基向细胞核转位。而NF-κB p65亚基向细胞核移位是激活NF-κB信号通路的重要步骤,从而进一步促进Aβ生成,最终导致AD的淀粉样变性和神经退行性变。当然,CysLT1R与NF-κB p65亚基间在细胞核内相互结合说明这两种蛋白之间存在相互作用,这种相互作用对NF-κB信号通路产生何种影响仍需进一步探究。
综上所述,CysLT1R的核转位及核分布参与了NF-κB信号通路的激活,这与该受体诱导Aβ的生成有关。