芦荟大黄素衍生物AE-YJ通过PI3K-Akt/NF-κB和MAPK/NF-κB途径抑制LPS诱导RAW264.7细胞炎症介质的释放
2021-12-16马丽炎李陵宇邹忠梅
郭 静,尚 海,马丽炎,高 源,李陵宇,邹忠梅,宛 蕾
(1.贵州医科大学基础医学院,贵阳 贵州 550025;2.中国医学科学院北京协和医学院药用植物研究所,北京 100193)
炎症定义为免疫系统对微生物入侵或伤害的局部保护反应[1]。但值得注意的是,过度的炎症会损害身体[2]。巨噬细胞作为重要的免疫细胞充当抵御入侵物(细菌、病毒和真菌)的第一道防线[3]。在炎症过程中,巨噬细胞产生过量的炎症介质[4],例如PGE2、NO、TNF-α、IL-6、IL-1β等,继而引发一系列炎症反应。炎症与许多疾病相关,并且由于其复杂性很难被治愈[5]。
炎症通过不同途径起作用。NF-κB作为炎症发生的一条重要途径,是炎症和抗炎的核心[6]。细胞外刺激(例如IL-1β和TNF-α)可触发NF-κB途径激活。NF-κB信号通路的起始端由信号分子结合膜受体(例如TLR4)进行信号传导,激活IKK激酶。IKK是IκB的激酶,可以促进IκB的磷酸化,磷酸化的IκB被泛素化降解,使得NF-κB脱离出来从胞质入核,激活下游基因(例如iNOS和COX-2)的转录[7]。NF-κB的转录活性受细胞内级联反应的调控,包括PI3K/Akt和MAPK途径。PI3K/Akt途径中,活化的Akt增加IKKα的磷酸化,激活NF-κB途径[8]。MAPK称为NF-κB的上游激活剂,可调控NF-κB途径的转录激活[9]。MAPK信号通路本身也对炎症因子的释放起着重要的调节作用[10]。研究证明,MAPK抑制剂降低LPS诱导RAW264.7细胞中NF-κB的下游效应因子,例如iNOS和COX-2的蛋白表达[11]。总之,PI3K-Akt/NF-κB和MAPK/NF-κB途径之间相对激活的微妙平衡似乎对于细胞存活和增殖基因的表达至关重要[12]。
芦荟大黄素(aloe-emodin,AE)作为一种蒽醌类天然产物,主要来源于大黄、芦荟、决明子等中药,其具有出色的抗炎活性。已有研究表明,芦荟大黄素可通过NF-κB[13],MAPK[14]和PI3K/Akt[15]等多种途径降低炎症因子(例如TNF-α、IL-1β、IL-6)的产生发挥抗炎作用。然而,芦荟大黄素的溶解度很差,在很大程度上影响了其生物利用度。因此,本研究设计合成带亲水哌嗪基团的芦荟大黄素衍生物AE-YJ。在此基础上,以LPS诱导RAW264.7细胞作为炎性细胞模型,检测AE-YJ对LPS诱导RAW264.7细胞释放炎症介质的影响,通过蛋白质印迹分析和免疫荧光的方法进一步研究对PI3K/Akt、NF-κB和MAPK信号途径的作用。
1 材料与方法
1.1 细胞株RAW264.7小鼠单核巨噬细胞白血病细胞(20042706,北京北纳创联生物技术研究院)。
1.2 药品与试剂芦荟大黄素(DL0007),成都德思特生物技术有限公司;LPS(057M4013V),美国Sigma公司;DMEM培养基(11965092),美国Gibco公司;FBS(10099-141),澳大利亚Gibco公司;ECL Western blot底物(P0018FS、BCA蛋白质检测试剂盒(P0012S)、一氧化氮检测试剂盒(S0021),中国Beyotime公司;TNF-α ELISA试剂盒(430907)、IL-6 ELISA试剂盒(431307),美国Biolegend公司;IL-1β ELISA试剂盒(1210122),深圳达科为公司;PGE2 ELISA试剂盒(ADI-930-001),美国ENZO公司;iNOS兔多克隆抗体(A18247,1 ∶1 000)、COX-2兔多克隆抗体(A1253,1 ∶1 000)、IκBα兔单克隆抗体(A19714,1 ∶1 000)、p-IκBα兔多克隆抗体(AP0614,1 ∶1000)、NF-κB p65兔单克隆抗体(A19653,1 ∶1 000)、Akt 兔单克隆抗体(A17909,1 ∶1 000)、p-Akt 兔单克隆抗体(AP1208,1 ∶1 000)、ERK1/2鼠单克隆抗体(A10613,1 ∶1 000)、p-ERK1/2鼠单克隆抗体(AP0485,1 ∶1 000)、p38 兔单克隆抗体(A4771,1 ∶1 000)、p-p38 兔多克隆抗体(AP0057,1 ∶1 000)、JNK1/JNK2/JNK3兔单克隆抗体(A4867,1 ∶1 000)、p-JNK 兔单克隆抗体(AP0613,1 ∶1 000)、组蛋白H3多克隆抗体(A2348,1 ∶1 000)、GAPDH兔单克隆抗体(AC033,1 ∶1 000)、羊抗兔IgG辣根过氧化物酶二抗(AS014,1 ∶10 000)、羊抗鼠IgG辣根过氧化物酶二抗(AS003,1 ∶10 000)、Alexa Fluor 488羊抗兔IgG辣根过氧化物酶二抗(AS053,1 ∶500),武汉ABclonal公司。
1.3 AE-YJ的结构本实验室合成了AE-YJ,见Fig 1。

Fig 1 Chemical structures of AE and AE-YJ
1.4 细胞培养RAW264.7细胞培养使用含10%热灭活的FBS含青霉素G(100 kU·L-1)和链霉素(100 mg·L-1)的DMEM培养基,在5% CO2和95%空气的潮湿环境中培养。RAW264.7细胞每隔3 d进行传代培养。将细胞用不同浓度的AE-YJ培养,并用LPS(10 μg·L-1)刺激指定的时间。在DMSO中制备AE-YJ的储备溶液,实验中所用AE-YJ为培养基稀释至指定浓度,DMSO的最终浓度小于0.5%。
1.5 小鼠腹膜原发性巨噬细胞的提取实验动物为雄性Balb/c小鼠,(18-22)g,SPF级,购自北京维通利华,SYXK(京)2016-0006,饲养于中国医学科学院药用植物研究所实验动物中心(SPF级)。所有动物实验均得到中国医学科学院药用植物研究所动物伦理委员会的批准。

1.6 AE-YJ对RAW264.7细胞活力的影响用不同浓度的AE-YJ(0、1.5625、3.125、6.25、12.5、25、50 μmol·L-1)处理RAW264.7细胞(2.0×109个·L-1)24 h,每孔加入MTT(5 g·L-1)20 μL,继续孵育4 h后弃上清,加入150 μL DMSO,振荡10 min使结晶物充分溶解。在酶标仪492 nm处读取吸光度。
1.7 NO测定将RAW264.7细胞以2.0×109个·L-1的密度接种到96孔板中,然后用10 μg·L-1LPS和AE-YJ(1.5625、3.125、6.25、12.5、25 μmol·L-1)处理24 h。收集细胞培养上清,按NO检测试剂盒操作说明检测NO含量。
1.8 NO自由基的清除根据文献报道的方法[16]测定AE-YJ对一氧化氮自由基的影响。将75 μL硝普钠(60 mmol·L-1SNP溶于PBS)溶液与75 μL不同浓度的AE-YJ在25 ℃避光孵育5 h。然后将100 μL Griess试剂添加到包含混合物的孔中,540 nm测亚硝酸盐水平。
1.9 IL-6、IL-1β、TNF-α、PGE2测定RAW264.7细胞(2.0×109个·L-1)接种至96孔板中,并用不同浓度(3.125、6.25、12.5 μmol·L-1)的AE或AE-YJ和LPS(10 μg·L-1)孵育24 h。收集细胞培养上清液后,使用LEGEND MAXTM小鼠ELISA试剂盒测定IL-6、TNF-α的浓度。用小鼠IL-1β ELISA试剂盒检测IL-1β含量。用PGE2高灵敏度ELISA试剂盒对样品中PGE2浓度进行了定量。
1.10 细胞核和细胞浆蛋白的制备RAW264.7细胞(2.0×109个·L-1)接种至6孔板中,用不同浓度(3.125、6.25、12.5 μmol·L-1)的AE-YJ处理细胞24 h,100 μg·L-1LPS刺激30 min后,按细胞核蛋白与细胞质蛋白抽提试剂盒说明分别制备细胞核蛋白和细胞质蛋白,然后进行Western印迹分析。
1.11 总mRNA提取和定量聚合酶链反应(RT-PCR)RAW264.7细胞接种在6孔板,LPS(10 μg·L-1)和AE-YJ共同处理24 h后,使用TRIzol从细胞样品中分离出总RNA。用TB GreenTMPremix Ex TaqTMⅡ将总RNA(2 μg)反转录成cDNA 20 μL。q-PCR在PIKORed 96实时PCR上进行。用于RT-PCR分析的引物序列如下。COX-2 sense-ATTCCAAACCAGCAGACTCATA,antisense-CTTGAGTTTG AAGTGGTAACCG,IL-6 sense-CTCCCAACAGACCT GTCTATAC,antisense-CCATTGCACAACTTTTCTCA;IL-1β sense-TCTCGCAGCAGCAACATCAACAAGAGC,antisense-GGAAGGTCCAAGGGAAAGACACAGGT;GAPDH sense-ATGGTGAAGGTCGGTGTGAACGGA TT,antisense-GTCTCGCTCCTGGAAGATGGTGATGG循环扩增条件如下随后:95 ℃初始变性30 s,95 ℃持续变性5 s和55 ℃持续退火30 s,72 ℃持续30 s充分延伸,采集荧光。完成45个PCR扩增周期后,进行溶解曲线分析。COX-2、IL-1β、IL-6 mRNA水平归一化为GAPDH。
1.12 蛋白质印迹分析RAW264.7细胞(2.0×109个·L-1)接种至6孔板中并生长直到85%-95%汇合度。裂解细胞后在4 ℃下离心15 min,BCA试剂盒测定蛋白质浓度后,煮沸10 min使其完全变性。用4%-20%梯度分离胶电泳分离后再转移至PVDF膜。室温下用封闭液封闭30 min,然后将膜与特异性一抗在4 ℃孵育过夜。洗膜3次后孵育对应二抗1 h。洗膜3次后在ChemDocTMXRS +成像系统(美国Bio-Rad)中获得蛋白条带。将GAPDH和H3用作过程控制的内标。用Image Lab软件进行印迹密度测定。
1.13 免疫荧光检测取对数生长期RAW264.7细胞(5.0×109个·L-1),取500 μL接种至24孔板,用不同浓度的AE-YJ(3.125、6.25、12.5 μmol·L-1)处理24 h。在100 μg·L-1LPS刺激30 min后,将细胞用4%多聚甲醛固定15 min。用0.5% Triton X-100处理10 min,然后用免疫荧光封闭液封闭1 h,用p65抗体在4 ℃孵育过夜。将细胞与Alexa Fluor 488标记的山羊抗兔IgG避光在室温下孵育1 h。在黑暗中,用抗荧光淬灭封片剂(含DAPI)封片,使用扫描电子显微镜(Ex:495 nm,Em:519 nm,Inspect,美国FEI)扫描全片。使用Caseviewer软件进行分析。

2 结果
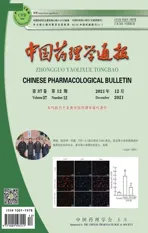
2.1 AE-YJ减少LPS诱导的RAW264.7细胞中NO的产生MTT结果显示,AE-YJ在0-25 μmol·L-1的浓度下对细胞活力无明显影响(Fig 2A)。因此,在下述实验中,AE-YJ的浓度不超过25 μmol·L-1。Griess实验显示,LPS诱导,RAW264.7细胞中的NO明显增加(P<0.01)。AE-YJ明显抑制LPS诱导产生NO(P<0.01)(Fig 2B),6.25 μmol·L-1剂量AE-YJ抑制NO作用明显强于AE(P<0.01)。AE和AE-YJ抑制LPS刺激RAW264.7细胞中NO释放的IC50分别为7.091 μmol·L-1和5.725 μmol·L-1。在小鼠腹膜原发性巨噬细胞中也得到了类似结果,AE-YJ和AE抑制LPS刺激NO释放的IC50分别为5.332 μmol·L-1和3.191 μmol·L-1(Fig 2C)。因此,AE-YJ抑制LPS诱导RAW264.7细胞释放NO并不是由细胞毒作用导致的。
2.2 AE-YJ对NO自由基无直接清除作用将不同浓度的AE-YJ(0-25 μmol·L-1)与SNP避光25 ℃孵育5 h。结果显示,AE-YJ未减少SNP溶液中NO自由基释放(Fig 3)。同时,AE也得到了相似的实验结果。因此,AE-YJ无直接清除NO自由基的作用。
2.3 AE-YJ减少LPS诱导的RAW264.7细胞促炎细胞因子的释放使用ELISA试剂盒测定培养上清中PGE2、TNF-α、IL-1β和IL-6的表达水平。结果显示(Fig 4),LPS模型组的细胞上清液中PGE2、TNF-α、IL-1β和IL-6的浓度明显增加(P<0.01)。不同浓度的AE-YJ对LPS诱导的RAW264.7细胞中PGE2、TNF-α、IL-1β和IL-6的释放具有明显的抑制作用(P<0.01)。同等剂量的AE-YJ抑制作用明显强于AE(P<0.01)。因此,AE-YJ可明显抑制RAW264.7细胞中炎症介质(如PGE2、TNF-α、IL-1β和IL-6)的释放,且抑制作用强于AE。
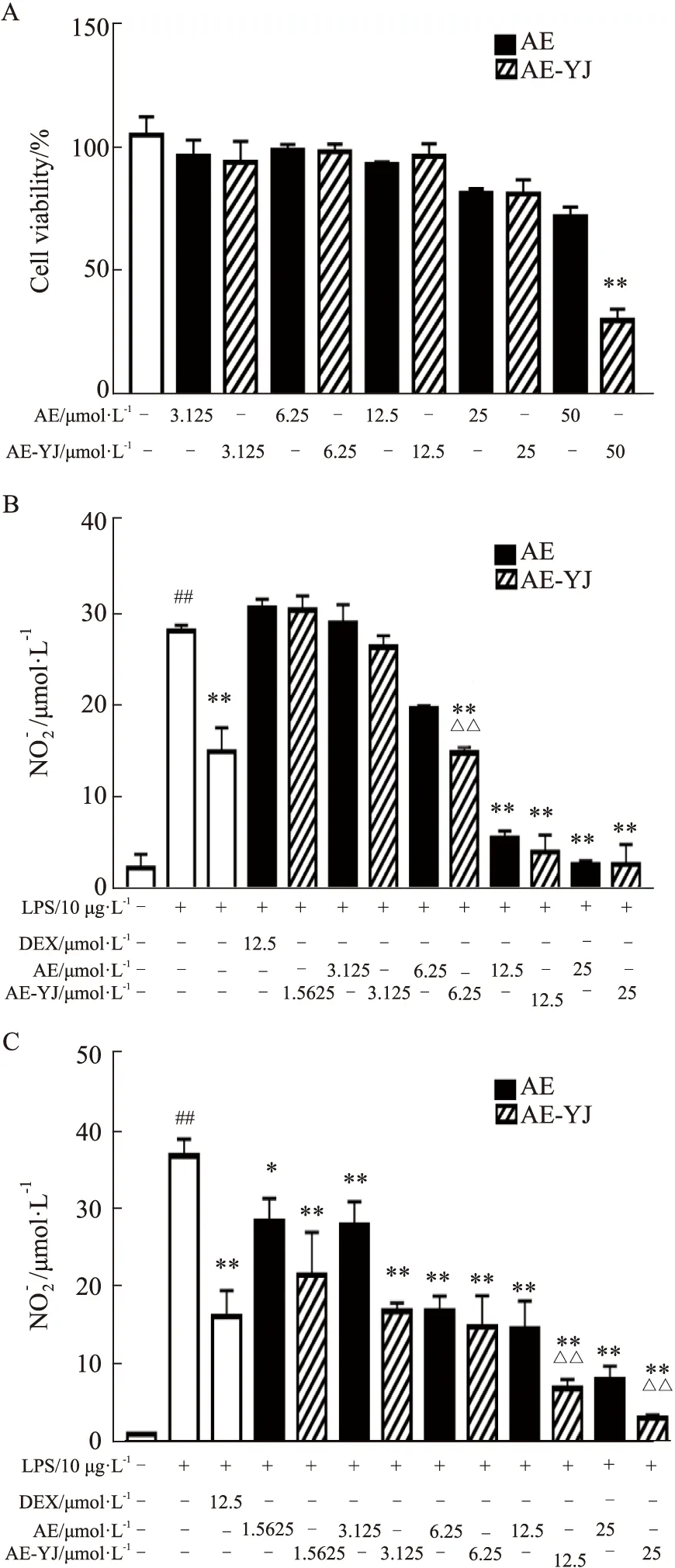
Fig 2 Effect of AE and AE-YJ on NO release ##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group;△△P<0.01 vs AE group.
2.4 AE-YJ减少LPS诱导的RAW264.7细胞中COX-2、IL-1β、IL-6 mRNA表达Fig 5所示,LPS(10 μg·L-1)模型组中IL-1β、IL-6和COX-2 mRNA的表达明显增加(P<0.01)。与LPS模型组相比,不同浓度的AE-YJ处理RAW264.7细胞24 h后,IL-1β、IL-6和COX-2 mRNA的表达水平明显降低(P<0.01)。与同等浓度处理的AE组相比,AE-YJ抑制IL-1β、IL-6和COX-2 mRNA表达的作用更强(P<0.01)。
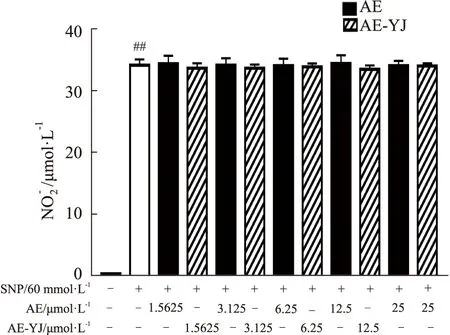
Fig 3 Effects of AE-YJ on nitric oxide radicals n=3)##P<0.01 vs control group.
2.5 AE-YJ抑制LPS刺激的RAW264.7细胞中iNOS、COX-2的蛋白表达RAW264.7细胞用LPS(10 μg·L-1)和AE-YJ处理24 h,并通过蛋白印迹法分析NF-κB信号通路中iNOS、COX-2的表达。如Fig 6所示,LPS模型组iNOS和COX-2的蛋白表达水平明显增加(P<0.01)。与LPS模型组比较,AE-YJ处理后LPS刺激的RAW264.7细胞中iNOS和COX-2的表达明显降低(P<0.01)。
2.6 AE-YJ抑制LPS刺激的RAW264.7细胞中NF-κB通路的激活LPS(100 μg·L-1)暴露促进了模型组中RAW264.7细胞中的IκBα蛋白降解(P<0.01)(Fig 7A,B)。与LPS模型组相比,AE高浓度处理可以阻碍IκBα蛋白降解(P<0.01),AE-YJ可明显抑制IκBα蛋白降解(P<0.01),但AE-YJ还显示出可以明显增加IκBα蛋白表达水平(P<0.01)。为了研究AE-YJ对NF-κB p65核易位的影响,使用蛋白质印记分析和免疫荧光法检查了 LPS刺激后p65在细胞质和细胞核的分布。如Fig 7(C,D,E,F)所示,LPS模型组RAW264.7细胞核中p65的含量明显增加(P<0.01)。与LPS模型组相比,AE-YJ的处理明显降低了p65蛋白在细胞核中含量(P<0.01)。免疫荧光结果进一步显示(Fig 7G-I),正常对照组中,p65蛋白在细胞核内几乎无表达。LPS模型组RAW264.7细胞,p65在细胞核内的含量明显增加(P<0.01)。与LPS模型组相比,AE-YJ明显减少p65蛋白进入细胞核的量(P<0.01)。这些结果表明,AE-YJ抑制LPS刺激的巨噬细胞中转录因子NF-κB p65的核易位,并且能增加IκBα的蛋白表达。因此,AE-YJ抑制了RAW264.7细胞中LPS诱导的NF-κB信号通路的激活,这可能与增加IκBα的蛋白表达有关。

Fig 4 Effects of AE and AE-YJ on inflammatory mediators released by LPS stimulated RAW 264.7 cells n=3)##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group;△△P<0.01 vs AE group.

Fig 5 Effects of AE-YJ on mRNA expression of IL-1β,IL-6 and COX-2 in LPS-stimulated RAW 264.7 cells ##P<0.01 vs control group;**P<0.01 vs LPS group;ΔΔP<0.01 vs AE group.
2.7 AE-YJ抑制LPS刺激的RAW264.7细胞中PI3K/Akt信号通路的激活如Fig 8,LPS诱导模型组RAW264.7细胞中磷酸化Akt的表达明显增加(P<0.01)。与LPS模型组相比,3.125 μmol·L-1AE-YJ处理使磷酸化Akt的表达降低75%(P<0.01),而相同浓度的AE仅使其降低30%(P<0.01)。6.25 μmol·L-1浓度下AE-YJ和AE分别使Akt的磷酸化表达降低85%(P<0.01)和65%(P<0.01)。12.5 μmol·L-1浓度下AE-YJ和AE分别使Akt的磷酸化表达降低93%(P<0.01)和90%(P<0.01)。这些结果表明,AE-YJ对Akt磷酸化的抑制作用强于AE。

Fig 6 Effects of AE-YJ on protein expression levels of iNOS,COX-2 in LPS stimulated RAW264.7 cells ##P<0.01 vs control group;**P<0.01 vs LPS group.
2.8 AE-YJ抑制LPS刺激的RAW264.7细胞中MAPK信号通路的激活结果如Fig 9所示。LPS模型组p-ERK、p-p38和p-JNK的蛋白表达明显增加(P<0.01),表明LPS诱导可以激活RAW264.7细胞MAPK途径中的ERK、p38和JNK的磷酸化。与LPS模型组相比,AE-YJ处理后,LPS诱导的RAW264.7细胞中MAPK信号通路的p-ERK、p-p38和p-JNK的表达明显减少(P<0.01)。结果表明AE-YJ的抗炎机制可能与抑制MAPK信号通路的激活有关。AE-YJ也可能是通过抑制MAPK信号通路中ERK、p38和JNK蛋白的激活,并间接影响NF-κB通路的活化,通过MAPK/NF-κB途径发挥抗炎作用。
3 讨论
许多研究已证明,AE在体内外具有多种药理活性[10],其抗炎作用尤为突出[17]。对AE的结构进行了修饰,设计引入含氮基团和哌嗪基团,合成了芦荟大黄素衍生物AE-YJ。在炎症反应中,iNOS和COX-2大量表达并催化产生大量的NO和PGE2。过量的NO又会诱发炎性疾病的发生发展[18]。结果显示AE-YJ可以有效抑制LPS诱导RAW264.7细胞和小鼠腹膜原发性巨噬细胞释放NO。惊喜的是,相较于AE,AE-YJ显示出更为强烈的抑制NO释放的活性。由于化合物直接清除NO也可以造成细胞培养上清中NO含量减少,为检查AE-YJ是否对NO自由基有影响,采用了SNP释放NO的无细胞体系,实验也证明了AE-YJ无直接清除NO的作用(Fig 3)。此外,炎性介质(例如PGE2、TNF-α、IL-6和IL-1β)在炎症疾病的发展中也起着关键作用。实验数据显示AE-YJ可明显降低LPS刺激RAW264.7细胞中PGE2、TNF-α、IL-6和IL-1β(Fig 4)的产生,AE-YJ显示出比AE更好的抗炎活性,AE-YJ更明显的抑制炎性细胞因子释放。这些结果表明,AE-YJ具有抗炎活性,这可能是通过抑制炎性介质的产生而发挥作用。iNOS和COX-2[18]的蛋白表达直接影响NO和PGE2的量。研究结果显示AE-YJ明显抑制iNOS和COX-2的表达(Fig 6)。
Akt是葡萄糖代谢和细胞生长中重要的调节分子,调控细胞周期和细胞增殖。炎症中,Akt的异常表达会促进IκBα的降解,介导NF-κB途径的活化。本研究表明,LPS刺激30 min后,Akt的磷酸化增加,IκBα的降解以及IκBα和p65的磷酸化也明显增加,提示NF-κB的激活明显增加。AE-YJ处理可以有效抑制Akt的磷酸化,明显阻碍IκBα的降解,并明显增加IκBα的表达(Fig 7,8),免疫荧光和蛋白质印迹分析显示p65易位入核减少(Fig 7)进而降低炎性相关蛋白基因的表达。因此,AE-YJ的抗炎机理可能与PI3K-Akt和NF-κB途径有关。AE-YJ通过下调PI3K-Akt/NF-κB途径来抑制炎症介质和促炎细胞因子的表达。除NF-κB外,许多证据表明MAPK途径在炎症反应中也起重要作用。MAPK途径调节细胞的生长周期,调控炎性细胞因子的产生。MAPK途径在NF-κB通路的活化中起着重要作用。研究显示AE-YJ明显降低LPS诱导的p38、ERK和JNK的磷酸化和炎症因子的表达。这可能是AE-YJ通过抑制MAPK信号通路的激活,直接降低炎性细胞因子的释放。也有可能是AE-YJ通过抑制MAPK信号通路的激活,从而影响NF-κB途径的活化。即AE-YJ通过MAPK/NF-κB途径降低炎症因子和炎症相关蛋白基因的产生。因此,AE-YJ可能通过抑制LPS诱导的RAW264.7细胞中的PI3K-Akt/NF-κB 和MAPK/NF-κB途径降低炎性细胞因子PGE2、TNF-α、IL-6以及IL-1β的表达,进而发挥抗炎作用。
Fig 7 Effects of AE-YJ on NF-κB pathway in LPS-stimulated RAW264.7 cells ##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.
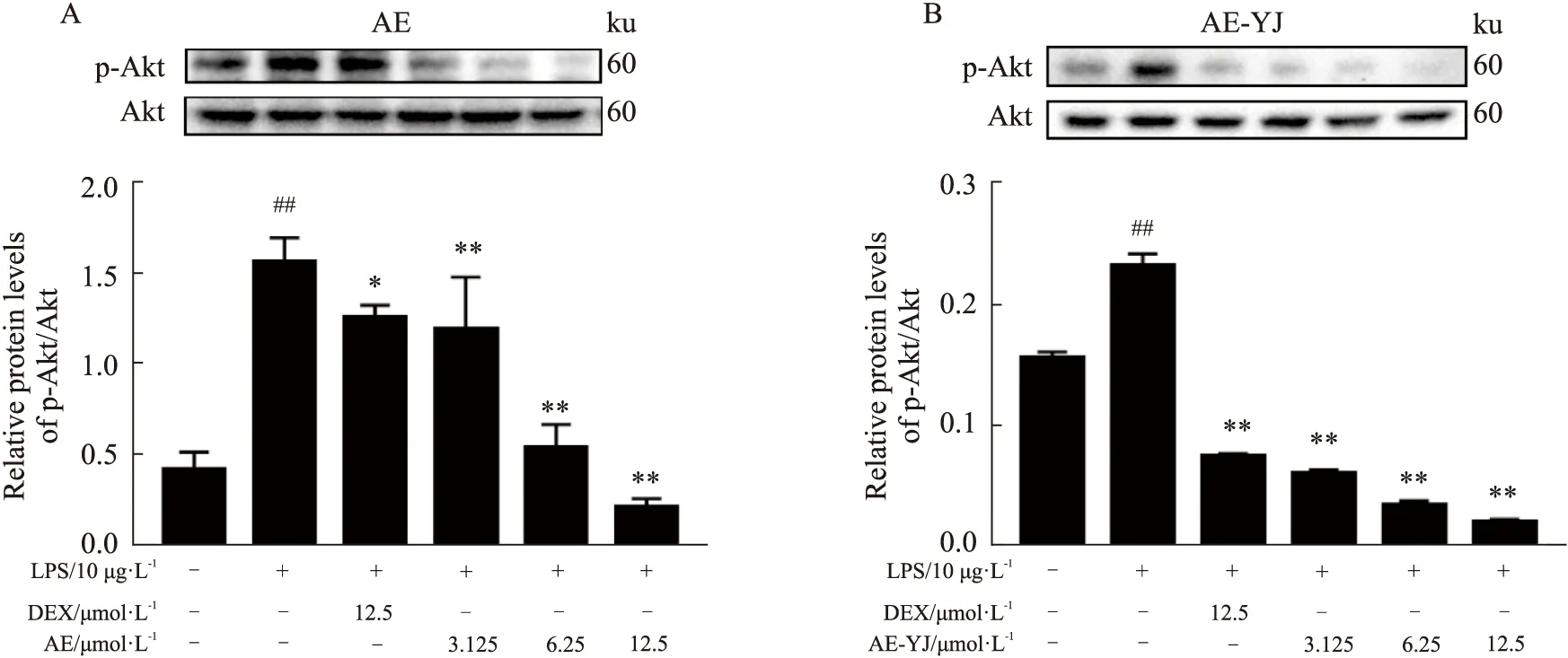
Fig 8 Effects of AE-YJ on PI3K/Akt signaling in LPS-induced RAW264.7 ##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.
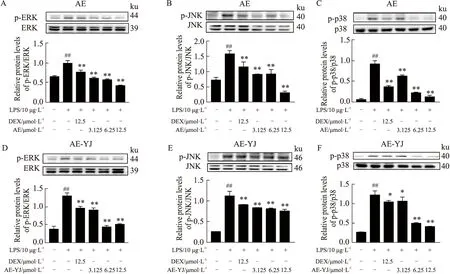
Fig 9 Effects of AE-YJ on MAPK signaling pathway in LPS-induced RAW264.7 ##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.
综上所述,AE-YJ抑制LPS诱导的RAW264.7细胞中NO、PGE2、TNF-α、IL-6和IL-1β的产生,同等剂量下,AE-YJ显示出比AE更强的抗炎活性。AE-YJ的抗炎作用机制可能是通过PI3K-Akt/NF-κB和MAPK/NF-κB途径下调iNOS、COX-2以及IL-6、IL-1β和TNF-α的表达。