血浆抗糖抗体检测在IgA肾病中的作用及其与临床病理指标的相关性
2021-12-16杨钢刘静
杨钢 刘静
作者单位:1.武汉市红十字会医院肾内科,湖北,武汉430000
2.华中科技大学同济医学院附属协和医院肾内科,湖北,武汉430000
IgA肾病是最为常见的一种原发性肾小球疾病。IgA肾病四重打击学说指出IgA肾病主要病理特征为铰链区O 糖的半乳糖缺陷型IgA1 在肾小球系膜中与特定受体相互作用,通过激活补体或成为自身免疫应答抗IgA 的靶点而沉积在肾小球膜中,诱导活化肾小球系膜基质使基质合成增加,损伤细胞;同时半乳糖缺陷型IgA 通过与RR Fcα/γ 相互作用,激活循环淋巴细胞和单核细胞,增强其对肾小球膜细胞的趋化作用,引起炎症浸润,持续损伤间质,最终导致肾脏损伤和疾病进展[1-2]。然而该学说仍缺乏广泛的证据支持,尤其是抗糖抗体在IgA肾病中的作用有待进一步探究。因此,本研究通过抗糖抗体测定探讨抗糖抗体检测在IgA肾病中的作用及其与临床病理指标的相关性。
1 资料与方法
1.1 一般资料
纳入2018年3月至2020年4月本院收治的IgA肾病患者80 例,为IgA 组,其中男46 例,女34 例,平均年龄(48.13±7.14),BMI 平均指数(26.12±3.10);另选取同期80 例健康人群为对照组,其中男42 例,女38 例,平均年龄(46.18±6.73),BMI 平均指数(25.84±3.27)。两组性别、年龄、BMI 指数、SBP、DBP 比较差异无统计学意义(P>0.05)。所有参与者均已知情并签署同意书。本实验经伦理委员会批准同意。
纳入标准:①所有患者均符合2016年版《原发性IgA肾病诊治循证指南》[3]中IgA肾病的诊断标准;②年龄在18~75 岁之间;③患者依从性好。排除标准:①近1月内服用肾毒性药物者;②合并心、脑等严重的器质性病变者;③其他病因所致的肾脏疾病者;④合并其他自身免疫性疾病或严重感染者;⑤临床资料不完整者。
1.2 方法
1.2.1 半乳糖缺陷IgA1(Gd-IgA1)测定
采用山羊抗人IgA 多克隆抗体F(ab)′2(2.5 mg/L)包被96 孔酶标板,孵育过夜,小牛血清蛋白封闭未结合位点。稀释IgAN 患者血浆,设复孔及空白对照孔。唾液酸酶37℃酶切后,加HPA 与GalNAc 结合,37℃孵育。加HRP 标记生物亲和素,37℃孵育。过氧化物酶底物显色,TMB A 液与B 液以1∶1 混匀,室温下避光显色,1 mol/L H2SO4 终止显色。酶标仪450/570 nm 双波长读数。分别以Gd-IgA1 标准品浓度及相应A 值以Logistic 四参数拟合各自标准曲线,最终求得各样品浓度。将1 μg IgA1 混合物的缺糖IgA1 定义为1 U,最终Gd-IgA1 浓度单位以U/mL 表示。
1.2.2 抗糖抗体测定
抗原制备:分离并纯化患者血浆IgA1,通过细菌培养获得IgA1 特异性蛋白酶HF48;从铰链区237 和238 氨基酸之间切开IgA1 分子,最大程度保留该区Fab 段抗原的完整性,纯化保留Fab-HR抗原。用HAA-Western 印迹法验证纯化的Fab-HR自身抗原存在半乳糖的缺失;IgG 型抗糖抗体测定:采用ELISA 法测定,将Fab-HR 包被酶标板,孵育过夜;加入1∶20 稀释后的标准品血浆,ALP 标记的山羊抗人IgG 抗体检测IgG 型抗糖抗体。酶标仪450 nm 读数,ALP 底物显色液室温避光显色,计算IgG 型抗糖抗体浓度。IgA1 型抗糖抗体测定:采用ELISA 法测定,将Fab-HR 包被酶标板,孵育过夜;加入1∶20 稀释后的标准品血浆;HRP 标记的小鼠抗人IgA1 重链抗体检测IgA1 型抗糖抗体;过氧化物酶底物室温下避光显色;酶标仪450/570 nm双波长读数,计算IgA1 型抗糖抗体浓度。
1.3 IgA肾病病理Lee 分级及牛津分型[4]
Lee 分级:Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级、Ⅴ级。牛津分型:即MEST 分型,系膜细胞增殖积分(M)、节段肾小球硬化或粘连(S)、毛细血管内增生性病变(E)、间质纤维化/肾小球萎缩(T)。
1.4 统计学方法
使用SPSS 22.0 软件进行数据处理,计数资料用n(%)表示,使用χ2检验进行比较;计量资料用()表示,使用t检验进行比较。两变量间进行Pearson 相关分析;采用Logistics 回归方程分析血浆抗糖抗体与临床资料(尿酸、肌酐等)及牛津分析的相关性,绘制受试者工作特征曲线(ROC)分析血浆抗糖抗体指标在早期诊断IgA肾病中的应用价值,P<0.05 表示差异有统计学意义。
2 结果
2.1 IgA 组与对照组患者临床资料比较
两组性别、年龄、BMI 指数、SBP、DBP 比较,差异无统计学意义(P>0.05);肾功能指标以及血浆抗糖抗体指标IgG、IgA1 型抗糖抗体比较,差异有统计学意义(P<0.05)。见表1。
表1 两组患者临床资料比较[n(%),(±s)]Table 1 Comparison of clinical data between the 2 groups[n(%),(±s)]
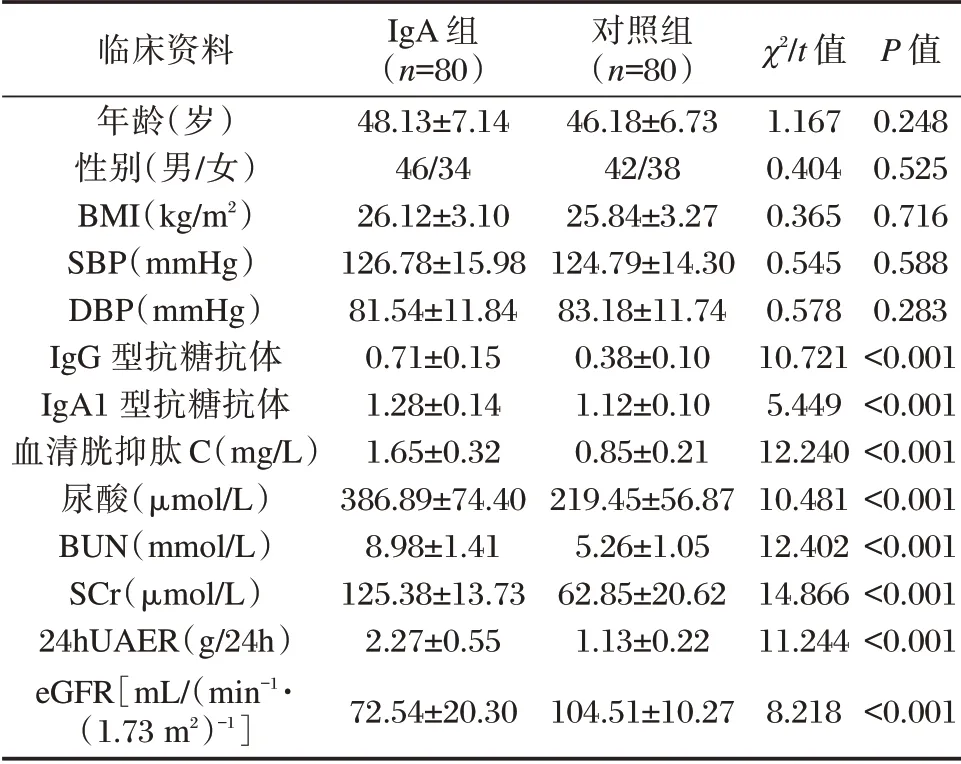
表1 两组患者临床资料比较[n(%),(±s)]Table 1 Comparison of clinical data between the 2 groups[n(%),(±s)]
临床资料年龄(岁)性别(男/女)BMI(kg/m2)SBP(mmHg)DBP(mmHg)IgG 型抗糖抗体IgA1 型抗糖抗体血清胱抑肽C(mg/L)尿酸(μmol/L)BUN(mmol/L)SCr(μmol/L)24hUAER(g/24h)eGFR[mL/(min-1·(1.73 m2)-1]IgA 组(n=80)48.13±7.14 46/34 26.12±3.10 126.78±15.98 81.54±11.84 0.71±0.15 1.28±0.14 1.65±0.32 386.89±74.40 8.98±1.41 125.38±13.73 2.27±0.55 72.54±20.30对照组(n=80)46.18±6.73 42/38 25.84±3.27 124.79±14.30 83.18±11.74 0.38±0.10 1.12±0.10 0.85±0.21 219.45±56.87 5.26±1.05 62.85±20.62 1.13±0.22 104.51±10.27 χ2/t 值1.167 0.404 0.365 0.545 0.578 10.721 5.449 12.240 10.481 12.402 14.866 11.244 8.218 P 值0.248 0.525 0.716 0.588 0.283<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
2.2 血浆抗糖抗体指标与IgA肾病病理分级的相关性
Pearson 的相关分析血浆抗糖抗体指标IgG 型抗糖抗体与IgA肾病病理分级呈正相关(r=0.679,P=0.000),IgA1 型抗糖抗体与IgA肾病病理分级无统计学意义(r=0.272,P=0.051)。见图1。
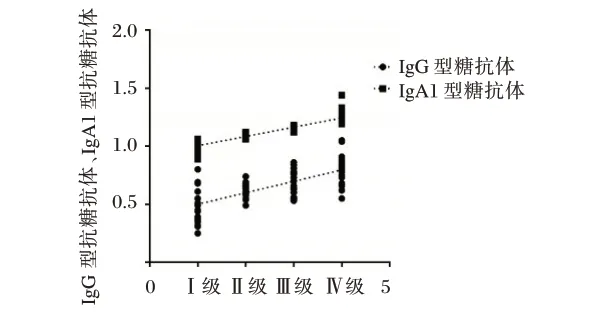
图1 IgG、IgA1 型抗糖抗体与IgA肾病病理分级相关性Figure 1 Correlation between IgG,IgA1 type anti-glycemic antibody and the pathological grade of IgA nephropathy
2.3 血浆抗糖抗体与尿酸的相关性
Pearson 的相关分析提示血浆抗糖抗体指标IgG 型抗糖抗体与尿酸水平呈正相关(R=0.589,P=0.032),IgA1 型抗糖抗体与尿酸水平无统计学意义(R=0.114,P=0.073)。见图2。
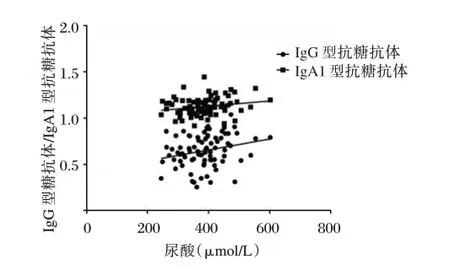
图2 IgG、IgA1 型抗糖抗体与尿酸水平相关性Figure 2 Correlation between IgG-type,IgA1 type antiglycemic antibodies and uric acid levels
2.4 血浆抗糖抗体与牛津分级的相关性
根据IgA肾病牛津分型标准分为M、E、S、T。Pearson 的相关分析提示血浆抗糖抗体指标IgG 型抗糖抗体与IgA肾病牛津分型呈正相关(r=0.752,P=0.024),IgA1 型抗糖抗体与IgA肾病牛津分型无显著相关性(r=0.032,P=0.384)。见图3。
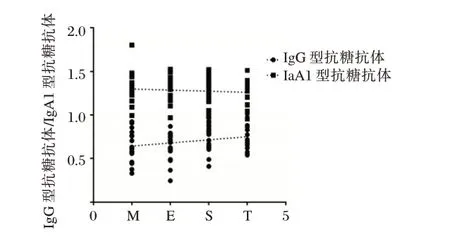
图3 IgG、IgA1 型抗糖抗体与牛津分型相关性Figure 3 Correlation between IgG,IgA1 type anti-glycemic antibodies and Oxford classification
2.5 血浆抗糖抗体指标在早期诊断IgA肾病中的ROC 曲线
血浆IgG 型抗糖抗体诊断IgA肾病的AUC 为0.785(95%CI:0.708~0.862,P<0.05),临界值为0.550,敏感度为90.00%,特异度为65.00%。见图4。
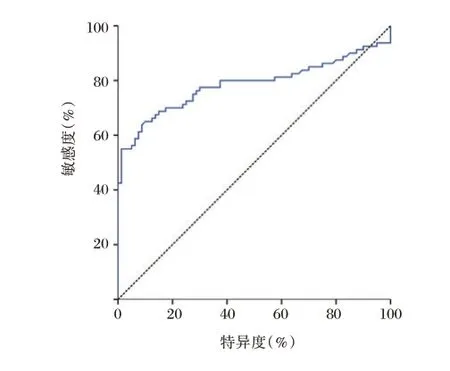
图4 血浆抗糖抗体指标在早期诊断IgA肾病中的ROC 曲线Figure 4 ROC curve of plasma anti-glycemic antibody indicators in the early diagnosis of IgA nephropathy
3 讨论
IgA肾病是一种以IgA 沉积为主的常见肾小球肾炎。IgA肾病患者IgA1 链区氮乙酰半乳糖氨O-糖基化程度降低,引起乙酰半乳糖氨暴露形成异常糖基化IgA1(Gd-IgA1),低糖基化的IgA可作为自身抗原诱导机体产生特异性的IgA1-IgA1 和IgA1-IgG 免疫复合物,抗原、抗体或免疫复合物的形成和自聚集沉积于肾脏损伤肾功能[5-6]。有研究表明[7],二聚体和IgA1 聚合物比单体更易聚集,这可能解释了大分子IgA 在组织中聚集和沉积的倾向。多数学者认为,对特定抗原改变的IgA 免疫反应是导致IgA肾病中形成肾素性IgA 抗体复合物的原因[8]。虽然IgG 型抗糖抗体可能参与了大分子IgA 的形成,但没有直接证据支持这一假设。
现有资料尚不能最终确定IgA肾病IgA 沉积物的来源,但多数认为半乳糖缺陷型IgA 通过与RR Fcα/γ 相互作用,引起IgA 同型转换的TGFβ、促进产生IgA 的激活循环淋巴细胞和单核细胞分化[9];另,IgA肾病系膜细胞增殖和基质扩张,这一过程依赖于IgA 诱导的系膜细胞激活的触发。研究表明[10],IgA 复合物能够激活细胞内钙离子、PLC-γ1 肌醇三磷酸,使蛋白质酪氨酸磷酸化,激活人系膜细胞,使系膜细胞释纤维原性转化生长因子-β、白介素-6 等,介导IgA 产生。在Suzuki[11]的研究中发现IgA肾病单克隆IgG 抗体重链可变区的互补决定区3 区氨基酸由丙氨酸转变为苏氨酸,其与Gd-IgA1 结合力下降,提示该区氨基酸的改变可导致IgG 型抗糖抗体与乙酰半乳糖氨的特异性亲和力提高,增加IgA肾病抗体沉积。
Perše 等[12]人在IgA肾病的肾小球及受损的组织中检测到骨髓Gd-IgA1 受体FcαRI 的信使RNA。Suzuki H[13]的研究中指出,在IgA肾病的白细胞中发现大量的Gd-IgA1 与跨膜FcαRI 结合产生炎症反应,其结合水平与肾小球硬化呈相关性,而在IgA肾病患者表现出局灶节段性肾小球硬化相似的病理损害,推测IgG 型血浆抗糖抗体可能引发局灶性肾小球硬化。同时骨髓IgG 受体FcαRI 可通过启动细胞因子、抗炎因子等机制介导炎症反应,损伤肾功能[14]。另,在血尿酸异常的IgA肾病患者肾小管萎缩和间质纤维化更为严重,同时还可以通过激活RAS 系统引发肾小球损害,证实IgG 型抗糖抗体可能会引发或加重肾脏损害;促进疾病的发展[15]。在补体系统方面IgA 可通过选择性途径和凝集素途径激活该系统,在IgA肾病患者肾系膜区MBL 和MBL 相关丝氨酸蛋白酶与IgA 的沉积支持凝集素通路参与了IgA肾病的进展。有学者[16-17]也证实了在IgA肾病中局部存在肾小球补体活化的作用。提示IgA肾病中IgG可能利用补体的局部激活和系膜细胞的激活促进了肾损害的发生,促进疾病的发展。
综上所述,IgG、IgA1 型抗糖抗体在IgA肾病含量高于健康人群,推测抗糖抗体参与了IgA肾病的发生发展,且IgG 型抗糖抗体明显优于IgA1 型抗糖抗体,并可作为IgA肾病诊断指标。同时本研究的不足之处在于血浆抗糖抗体水平仅代表单个时间点的水平,未对机体抗糖抗体水平进行连续测量,另外由于样本量较少且来源较单一,会影响研究结果,因此后期我们将进行大样本、多中心、连续时间点的研究。
