PBMC中PD-L1、HLA-B、MRP5在晚期乳腺癌放疗过程中的动态表达及意义
2021-12-16寸倩滢张思荣唐恩跃
寸倩滢 张思荣 唐恩跃
作者单位:保山市人民医院检验科,云南,保山678000
据统计,乳腺癌发生率居于全球范围内女性恶性肿瘤首位,此类患者转移后的5年生存率仅为27%甚至更低[1-2]。近年来,随着放疗技术进展,放疗患者总体生存状况得到显著改善。但肿瘤在分子基因水平方面存在高度异质性,从而导致放疗效果出现明显差异[3]。程序性细胞死亡配体1(Programmed cell death ligand 1,PD-L1)通路在乳腺癌中存在活性,参与免疫介导的细胞凋亡[4]。人类白细胞抗原-B(Human leukocyte antigen-B,HLA-B)缺失表达是多种肿瘤发生的重要因素[5]。研究证实,肿瘤组织中存在多药耐药相关蛋白(Multidrug resistance associated proteins,MRP),其中MBP5 参与肿瘤发生进展,并与肿瘤复发有一定关系[6]。但关于三者在晚期乳腺癌放疗过程中的监测价值仍缺乏循证依据。为此,本研究尝试探究外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)中PD-L1、MRP5、HLA-B 在晚期乳腺癌放疗过程中的动态表达及意义。报告如下。
1 资料与方法
1.1 一般资料
选取保山市人民医院2018年1月至2021年1月122 例晚期乳腺癌患者,其中年龄平均年龄(52.17±7.61)岁;体质量指数平均(22.06±1.81)kg/m2;临床分期:ⅢB 期72 例,Ⅳ期50 例。纳入标准:均经病理检查证实为乳腺癌;均具备放疗指征;患者及家属均知情,签订知情同意书。排除标准:参与本研究前接受抗肿瘤、免疫抑制治疗者;伴有自身免疫性疾病者;存在急慢性严重感染者;妊娠期、哺乳期女性;合并血液系统疾病者。本研究经本院伦理委员会审批通过。
1.2 方法
1.2.1 治疗方法
所有患者均行放疗,采用直线加速器6 MVX射线与9 MEV 电子线,根据肿瘤分期、病理类型[7]等确定放疗区域,照射剂量为2 Gy/次,5 次/周,总量直至50 Gy。以21 d 为1 个疗程,共放疗2 个疗程。放疗结束后4 周评估疗效,肿瘤病灶完全消失,持续时间≥4 周为完全缓解;肿瘤病灶缩小幅度≥50%,且持续时间≥4 周为部分缓解;介于部分缓解与进展之间为稳定;肿瘤病灶增大幅度≥25%为进展。将完全缓解、部分缓解纳入有效组,稳定、进展纳入无效组[8],分为有效组(74 例)与无效组(48 例)。
1.2.2 检测方法
采集静脉血30 mL,肝素抗凝,采用Hark's 液稀释1 倍,缓慢加到NycoprepTM1.077A 人淋巴细胞分离液上,离心处理,2 000 r/min,离心20 min 离心半径(13.5 cm),吸取中间白膜层,提取PBMC。采用Trizol 裂解PBMC,提取总RNA,逆转录为cDNA,采用Real-time PCR Master Mix kit 进行实时荧光定量聚合酶链反应(Real time fluorescent quantitative polymerase chain reaction,RT-qPCR)检测,引物由广州伯信生物科技有限公司合成,反应条件:95℃60 s,95℃15 s,40 个循环,60℃60 s。采用△△Ct 法相对定量分析PBMC中PD-L1、MRP5、HLA-BmRNA 表达量。
1.3 统计学方法
采用统计学软件SPSS 22.0 处理数据,计量资料均确认具备方差齐性且近似服从正态布,以()描述,多组间比较采用单因素方差分析,进一步两两组间比较采用LSD-t 检验,两组间比较采用独立样本t检验;计数资料用n(%)表示,χ2检验;相关性分析采用Spearman/Pearson 相关系数模型;预测价值采用受试者工作特征(ROC)曲线分析,获取曲线下面积、置信区间、敏感度、特异度及截断值,联合诊断实施Logistic 二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。P<0.05 表明差异有统计学意义。
2 结果
2.1 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA水平比较
放疗1 个疗程、放疗结束后PBMC中PD-L1、MRP5mRNA水平低于放疗前,HLA-BmRNA 高于放疗前(P<0.05)。见表1。
表1 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA水平比较(±s)Table 1 Comparison of PD-L1,HLA-B and MRP5 mRNA in PBMC before and after radiotherapy(±s)
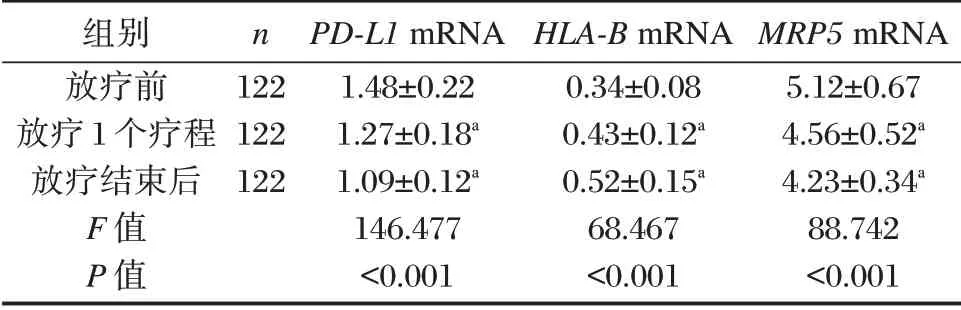
表1 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA水平比较(±s)Table 1 Comparison of PD-L1,HLA-B and MRP5 mRNA in PBMC before and after radiotherapy(±s)
注:与放疗前比较,aP<0.05。
组别放疗前放疗1 个疗程放疗结束后F 值P 值n 122 122 122 PD-L1 mRNA 1.48±0.22 1.27±0.18a 1.09±0.12a 146.477<0.001 HLA-B mRNA 0.34±0.08 0.43±0.12a 0.52±0.15a 68.467<0.001 MRP5 mRNA 5.12±0.67 4.56±0.52a 4.23±0.34a 88.742<0.001
2.2 两组放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA及差值
有效组放疗1 个疗程、放疗结束后PBMC中PD-L1、MRP5mRNA水平低于无效组,HLA-BmRNA水平高于无效组,放疗前与放疗结束后PBMC中PD-L1、MRP5、HLA-BmRNA 差值绝对值高于无效组(P<0.05)。见表2。
表2 两组放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA 表达量及差值比较(±s)Table 2 Comparison of PD-L1,HLA-B,MRP5 mRNA and difference between two groups before and after radiotherapy(±s)
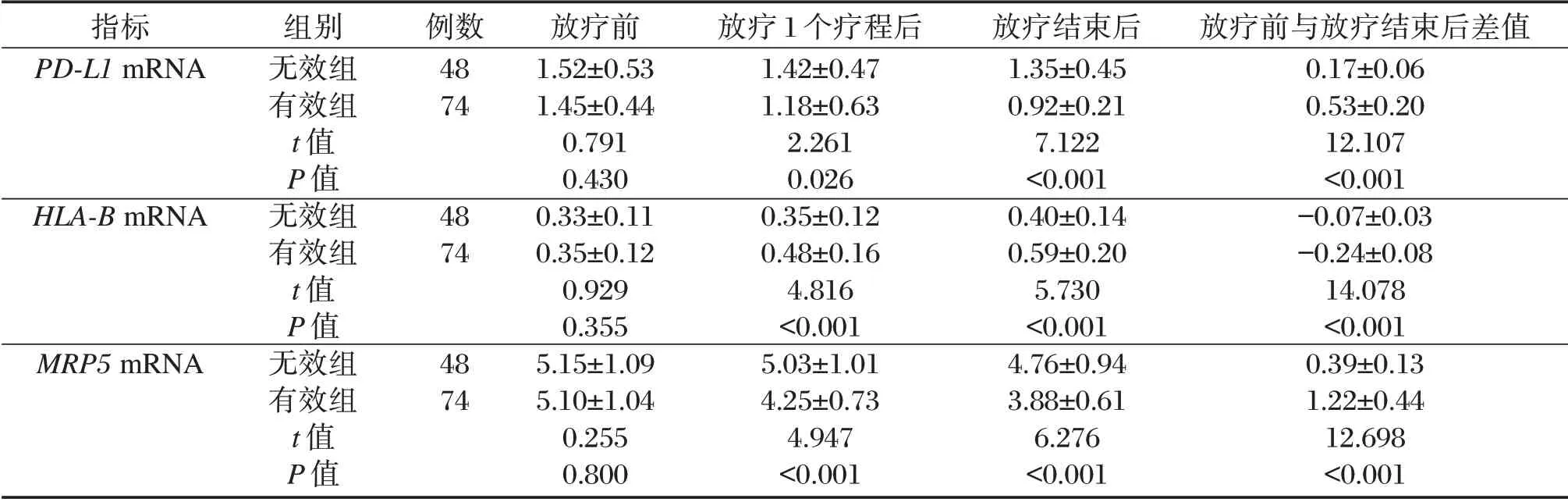
表2 两组放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA 表达量及差值比较(±s)Table 2 Comparison of PD-L1,HLA-B,MRP5 mRNA and difference between two groups before and after radiotherapy(±s)
指标PD-L1 mRNA HLA-B mRNA MRP5 mRNA组别无效组有效组t 值P 值无效组有效组t 值P 值无效组有效组t 值P 值例数48 74 48 74 48 74放疗前1.52±0.53 1.45±0.44 0.791 0.430 0.33±0.11 0.35±0.12 0.929 0.355 5.15±1.09 5.10±1.04 0.255 0.800放疗1 个疗程后1.42±0.47 1.18±0.63 2.261 0.026 0.35±0.12 0.48±0.16 4.816<0.001 5.03±1.01 4.25±0.73 4.947<0.001放疗结束后1.35±0.45 0.92±0.21 7.122<0.001 0.40±0.14 0.59±0.20 5.730<0.001 4.76±0.94 3.88±0.61 6.276<0.001放疗前与放疗结束后差值0.17±0.06 0.53±0.20 12.107<0.001-0.07±0.03-0.24±0.08 14.078<0.001 0.39±0.13 1.22±0.44 12.698<0.001
2.3 PBMC中PD-L1、HLA-B、MRP5 mRNA 放疗前与放疗结束后差值相关性
Pearson 相关性分析,PBMC中PD-L1、HLA-B、MRP5mRNA水平放疗前与放疗结束后差值绝对值呈正相关(r=0.632、0.650、0.731,P均<0.05)。
2.4 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA 差值与疗效的关系
Spearman 相关性分析,放疗前与放疗结束后PBMC中PD-L1、MRP5、HLA-BmRNA 差值绝对值与疗效呈正相关(r=0.711、0.726、0.803,P<0.05)。
2.5 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA水平差值对疗效的预测价值
以无效组作为阳性样本,有效组作为阴性样本,绘制ROC 曲线,结果显示,放疗前与放疗结束后PBMC中PD-L1、HLA-B、MRP5mRNA 差值绝对值预测疗效的AUC 分别为0.896、0.901、0.908,联合预测疗效的AUC 为0.951,95%CI 为0.906-0.996,敏感度为91.67%,特异度为91.89%,优于各指标单独预测,见表3、图1。

图1 ROC 曲线图Figure 1 ROC curve
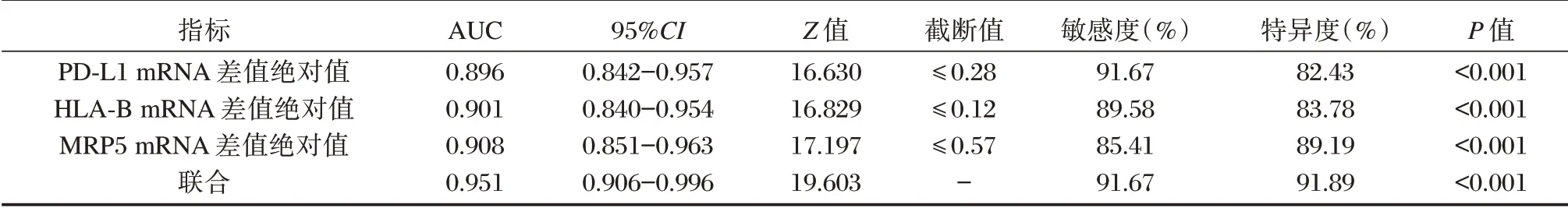
表3 放疗前后PBMC中PD-L1、HLA-B、MRP5 mRNA 表达量差值对疗效的预测价值Table 3 the predictive value of PD-L1,HLA-B,MRP5 mRNA difference in PBMC before and after radiotherapy for curative effect
3 讨论
近年来,临床在乳腺癌筛查、治疗及生存方面取得较大进展,但乳腺癌仍是45 岁以下女性最主要的癌症死因。放疗在减少乳腺癌术后复发、改善预后方面具有重要作用。但临床实践证实,即使临床病理特征相同的乳腺癌患者在接受相同放疗方案治疗后,效果也会存在差异[9]。因此,在放疗期间监测相关指标变化情况成为临床预测放疗效果、调整治疗方案的重要途径。
PD-L1 通路在多种癌症中均扮演活跃的免疫检查点的角色。PD-L1 作为一种跨膜蛋白,能够结合活化细胞毒性T 细胞表面表达的PD-1 受体,阻滞T 细胞活化及下游信号转导,抑制CD3/CD28 介导的T 细胞转录过程,从而促使肿瘤细胞逃避T 淋巴细胞的杀伤作用,进而加快肿瘤细胞生长、增殖。本研究发现,乳腺癌患者放疗后PBMC中PD-L1mRAN 较治疗前明显下降,主要是由于PD-LI 通路在参与肿瘤发生发展过程中会引起葡萄糖代谢、蛋白激酶的激活、磷脂酰肌醇激酶的磷酸化等一系列生化反应,而放疗过程中细胞代谢通路广泛参与免疫识别与凋亡细胞的清除,导致PD-L1 表达下调[10]。乳腺癌肿瘤细胞会表达过多的PD-L1,降低其免疫原性,导致机体无法产生充足的抗肿瘤免疫效应,造成肿瘤细胞成功逃避宿主免疫系统监视,发生肿瘤免疫逃逸,而放疗后肿瘤细胞被杀伤杀灭,PD-L1 表达便随之下调[11]。故临床可通过监测放疗期间PD-L1 变化情况及早预测放疗效果。
HLA-B 是HLA-Ⅰ类分子中最主要的因子之一,广泛分布于所有有核细胞表面,此类因子属于机体免疫的核心,不仅可参与免疫应答遗传调控、调节全身免疫状态,还是影响免疫识别的主要因素,在肿瘤发生时表达降低或缺失。Tevis SE 等[12]报道证实,乳腺间变性大细胞淋巴瘤患者HLA-B表达明显减少,在肿瘤发生过程中发挥重要作用。本研究则表明,与放疗前相比,乳腺癌患者放疗后PBMC中HLA-BmRNA 明显升高,且其放疗前后的变化差值与放疗疗效密切相关。究其原因,PBMC 是重要的抗原递呈细胞,宿主PBMC中HLA-B 的表达不仅代表的是宿主的免疫特性,还可呈现肿瘤特性,是细胞毒性T 细胞识别肿瘤细胞的关键,其表达量下调被认为是肿瘤细胞逃逸的重要机制之一[13]。因此,临床可根据PBMC中HLA-B 表达情况评估患者机体细胞免疫情况及肿瘤特性,为制定个体化放疗方案提供可靠依据。
报道显示,炎症除了是肿瘤发生的影响因素之外,还可改变药物转运蛋白表达及活性,促使肿瘤对放化疗产生耐药性,成为肿瘤放化疗失败的重要原因[14]。MPR5 是临床常见的多药耐药相关蛋白之一,其表达上调可能是由于肿瘤患者外周血中的促炎介质与PBMC 表面相应受体结合的结果。在此基础上,本研究结果显示,PBMC中MPR5mRNA 放疗后呈下降趋势,其中放疗无效组虽有下降但并不明显,放疗有效组下降较为显著,出现这种现象的原因是放疗虽可杀伤杀灭肿瘤细胞,但也会一定程度损伤正常细胞,破坏其细胞结构,导致促炎因子释放并介导炎症反应,激活NF-κB,释放相关因子改变MRP5 活性功能与表达情况,并将输入的抗逆转录病毒从细胞中泵出,从而引发耐药效应[15]。提示监测其在放疗过程中的变化情况是及早预测放疗疗效的重要途径。
此外,在上述研究基础上,本研究初次尝试探究放疗前后PBMC中PD-L1、MRP5、HLA-BmRNA差值联合预测放疗疗效的价值,结果显示,三者联合预测的AUC 高达0.951,为临床早期预测放疗疗效、调整放疗方案提供新思路、新途径,有利于提高疗效,改善预后。但本研究属于单中心、小样本分析,可能造成数据偏移,需做进一步分析与探究。
综上可知,晚期乳腺癌放疗过程中动态监测PBMC中PD-L1、MRP5、HLA-BmRNA 变化情况能作为临床预测疗效的潜在途径,有助于及时调整放疗方案、提高疗效。
